ФХ экз. Теоретические экз вопросы по фх
 Скачать 1.77 Mb. Скачать 1.77 Mb.
|
|
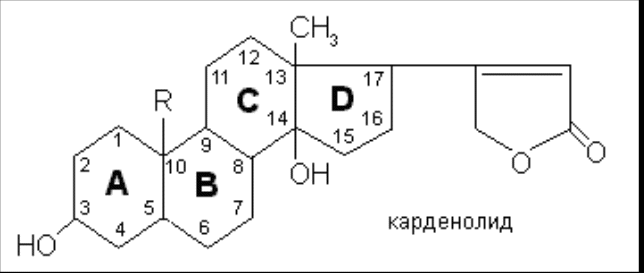
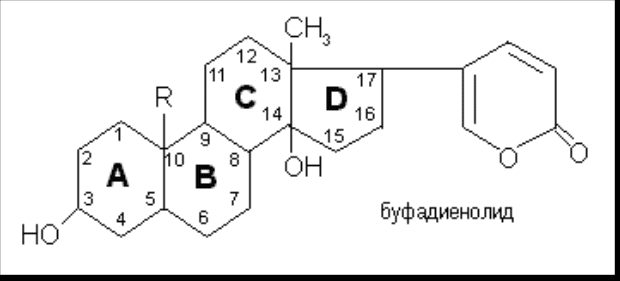
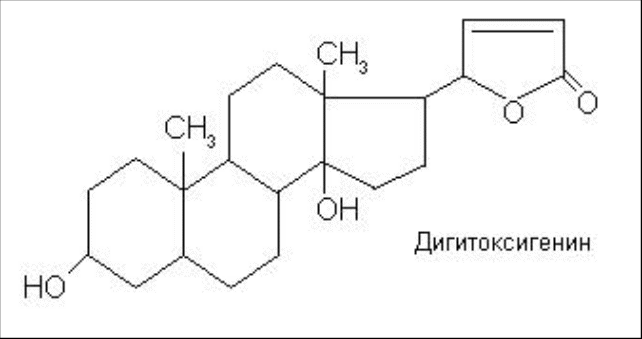
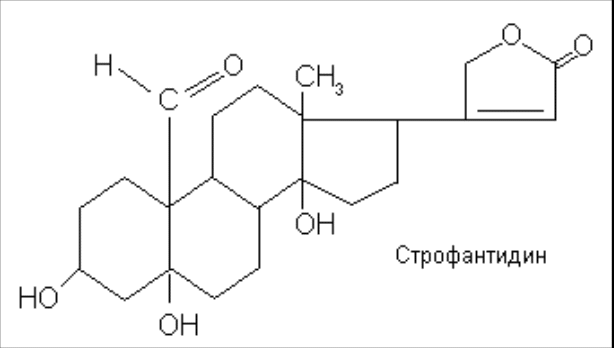
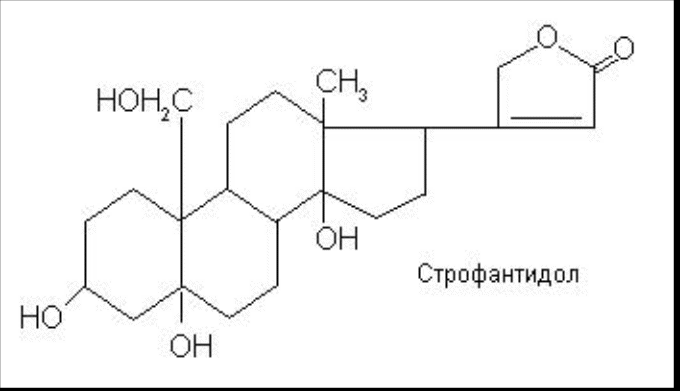
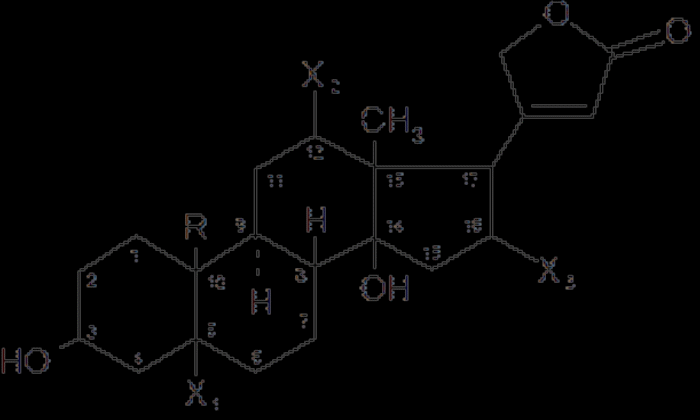
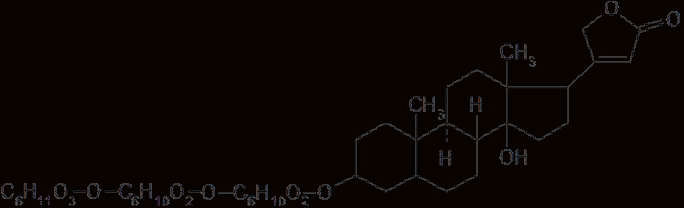
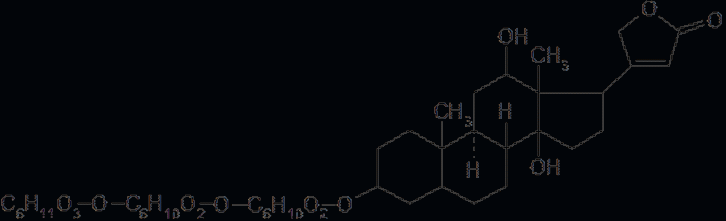
Мезатон (фенилэфрина гидрохлорид) (ГФ 10). 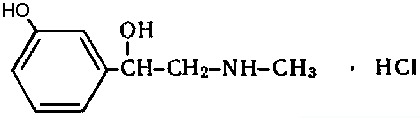 Реакции подлинности: 1) комплексообразование с CuSO4(сине-фио) и FeCl3(фио). 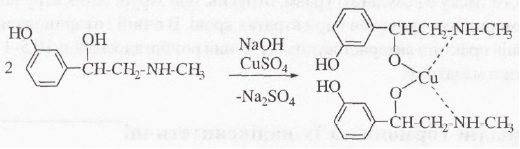 2) Реакции на хлориды. Количественное: 1) обратная броматометрия (ГФ 10). F=1/6. Титрант – бромат калия. Инд – крахмал. 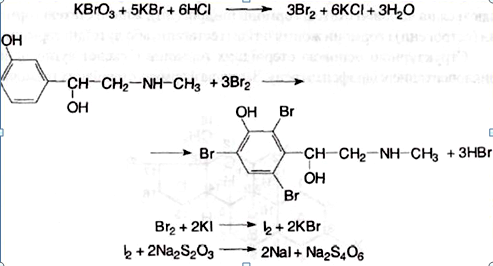 2) Аргентометрия. 3) Алкалиметрия по связанной HCl. Анаприлин. (пропранолола гидрохлорид) 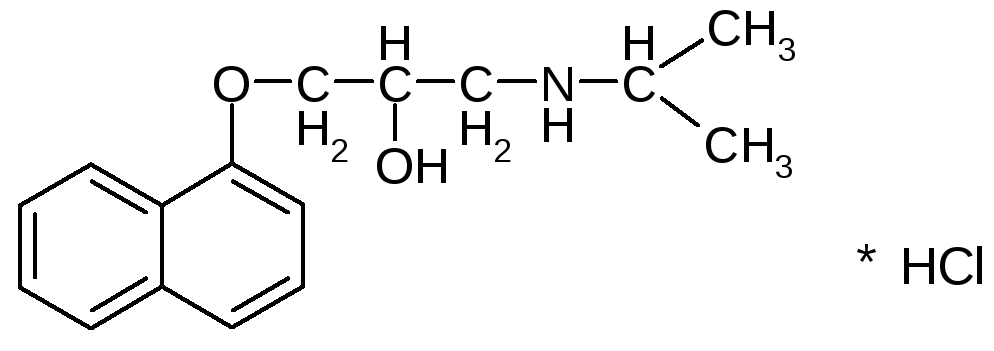 Подлинность: ЛВ - соль, поэтому можно вытеснить слабое органич. основание в виде белого осадка сильным основанием NaOH. + реакции на хлориды. Количественное: Алкалиметрия по связанной HCl. Аргентометрия по Cl-иону. Атенолол (ГФ 13).  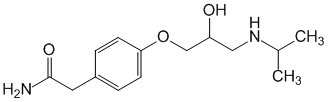 Подлинность: ИК УФ Остаточные органические растворители. Газовая хроматография. Микробиологическая чистота. Инкубации посевов на питательных средах для бактерий. Количественное определение. Неводное КОТ. Хлорная к-та. Среда – лед. уксус. к-та. ТЭ определяют потенциометрически (регистрации изменения потенциала индикаторного электрода в процессе титрования в соответствии с изменением концентрации титруемого вещества в процессе прибавления титранта). 4. Биохимическая роль стероидов в организме как предпосылка для получения ЛВ. Классификация и номенклатура. Источники получения. Условное наименование циклов и веществ. Особенности строения, стереохимия и биологическая активность стероидных соединений. Общие физические и химические свойства. Методы анализа соединений стероидной структуры. Фармакопейный анализ ЛВ данной группы. Стероиды – вещества животного, реже растительного происхождения, обладающие высокой биологической активностью. Стероидные гормоны контролируют основные процессы жизнедеятельности, влияют на все виды обмена веществ, рост и развитие организма, половую функцию. Выделяют стероиды из спинного мозга и желчи рогатого скота, щелочного гидролизата дрожжей, растительных масел и животных жиров, отходов целлюлозо-бумажного производства, различных растений или синтезируют из неприродного сырья. Синтетических аналоги природных стероидных горомнов получают промышленном способом, модифицируя структуру природных гормонов. Стероидные гормоны являются производными ряда углеводородов, главным образом прегнана, андростана и эстрана. Все стероидные гормоны по своей структуре являются производными циклопентанпергидрофенантрена. Для природных стероидов характерно присутствие гидроксильной группы или кетогруппы в положении 3 и боковой цепи или кислородной функции в положении 17. Метильные группы, присоединенные к стероидному циклу в положении 10 и 13, называются ангулярными. Радикал R и атомы водорода (в положении 8, 9, 14) ориентированы в пространстве в цис- или транс-положении. Условно принято считать, что ангулярные метильные группы расположены над плоскостью чертежа (это обозначают сплошной линией). Если другие заместители находятся в цис-положении, т. е. в одной плоскости с ангулярными группами, то их также обозначают сплошной линией, а если в транс-положении, то пунктирной линией. 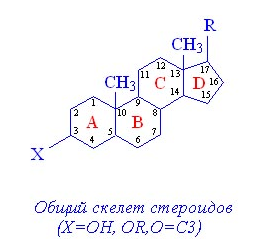 Классификация стероидных горомонов По химической структуре выделяют Кортикостероиды (производные прегнана), Гестагены (производные прегнана), Андрогены (производные андростана), Эстрогены (производные эстрана). Кортикостероиды подразделяются на минералокортикоиды, которые регулируют в основном минеральный обмен (альдостерон, дезоксикортикостерон), и глюкокортикоиды, влияющие на углеводный и белковый обмен (преднизолон, гидрокортизон). Стероидный цикл и различные функциональные группы влияют на физико-химические свойства гормонов. На использовании этих свойств основаны способы определения подлинности и количественного определения. При испытании на подлинность для подтверждения стероидного цикла используют реакцию с конц.серной кислотой – образуются окрашенные или флуоресцирующие соединения. Спиртовой и фенольный гидроксилы открывают с помощью реакции этерификации – образуются эфиры, у которых определяют температуру плавления. Фенольный гидроксил можно так же открыть по реакции образования азосоединений. Сложноэфирную группу подтверждают по образованию солей гидроксамовых кислот (окрашенные) или по реакции гидролиза в щелочной или кислой среде. Количественное определение проводят титрометрическим или фотоколориметрическим способом, используя для этого различные цветные реакции. Кроме этого для качественного количественного определения используют УФ-спектрофотометрию. 5.Карденолиды (гликозиды сердечного действия). Химия карденолидов, их классификация. Связь между строением и биологическим действием, роль стерических факторов. Соединения ряда дигитоксигенина: дигитоксин, ацетилдигитоксин, дигоксин. Строфантин. Гликозиды ландыша: коргликон. Биологические и физико-химические методы количественной активности гликозидов. Фармакопейный анализ данной группы ЛВ.
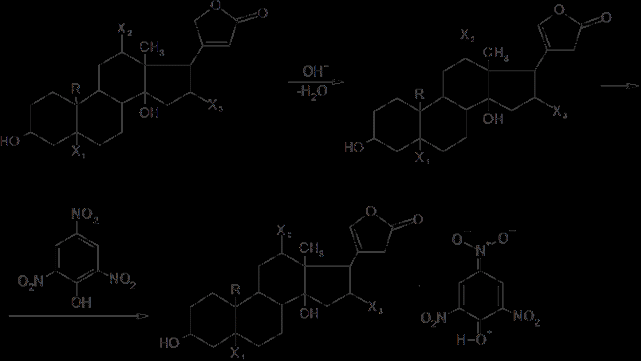
6. Современное состояние и развитие химии кортикостероидов как ЛВ. Биохимические предпосылки получения ЛВ группы кортикостероидов. Зависимость между строением и биологической активностью. Минералкортикостероиды и глюкокортикостероиды. Дезоксикортикостерона ацетат, кортизона ацетат, гидрокортизон и преднизалон. Фторзамещенные соединения: дексаметазон. Сложные эфиры стероидов. Получение. Фармакопейный анализ. . Гормоны коркового слоя надпочечных желез (кортикостероиды) являются производными кортикостерона, структура которого включает углеводород прегнан: 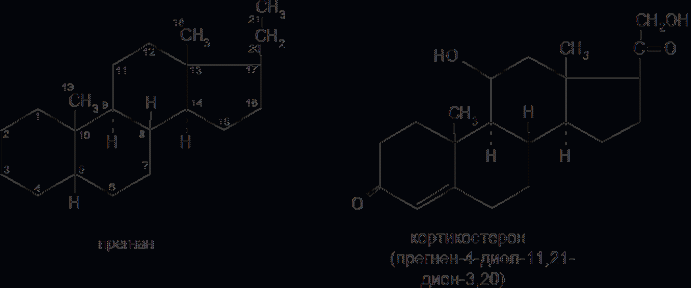 По действию на организм кортикостероиды условно делят на две группы: минералокортикостероиды и глюкокортикостероиды. Первая из них активно регулирует минеральный обмен и слабо влияет на углеводный и белковый обмен. Вторая группа, наоборот, активно регулирует углеводный и белковый обмен и слабо влияет на минеральный. Из минералокортикостероидов наиболее широко применяют дезоксикортона ацетат, а из глюкокортикостероидов — кортизона ацетат, гидрокортизона ацетат, его полусинтетический аналог — преднизолон, а также галогенопроизводные преднизолона. Источниками получения более 40 кортикостероидов служат надпочечные железы убойного скота. Исходными продуктами их синтеза могут быть природные вещества стероидной структуры (диосгенин, стигмастерин), а также холестерин, который считают предшественником кортикостероидов в организме. Лекарственные вещества гормонов коры надпочечников и их синтетических аналогов представляют собой белые кристаллы, имеющие желтоватый или кремоватый оттенок. Они практически нерастворимы в воде. Дезоксикортона ацетат и преднизолон умеренно растворимы в этаноле, а кортизона и гидрокортизона ацетаты очень мало в нём растворимы. Гидрокортизона ацетат мало растворим, а преднизолон очень мало растворим в хлороформе. Дезоксикортона ацетат и кортизона ацетат легко растворимы в хлороформе. Химические свойства кортикостероидов определяются наличием a,b-ненасыщенной кетонной группировки в кольце А и a-кетольной группировки в боковой цепи кольца D. Кетогруппа и гидроксил в положении 11 из-за стерических препятствий довольно инертны (не образуют гидразонов, семикарбазонов, не ацилируются). В испытаниях, рекомендуемых для оценки качества кортикостероидов и их аналогов, много общего. При нагревании на водяной бане смеси спиртового раствора кортикостероида и реактива Фелинга выпадает красно-оранжевый осадок. Реакция обусловлена восстановительными свойствами a-кетольной группировки, которая легко окисляется до карбоксильной: 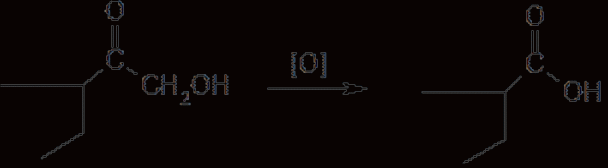 В присутствии реактива Фелинга:  Восстанавливающие свойства a-кетольной группы лежат в основе реакции «серебряного зеркала», которое образуют ряд кортикостероидов (кортизона ацетат, гидрокортизон, преднизолон): 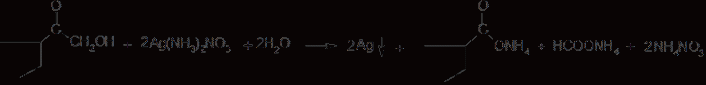 Кортикостероиды, содержащие a-кетольную группу (кортизон и его аналоги), дают цветную реакцию, основанную на окислении 0,5%-ным раствором хлорида трифенилтетразолия в этаноле в присутствии 10%-ного раствора гидроксида тетраметиламмония. Появляется красная окраска, обусловленная образованием формазана: 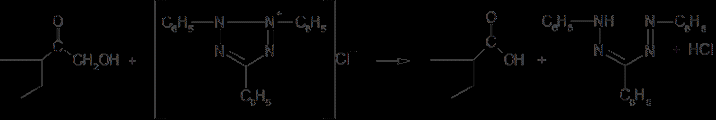 Кортикостероиды можно отличать друг от друга с помощью реакций на те или иные функциональные группы. При нагревании на водяной бане спиртовых растворов лекарственных веществ с раствором фенилгидразина появляется желтое окрашивание. Реакция обусловлена образованием фенилгидразона (с кетонной группой в положении 3) и на примере кортизона ацетата происходит по схеме 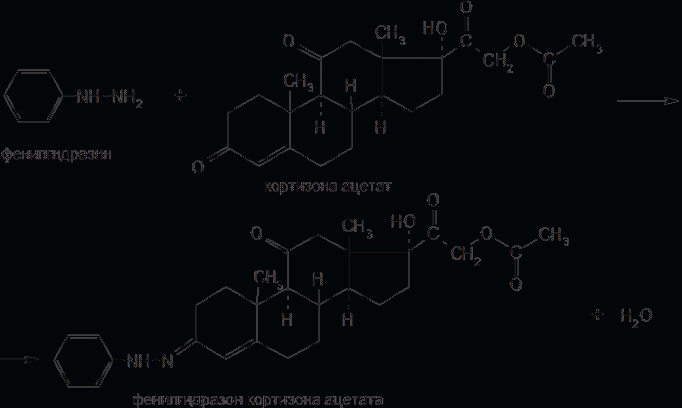 Для идентификации лекарственных веществ, представляющих собой сложные эфиры, использована реакция получения ацетогидроксамовой кислоты, которая затем с солями железа (III) образует соединения, окрашенные в темно-вишневый (кортизона ацетат) или красно-коричневый (дезоксикортона ацетат) цвет: 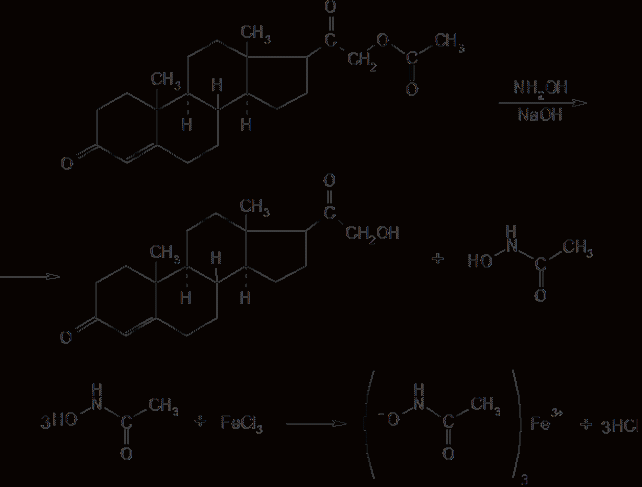 Ацетильную группу можно обнаруживать после гидролиза кортизона и гидрокортизона ацетатов в спиртовом растворе гидроксида калия. Последующее прибавление концентрированной серной кислоты приводит к образованию этилацетата, имеющего характерный запах. Эта реакция рекомендована ФС для испытания на подлинность гидрокортизона ацетата: 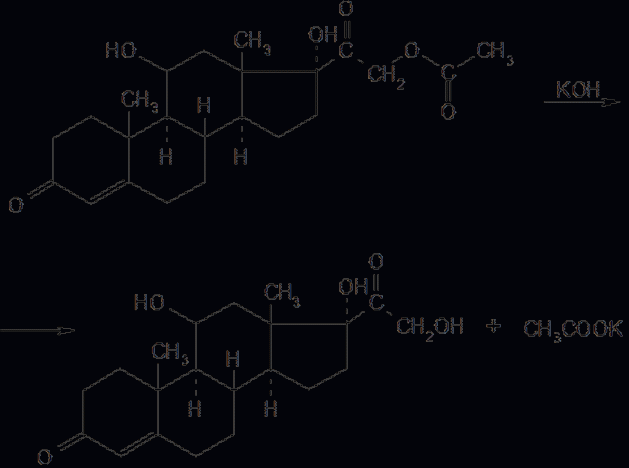 2CH3COOK + H2SO4 + 2C2H5OH ¾® 2CH3COOC2H5 + K2SO4 + 2H2O. Для качественного и количественного анализа кортикостероидов и их аналогов используют спектрофотометрию в УФ-области. Расчёт содержания лекарственного вещества выполняют по удельному показателю поглощения или (преднизолон) по оптической плотности.В результате исследования влияния галогенов, введенных в молекулу кортикостероидов, на их фармакологическую активность были синтезированы моно- и дифторпроизводные преднизолона. Они содержат в положении 9 один атом фтора — дексаметазон 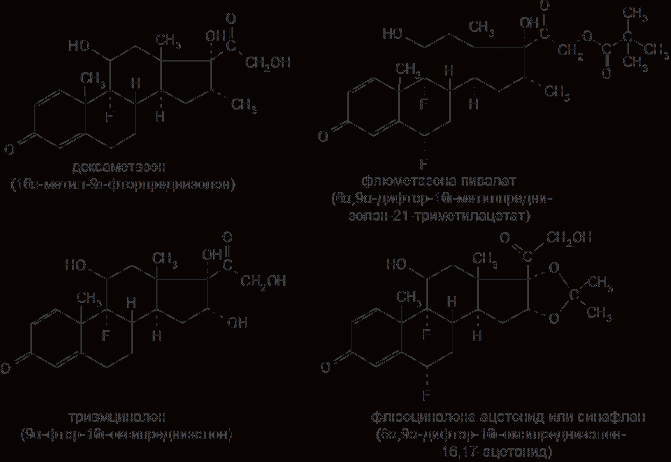 | ||||||||||||||||||||||||||||||||||||||||||||||||||