Теория занятия спирты общая характеристика
 Скачать 1.22 Mb. Скачать 1.22 Mb.
|
|
Теория занятия: СПИРТЫ Общая характеристика: - Это производные углеводородов, содержащие одну или несколько ОН-групп у атома С (в sp3-гибридизации). - Общая формула гомологического ряда предельных одноатомных спиртов — CnH2n+1OH. Строение спиртов - Спирты геометрически подобны молекуле воды. Угол R−O−H в молекуле метанола равен 109°. Гидроксильный кислород находится в состоянии sp³ гибридизации:  Классификация спиртов: 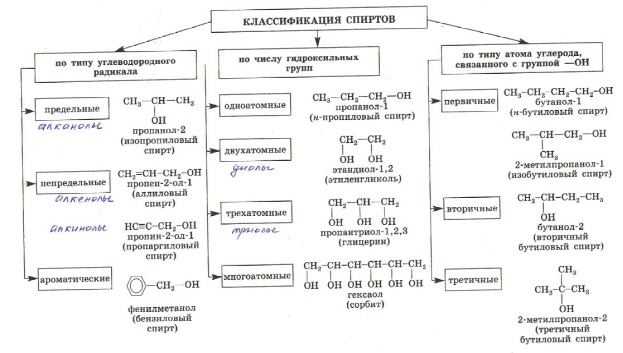 Изомерия: - Изомерия углеродного скелета: СН3-СН2-СН2-СН2-ОН – бутанол-1 СН3-СН2-СН-ОН - 2-метилпропанол-1 | СН3 - Изомерия положения ФГ (–ОН): СН3-СН2-СН2-ОН –пропанол-1 СН3-СН-СН3 – пропанол-2 | ОН - Межклассовая изомерия: Спирты изомерны простым эфирам R –O – R1 С3Н8О С3Н7ОН СН3 – О – С2Н5 пропанол метилэтиловый эфир Номенклатура: - Названия спиртов образуют, добавляя окончание -ол к названию углеводорода с самой длинной углеродной цепью, включающей гидроксильную группу. - Нумерацию цепи начинают с того края, ближе к которому расположена гидроксильная группа. - Цифрой указать положение группы -ОН Заместительная номенклатура: - название спирта производится от соответствующего углеводородного радикала с добавлением, слова "спирт", например: СН3ОН - метанол, метиловый спирт C2H5OH - этанол, этиловый спирт С3Н7ОН – пропанол, пропиловый спирт С4Н9ОН – бутанол, бутиловый спирт С5Н11ОН – пентанол, амиловый спирт Физические свойства: - Низшие спирты (до C15) — жидкости, высшие — твердые вещества. - Метанол и этанол смешиваются с водой в любых соотношениях. С ростом молекулярной массы растворимость спиртов в воде падает. - По сравнению с соответствующими углеводородами, спирты имеют высокие температуры плавления и кипения, что объясняется сильной ассоциацией молекул спирта в жидком состоянии за счет образования водородных связей. Образование водородных связей: Н3С Н3С Н3С Н3С | | | | О – Н…О – Н … О – Н … О – Н между молекулами спирта R Н R H | | | | О – Н … О – Н …О – Н … O – H между молекулами спирта и воды Химические свойства спиртов: 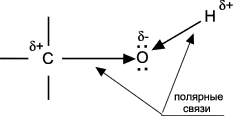 -Химические свойства спиртов определяются присутствием в их молекулах гидроксильной группы -ОН. -Связи С-О и О- Н сильно полярны и способны к разрыву. -Различают два основных типа реакций спиртов с участием функциональной группы –ОН: Реакции с разрывом связи О-Н (здесь проявляются слабые кислотные свойства спиртов) Реакции сопровождающиеся разрывом связи С-О: (здесь проявляются слабые основные свойства спиртов) Спирты являются амфотерными соединениями. Реакции с разрывом связи О-Н: 1. Кислотные свойства спиртов выражены очень слабо. Низшие спирты бурно реагируют со щелочными металлами: 2С2Н5-ОН + 2K→ 2С2Н5-ОK + Н2↑ С увеличением длины углеводородного радикала скорость этой реакции замедляется Спирты не взаимодействуют со щелочами 2. Реакция этерификации протекает с образованием сложных эфиров: СН3-СН2-ОН + СН3СООН Н+, t® СН3СООС2Н5 + Н2О (образуется этиловый эфир уксусной кислоты, этилацетат с приятным запахом) 3. Спирты окисляются под действием сильных окислителей до карбонильных соединений. Первичные спирты окисляются до альдегидов, которые, в свою очередь, могут окисляться до карбоновых кислот: [O] [О] R-CH2-OH → R-CH=O → R-COOH спирт альдегид карбоновая кислота Н Н | / Н-СН -ОН [O], фермент® Н-С=О + Н2 метанол метаналь Н Н | / СН3-СН-ОН [O], фермент® СН3-С=О + Н2 -Вторичные спирты окисляются до кетонов: 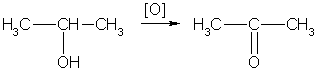 - Третичные спирты могут окисляться только с разрывом С-С связей под действием сильных окислителей, таких как перманганат калия или дихромат калия в кислой среде. Скорость реакций, при которых разрывается связь О-Н, уменьшается в ряду: первичные спирты > вторичные > третичные. Окисление спирта в клетке (дегидрирование): Образование ацетальдегида из этанола катализируется специфическим ферментом алкогольдегидрогеназой, связанной с НАД (кофермент) НАД+ CH3-CH2-OH ® CH3-CH=O + НАД(Н) + Н+ Алькогольдегидрогеназа окисляет и метанол до формальдегида (сильный яд) СН3ОН ® НСН=О +2Н+ Ароматические спирты окисляются подобно спиртам жирного ряда, образуются ароматические альдегиды и кетоны 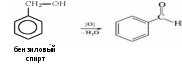 Реакции с разрывом связи С-О: Реакции дегидратации протекают при нагревании спиртов с водоотнимающими веществами. При сильном нагревании происходит внутримолекулярная дегидратация с образованием алкенов: H2SO4,t>140°С СН3-СН2-СН2-ОН → СН3-СН=СН2 + Н2О При более слабом нагревании происходит межмолекулярная дегидратация с образованием простых эфиров: H2SO4,t<140°С 2CH3-CH2-OH → C2H5 – O - C2H5 + H2O Следует напомнить студентам, что образующийся диэтиловый эфир используется для ингаляционного наркоза. Многоатомные спирты: этиленгликоль глицерин и др. примеры (ксилит, сорбит,…) Химические свойства многоатомных спиртов: 1. Многоатомные спирты более сильные кислоты, чем одноатомные спирты. Гликоли и глицерины образуют алкоголяты, аналогично одноатомным спиртам. 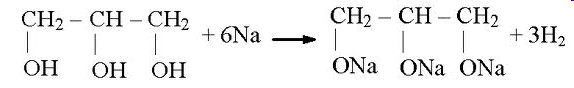 Отличительным свойством является образование соединений типа хелатов с ионами тяжелых металлов. При добавлении Cu(ОН)2 образуется раствор ярко-синего цвета (качественная реакция). 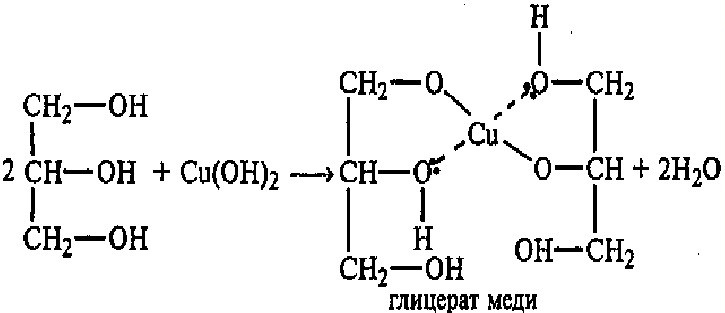 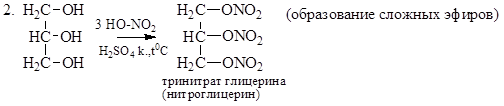 Отдельные представители: Метанол – очень ядовит, в организме под действием ферментов превращается в формальдегид и муравьиную кислоту, которые повреждают сетчатку глаз, вызывают гибель зрительного нерва и полную потерю зрения. Попадание в организм более 50 мл метанола вызывает смерть. Этанол – смешивается с водой в любых соотношениях. В медицине применяются в основном 70% растворы. В малых дозах вызывает расширение кровеносных сосудов. В больших количествах угнетает деятельность головного мозга, вызывает нарушение координации движений. Продукт окисления этанола в организме – ацетальдегид – очень ядовит и вызывает тяжелое отравление. Этиленгликоль – ядовит, неограниченно растворим в воде, замерзает при температуре значительно ниже 00С. Применяется в качестве антифриза для двигателей внутреннего сгорания. Глицерин – неограниченно растворим в воде, сладкий на вкус, входит в состав сложных эфиров, жиров и масел. Используется в косметике, фармацевтической и пищевой промышленности как смягчающее и успокаивающее средство. Нитроглицерин – 1%-ный раствор является мощным средством для расширения сосудов сердца. Входит в состав сердечных препаратов с различными торговыми названиями. Диэтиловый эфир - обладает общеанестезирующим действием. В хирургии - ингаляционный наркоз, в стоматологии - для обработки кариозных полостей и корневых каналов зуба при подготовке к пломбированию. Валидол – раствор ментола в ментиловом эфире изовалериановой кислоты. Применяется при стенокардии и неврозах.  ФЕНОЛЫ Это производные УВ, результат замещения гидроксилом (-ОН) атомов водорода в ядре ароматических УВ. Одноатомные фенолы (аренолы): С6Н5ОН фенол, гидроксибензол, устар. карболовая кислот (5 % раствор в воде — антисептик; основа лекарственных веществ, красителей). Это первый используемый в хирургии антисептик, до сих пор применяется «фенольная шкала» для сравнения антисептических свойств различных веществ). Другие представители: 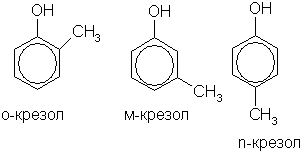 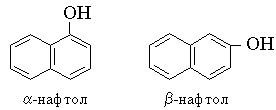 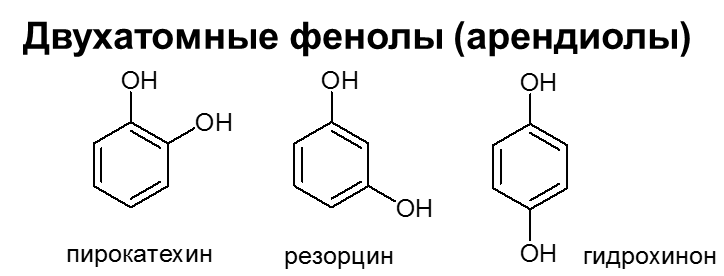 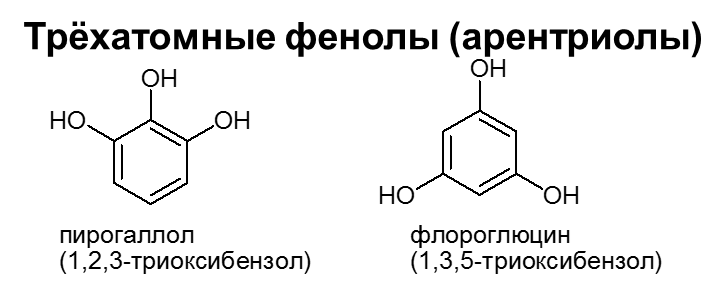 Номенклатура: Заместительная номенклатура: перед названием арена ставится префикс гидрокси- (например, гидроксибензол) при наличии заместителей в ароматическом ядре за родоначальную структуру берут фенол. Тривиальные названия (например, резорцин) Физические свойства: Фенол (карболовая кислота) – бесцветное кристаллическое вещество, трудно растворимое в воде. С увеличением количества ОН-групп растворимость фенолов в воде увеличивается. Окисляется на воздухе до розового цвета. Ядовит, является антисептиком, при попадании на кожу вызывает ожоги. Химические свойства: 1. Фенолы обладают кислотными свойствами. В отличие от спиртов в фенолах увеличивается поляризация связи О - Н 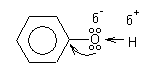 В молекуле фенола неподеленные пары О вступают во взаимодействие (сопряжение) с π-электронами бензольного кольца. В результате поляризация ОН-группы усиливается и отрыв атома Н облегчается. Фенол - слабая кислота, слабее, чем Н2СО3, СН3СООН. 2. Фенолы реагируют со щелочными металлами с образованием фенолятов 2С6H5OH + 2Na → 2С6H5ONa + H2 3. В отличие от спиртов фенолы реагируют со щелочами 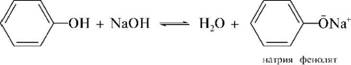 4. О-Ацилирование (этерификация) фенолов: 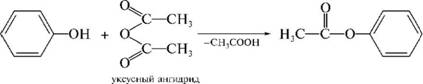 В отличие от спиртов фенолы не этерифицируются непосредственно карбоновыми кислотами. 5. Гидрирование (восстановление) 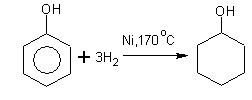 6. Окисление кислородом воздуха 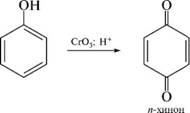 Реакции электрофильного замещения: Реакция бромирования с бромной водой (качественная реакция с образованием белого осадка трибромфенола). 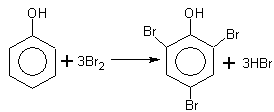 Реакции нитрования разбавленной кислотой 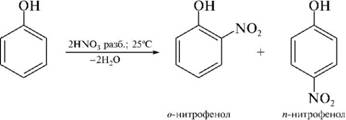 Реакция нитрования концентрированной кислотой 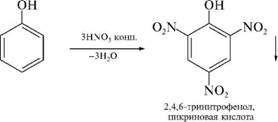 Качественная реакция на фенолы В водных растворах фенол и его производные образуют комплексные соединение с FeCl3, в основном фиолетового цвета. Эта реакция используется фармацевтами для доказательства наличия фенольных фрагментов в молекулах лекарственных средств. Отдельные представители: Фенол вызывает ожоги при попадании на кожу. Ядовит. Раствор называют карболовой кислотой (антисептик). Используется для производства пластмасс, лекарственных средств (салициловая кислота и ее производные), красителей, взрывчатых веществ (пикриновая кислота). Тимол ( п-метилизопропилфенол) - противоглистное средство; антисептическое для дезинфекции полости рта и обезболивания дентина; в фармацевтической промышленности — в качестве консерванта. 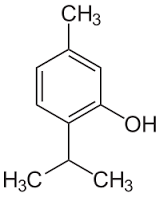 Норадреналин 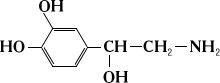 Адреналин (метиламиноэтанолпирокатехин)- Гормон надпочечников, сужает кровеносные сосуды, повышает артериальное давление. Применяется при остановке сердца (в реанимации), как гипертензивное и кровеостанавливающее средство. 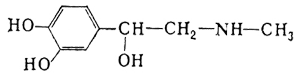 Резорцин менее ядовит, чем пирокатехин и гидрохинон. Антисептическое средство. n-аминофенол - промежуточный продукт в синтезе парацетамола. 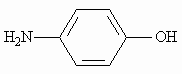 Парацетамол – антипиретик (оказывает жаропонижающее действие), анальгетик (обезболивающее действие). Первое действие выражено сильнее.  Убихиноны, или кофермент Q (КоQ) присутствуют в липидной фазе всех клеточных мембран, принимают участие в окислительно-восстановительных процессах: 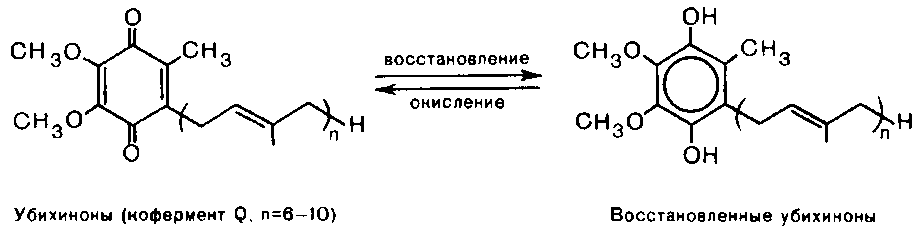 ТИОЛЫ (меркаптаны) R – SH - сернистые аналоги спиртов (производные сероводорода). ХИМИЧЕСКИЕ СВОЙСТВА Тиолы проявляют слабые кислотные свойства (на 5-6 порядков больше, чем у спиртов) 1. С2Н5SH + Na = C2H5SNa + H2O 2. С2Н5SH + NaOH = C2H5SNa + H2O 3. С2Н5SH + HgO = (C2H5S)2Hg + H2O 4. С2Н5SH + HgCl2 = (C2H5 S)2Hg + H2 O 5. Реакция этерификации (S-ацилирования) 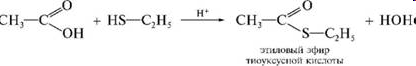 6. Реакция переэтерификации 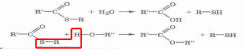 Один из важнейших тиолов - кофермент А (СоА-SH, КоА-SH). В его составе: аденозиндифосфат, пантотеновая кислота и 2-аминоэтантиол. Главная роль - перенос ацильных групп (СН3-СО-) в реакциях, протекающих в организме. Кофермент А участвует в обмене веществ: активируя карбоновые кислоты, превращает их в реакционноспособные сложные тиоэфиры (ацилкофермент А). 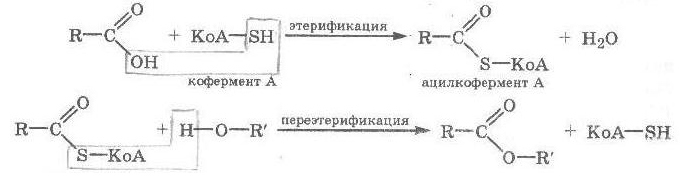 7. Окислительно-восстановительные реакции. Тиолы - сильные восстановители: окисление 2RSH ↔ R – S – S –R + 2H+ восстановление Тиол-дисульфидная система – сопряженная окислительно-восстановительная пара. Используется для поддержания Ox/Red гомеостата в организме и в работе антиоксидантной системы. Окислительно-восстановительные свойства тиолов Окисление тиолов (дегидрирование): 2RSH → R-S-S-R + 2H+ Окисление цистеина 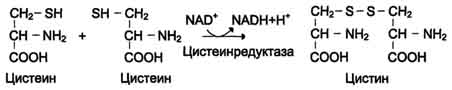 Липоевая кислота поддерживает окислительно-восстановительный гомеостаз клетки: 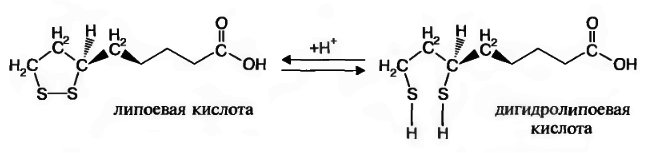 При накоплении окислителей в организме, они действуют на белки, содержащие аминокислоту цистеин, которая окисляясь превращается в цистин. Цистеиновые фрагменты белка сшиваются, что приводит к новой конформации белка и нарушению его биофункции. Тиосодержащие антиоксиданты организма (глютанион и дигидролипоевая кислота) защищают белки от окисления: 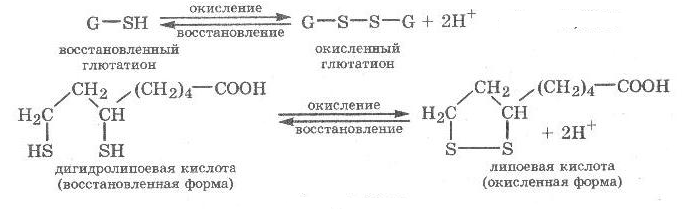 Для увеличения емкости антиоксидантной системы организма используются тиопрепараты: 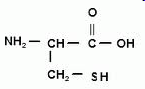 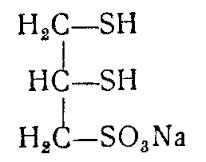 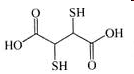 Ацетилцистеин (АЦЦ) Унитиол Сукцимер Эти же препараты являются антидотами металлов-токсикантов, а также отравляющего вещества люизит (схожее с ипритом действие). Нарушение окислительно-восстановительного гомеостаза наблюдается при радиоактивном облучении. Для предотвращения тяжелых последствий используют радиопротекторы (вещества, смягчающие последствия радиации), например меркамин (аминотиол) 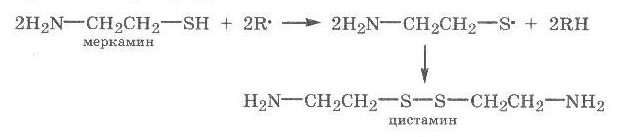 Тиолы при действии сильных окислителей (HNO3, KMnO4, H2O2) превращаются в сульфооксиды и сульфоны: 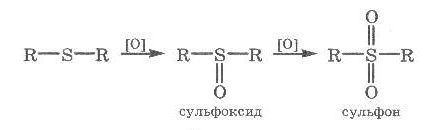 Диметилсульфооксид (ДМСО, димексид) оказывает противовоспалительное действие, широко применяется в травматологии, так как является уникальным растворителем: проникает через мембраны, способен растворять как полярные, так и неполярные вещества (таким образом, можно готовить лекарственные формы или использовать само вещество в разбавленном виде). 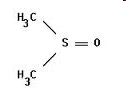 |
