1физ химия срс. Теплота растворения
 Скачать 303.22 Kb. Скачать 303.22 Kb.
|
|
Раздел 1 Теплота растворения Калориметрическими методами экспериментально определяется и такая важная величина, как теплота растворения. Она имеет особое значение для фармации, так как приготовление жидких лекарственных форм связано с растворением, главным образом, твёрдых (порошкообразных) лекарственных веществ, а, следовательно, и с тепловым эффектом, возникающим при этом и достигающим иногда значительных величин. Теплота растворения DНр-р или DНs.(от solution - раствор) - тепловой эффект растворения вещества при постоянном давлении. Различают интегральную и дифференциальную теплоту растворения. Теплота растворения 1 моля вещества с образованием т. н. бесконечно разбавленного раствора принято называть интегральной теплотой растворения. Интегральная теплота растворения зависит от соотношения количеств растворяемого вещества и растворителя и, следовательно, от концентрации образующегося раствора. Тепловой эффект при растворении 1 моля вещества в очень большом количестве уже имеющегося раствора этого же вещества некоторой концентрации (приводящем к бесконечно малому увеличению концентрации) принято называть дифференциальной теплотой растворения:
По физическому смыслу дифференциальная теплота растворения показывает, как изменяется тепловой эффект растворения вещества с увеличением его концентрации в растворе. Размерность СИ теплоты растворения - Дж/моль. Интегральная теплота растворения кристаллических веществ (например, неорганических солей, оснований и т. п.) складывается из двух величин - энтальпии превращения кристаллической решётки вещества в ионный газ (разрушения кристаллической решетки)DНреш и энтальпии сольватации (в случае водных растворов - гидратации)молекул и образующихся из них при диссоциации ионов DНсольв (DНгидр): DНр-р = DНреш + DНсольв; DНр-р = DНреш + DНгидр Величины DНреш и DНсольв противоположны по знаку (сольватация и гидратация всœегда сопровождаются выделœением теплоты, тогда как разрушение кристаллической решётки - её поглощением). Так, растворение веществ, обладающих не очень прочной кристаллической решёткой (к примеру, гидроксидов щелочных металлов – NaOH, КОН и т. п.), сопровождается сильным разогреванием образующегося раствора, а хорошо гидратирующихся жидких веществ, не имеющих кристаллической решётки (к примеру, серной кислоты) - ещё бóльшим разогреванием вплоть до вскипания. Напротив, растворение веществ с прочной кристаллической решёткой, таких, как, к примеру, галогениды щелочных и щёлочноземельных металлов KCl, NaCl, CaCl2, идёт с поглощением теплоты и приводит к охлаждению. (Этот эффект используется в лабораторной практике для приготовления охлаждающих смесей). По этой причине знак суммарного теплового эффекта при растворении зависит от того, какое из его слагаемых больше по абсолютной величинœе. В случае если известна энтальпия разрушения кристаллической решетки соли, то, измеряя теплоту растворения, можно вычислять энтальпию её сольватации. С другой стороны, измеряя теплоту растворения кристаллогидрата (т. е. гидратированной соли), можно с достаточной точностью вычислить энтальпию разрушения (прочность) кристаллической решётки. Теплота растворения хлорида калия, равная +17,577 кДж/моль при концентрации 0,278 моль/л и 25оС, предложена в качестве термохимического стандарта для проверки работы калориметров. Температурная зависимость теплот растворения, как и тепловых эффектов химических реакций, подчиняется уравнению Кирхгоффа. Когда растворяемое вещество и растворитель химически подобны и при растворении не возникает осложнений, связанных с ионизацией или сольватацией, теплоту растворения можно считать приблизительно равной теплоте плавления растворяемого вещества. В основном это относится к растворению органических веществ в неполярных растворителях. Существует несколько видов теплот растворения. Интегральной теплотой растворения ∆Нm называют теплоту, сопровождающую растворение 1 моль вещества в таком количестве растворителя, чтобы получился раствор определенной концентрации m. Интегральная теплота растворения соли в воде обычно резко зависит от концентрации раствора и температуры. При изменении концентрации или температуры может даже измениться знак теплового эффекта растворения. Интегральная теплота растворения при бесконечном разбавлении называется иногда первой теплотой растворения, она определяется экстраполяцией ∆Нm, измеренных при нескольких концентрациях, на нулевую концентрацию соли в растворе. Полная теплота растворения - это интегральная теплота растворения соли при приготовлении насыщенного раствора. Дифференциальной теплотой растворения называется теплота растворения бесконечно малого количества соли в растворе той же соли концентрации m или теплота растворения 1 моль соли в бесконечно большом объеме раствора той же соли. Дифференциальная теплота растворения соли в насыщенном растворе той же соли – это последняя теплота растворения Теплота растворения соли является алгебраической суммой двух основных тепловых эффектов: 1) поглощение теплоты при разрушении кристаллической решетки с удалением образовавшихся ионов на расстояния, соответствующие объему раствора; 2) выделение теплоты при сольватации ( или гидратации) каждого иона молекулами растворителя. Оба эффекта достигают сотен кДж/моль. Их алгебраическая сумма – наблюдаемая теплота растворения – имеет порядок единиц и десятков кДж/моль. Знак теплоты растворения соли определяется слагаемым, большим по абсолютной величине. Теплота нейтрализации. Реакции нейтрализации всегда сопровождаются положительным тепловым эффектом. При этом нейтрализация сильной кислоты сильным основанием в водном растворе дает один и тот же тепловой эффект: около 57,3 КДж на 1г-экв кислоты или основания (закон постоянства теплот нейтрализации). Этот закон находит объяснение в теории электролитической диссоциации. Так, например, реакцию нейтрализации гидроксида натрия соляной кислоты можно представить в виде реакции между ионами гидроксония и гидроксила: Теплотой нейтрализации называют количество теплоты, выделяющееся при взаимодействии грамм-эквивалента кислоты с грамм-эквивалентом щелочи. Постоянство теплоты нейтрализации не наблюдается, когда в реакции нейтрализации участвуют слабые кислоты и слабые основания. Это объясняется тем, что при применении слабых электролитов на тепловой эффект нейтрализации накладывается теплота диссоциации, которая представляет собой эндотермический процесс. При смешивании разбавленных растворов солей, представляющих собой сильные электролиты, теплового эффекта не наблюдается (закон термонейтральности, открытый Г.И. Гессом, 1841). Например, при реакции в растворах солей: не наблюдается ни выделения, ни поглощения теплоты. Это объясняется тем, что никаких существенных изменений с ионами Li+, Cl+, Br- в этом случае не происходит. Однако закон термонейтрализации не соблюдается, когда при взаимодействии растворов электролитов выпадает осадок. Например, при образовании нерастворимого осадка хлорида серебра наблюдается тепловой эффект реакции (реакция осаждения). Теплота гидратации. Физико-химический процесс взаимодействия частиц растворенного вещества с молекулами воды (растворителя) называется гидратацией. В процессе гидратации образуются сложные пространственные структуры, называемые гидратами, и при этом в окружающую среду выделяется энергия в виде тепла. Тепловой эффект реакции образования 1 моль гидратированной соли из безводной соли называется теплотой гидратации. При растворении в воде безводной соли, способной образовывать гидраты, последовательно протекают два процесса: гидратация и растворение образовавшегося кристаллогидрата. Например: CuSO4(тв) + 5Н2О(ж) = CuSO4×5H2О(тв), CuSO4×5H2О(тв) + nH2O(ж) = CuSO4(р), CuSO4(р) + nH2O(ж) = Cu2+(р) + SO42-(р) Растворение электролитов сопровождается процессом электролитической диссоциации. Теплота гидратации молекулы равна сумме теплот гидратации образовавшихся при этом ионов с учетом теплоты диссоциации. Процесс гидратации-экзотермический. Приближенно теплота гидратации вещества может быть определена как разность между теплотами растворения безводной соли и ее кристаллогидрата: ∆Hгидр = ∆Hбезв - ∆Hкрист где ∆Hгидр - теплота гидратации молекул; ∆Hбезв - теплота растворения безводной соли; ∆Hкрист - теплота растворения кристаллогидрата. Таким образом, для определения теплоты гидратации молекул необходимо предварительно определить теплоту растворения безводной соли и теплоту растворения кристаллогидрата этой соли. Теплота диссоциации Теплота диссоциации ( теплота, необходимая для расщепления молекул на атомы) водорода Q419 МДж / кмоль. При какой температуре Т средняя кинетическая энергия ОУП поступательного движения молекул достаточна для их расщепления. Теплота диссоциации определена равной 21 29 ккал / моль. Теплота диссоциации , вычисленная из данных по экспериментальному определению К при разных температурах равна 46 - 50 кДж / моль. Теплота диссоциации может быть вычислена на основании измерений констант равновесия реакции диссоциации двумя методами. Теплота диссоциации H2S03 - Н - HSO3 в разбавленных растворах равна 4 43 кал. [ Теплота диссоциации при 0 К: DQ 11 842 ккал / кмоль К2 - Решение. Теплота диссоциации может быть определена на основании тепловых потерь газа. Кун смен , а также Ламар и Деминг воспользовались этим. Теплота диссоциации имеет для различных слабых кислот и оснований различную величину и знак, так как является суммой изменений энтальпии при распаде молекул на ионы и гидратации последних. Раздел 2 Колориметр
Колориметр (от лат. color – цвет и от греч. metreo – измеряю) – прибор для измерения характеристик цвета света (не путать с калориметром – прибором для измерения количества теплоты). Существуют колориметры двух типов. Трёхцветные колориметры служат для количественного выражения цвета в виде набора трёх чисел – основных компонентов цвета. Они представляют собой интенсивности световых потоков трёх основных цветов (красный, зелёный, синий), дающих при их смешении цвет, неотличимый от измеряемого. Результаты фиксируются на трёх шкалах колориметра.
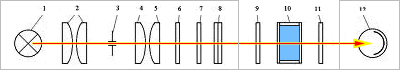
Колориметр – прибор для измерения цвета в одной из трёхмерных колориметрических систем, то есть в системе, в которой предполагается, что любой цвет может быть представлен как результат оптического сложения определённых количеств трёх цветов, принимаемых в ней за основные. В визуальных колориметрах эти количества – так называемые координаты цвета – подбираются наблюдателем так, чтобы получить цвет, неотличимый на глаз от измеряемого цвета Ц. Результаты подбора фиксируются на измерительных шкалах К. В простейшем визуальном колориметре – диске Максвелла – оптическое смешение основных цветов происходит во времени, при быстром попеременном восприятии их наблюдателем одного за другим. Внешнее кольцо этого диска разделено на 3 сектора. Регулировкой величины каждого сектора, окрашенного в один из основных цветов, добиваются того, чтобы при быстром вращении диска воспринимаемый цвет кольца не отличался от цвета образца, помещаемого в центр диска. Более распространены визуальные колориметры, в которых оптическое смешение осуществляется в пространстве – одновременным освещением белой поверхности тремя световыми потоками различной цветности; вклад в получаемый цвет каждого потока регулируется изменением его интенсивности. Оптическая схема одного из лучших колориметров этого типа (системы Л. И. Дёмкиной) приведена на рис. 1. Результаты измерений могут быть представлены в виде Ц = к'К + з'З + с'С, (1) где к', з', c' – считываемые по шкалам координаты Ц в системе основных цветов прибора К, З и С (обычно красного, зелёного и синего). Зная к', з' и c', можно рассчитать координаты и в любой другой трёхмерной колориметрической системе (с другими основными цветами); для этого достаточно знать координаты цветов К, З и С в этой другой системе. Чаще всего калориметры градуируют для пересчёта результатов измерений в международную систему XYZ. Колориметр системы Л. И. Дёмкиной. Оптическая схема визуального трёхцветного колориметра системы Л. И. Дёмкиной. Наблюдаемое в окуляр Ок поле зрения разделено (с помощью фотометрического кубика ФК) на две части – одна имеет цвет образца Об, другая – цвет экрана Э, на котором смешиваются основные цвета прибора. Свет от осветителя Ос попадает на Э через диафрагму Д, содержащую три светофильтра (красный К, зелёный З и синий С) и три подвижные заслонки. Изменяя с помощью заслонок площади фильтров, наблюдатель изменяет интенсивности потоков красного, зелёного и синего излучений, добиваясь, чтобы цвет их смеси не отличался от цвета образца. И – лампа осветителя; Л – линза; А – источник, освещающий образец; З1, З2, З3 – зеркала; ДК и Ф – ослабляющие фильтры. 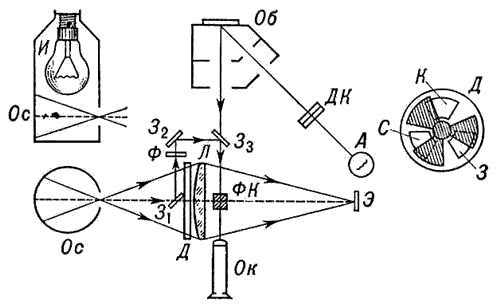 Рис.1 Фотоэлектрические колориметры (называют также объективными) составляют другой класс колориметров. В проводимых с их помощью измерениях используются соотношения, позволяющие рассчитать координаты цвета измеряемого излучения по его спектральному составу I (интенсивности излучения как функции длины волны). Эти соотношения представляют собой интегралы от произведений I на так называемые удельные координаты цвета – известные функции длины волны (в международной системе XYZ это функции x, y, z). Фотоэлектрические калориметры подразделяются на спектроколориметры и приборы с селективными приёмниками. Во–первых измеряемое излучение разлагается дисперсионной призмой (или системой призм) в спектр, "считываемый" фотоэлектрическим приёмником. Сигналы приёмника непрерывно или через равные малые интервалы длин волн умножаются на функции x, y и z и интегрируются по всему видимому спектру; результаты интегрирования представляют собой координаты измеряемого излучения. В калориметрах с селективными приёмниками используются три приёмника излучения со светофильтрами или один приёмник, перед которым последовательно вводятся три светофильтра. Каждый светофильтр состоит из комбинации цветных стекол; их толщины рассчитываются так, чтобы с максимальной точностью привести спектральные чувствительности фотоэлементов к кривым x, y, z. Если это осуществлено, значения трёх фототоков пропорциональны координатам цвета х, у и z. Колориметры – приборы для измерения цвета в какой–либо цветовой шкале или для сравнения интенсивности окраски исследуемого раствора со стандартным. Используются как составная часть автомата для смешивания красок из нескольких основных цветов. Колориметр позволяет сравнивать оптические плотности различных веществ. В колориметрии существуют три метода измерения цвета • Визуальный метод – привлекаются обученные колористы-наблюдатели. Данный метод сегодня используется редко. • Расчетный (спектрофотометрический) метод – требует измерения спектральных коэффициентов отражения образца и знания функций сложения цветов в совокупности со спектральным распределением энергии в источнике света. Самый популярный метод. • Объективный метод – измерение отношения координат цвета испытуемого образца цвета покрытия и образца сравнения с известными координатами цвета. Объективный метод получил широкое распространение в промышленности. Принципиальная схема фотоэлектрического компенсационного колориметра типа ФЭК-М показана на рис.2. Свет от источника 1 проходит в левом плече прибора (цифры без штрихов) через измеряемый раствор, в правом плече (цифры со штрихами) - через стандартный; разность сигналов селеновых фотоэлементов 9 и 9' регистрируется гальванометром 14. Неградуированные фотометрические клинья 10, 11 служат для установки гальванометра на нуль в отсутствие растворов. Оптическая компенсация, т. е. сведение разности сигналов приёмников 9 и 9' к нулю после установки кювет с растворами 6 и 6', осуществляется щелевой диафрагмой 12 с отсчётным барабаном (шкалой) 13, 2, 2' - конденсоры; 3, 3' - зеркала; 4, 4' - светофильтры; 5, 5' и 7, 7' - линзы; 8, 8' - призмы. Колориметр ФЭК-М 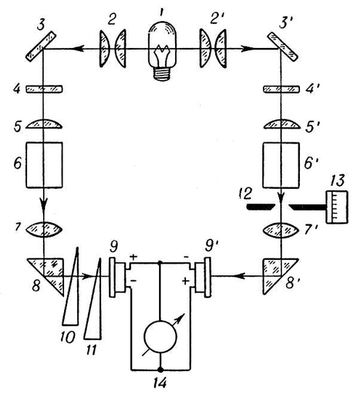 Рис.2 Оптическая схема визуального химического колориметра типа КОЛ-1М показана на рис.3. Уравнивание по цвету двух полей, соответствующих измеряемому и стандартному растворам и наблюдаемых в окуляр 6, осуществляется изменением толщины 1 слоя измеряемого раствора при перемещении плунжера (стеклянного столбика) 3, с которым связана шкала прибора. 1 - источник света, 2 и 2' - кюветы с измеряемым и стандартным растворами; 3, 3' - плунжеры; 4 - призма; 5 - сменные цветные светофильтры. Колориметр КОЛ-1М 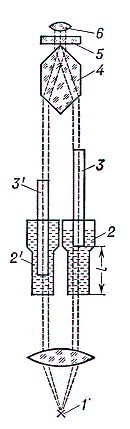 Рис.3 Колориметрия как метод химического анализа применяется для определения концентрации определенного вещества в растворе. Метод позволяет работать с окрашенными растворами или растворами, которые можно сделать окрашенными в результате определенной химической реакции. К работе с прибором допускаются лица, усвоившие необходимый инструктаж. Порядок работы на фотоколориметре заключается в следующем: Включить прибор в сеть. 2. Измерения на приборе начинать не менее чем через 15 минут после включения прибора. В течение этого времени устанавливается стабильный режим работы источника излучения и блока питания. 3. При открытой крышке кюветного отделения рукояткой УСТАНОВКА 0 установить нуль по шкале микроамперметра. 4. При закрытой крышке кюветного отделения с помощью ручки УСТАНОВКА 100 и установить отсчет 100 по шкале измерительного прибора. Примечание: в случае измерения растворов отсчет 100 выставьте кюветой с растворителем. 5. В кюветное отделение установите измеряемый образец, закройте крышку и снимите отсчет по шкале измерительного прибора. 6. Рабочие поверхности кювет должны перед каждым измерением тщательно протираться. При установке кювет в кюветодержатели нельзя касаться пальцами рабочих участков поверхностей. Наличие загрязнения на рабочей поверхности приводит к получению неверных результатов. 7. При замене в процессе работы одного поглотителя на другой, измерения проводить не ранее чем через 1 мин после смены поглотителя. 8. Не рекомендуется выключать прибор при непродолжительных перерывах в работе. Порядок выполнения работы. 1. Изучить порядок выполнения эксперимента и тщательно ознакомиться с правилами работы на приборах. 2. Получить допуск к работе и задание на выполнение эксперимента. 3. При определении концентрации вещества в растворе необходимо соблюдать следующую последовательность в работе: выбор поглотителя; -выбор кюветы; -построение градуировочной кривой для данного вещества; измерение оптической плотности для исследуемого раствора и определение концентрации вещества в растворе. Критика теории тепловой смерти вселенной Примером неправильного применения второго начала термодинамики может служить так называемая «теория тепловой смерти Вселенной», особенно оживленно обсуждавшаяся в конце прошлого столетия. Неправильно распространяя на Вселенную второе начало термодинамики, сторонники этой теории рассуждали приблизительно так: все виды энергии способны самопроизвольно превращаться в теплоту, а теплота самопроизвольно переходит от тел с большей температурой к телам с меньшей температурой. В природе непрерывно происходит процесс выравнивания существующих разностей температур. Рано или поздно во всей Вселенной выравняются температура и давление. Вселенная достигнет состояния термодинамического равновесия, при котором исключается возможность каких-либо процессов, — это будет состояние тепловой смерти Вселенной. Поскольку подобное состояние еще не достигнуто, следовательно, Вселенная не существует вечно, она была создана какое-то количество лет тому назад. Таким образом, делался вывод о возникновении (сотворении) мира. Дальше ученые-идеалисты делали вывод о том, что для создания Вселенной необходима была деятельность сознательного существа. Необходимость творца Вселенной аргументировалась так: поскольку Вселенная развивается, переходя от состояний с меньшей энтропией к состояниям с большей энтропией, следовательно, она переходит от состояний менее вероятных к состояниям более вероятным. Двигаясь назад в глубь веков, мы встречаемся, согласно этим рассуждениям, с состояниями все менее и менее вероятными и, наконец, в пределе достигаем состояния, вероятность которого исчезающе мала. Подобное состояние не может возникнуть случайно, но оно может быть создано сознательным существом, так же как практически не может нормальная игральная кость выпасть миллион раз подряд вверх шестеркой, но может быть таким образом сознательно положена человеком. Подобные ошибочные с точки зрения физики, но имеющие видимость научной теории рассуждения представляли широкое поле деятельности различным представителям идеалистической философии. Фундаментальная ошибка всех этих рассуждений заключалась в том, что опытный закон, установленный применительно к системе, содержащей конечное число частиц, необоснованно переносился на бесконечно протяженную систему. Подобного рода ошибки относятся к основным логическим ошибкам. Ведь ни у кого не возникает сомнения в невозможности применения второго начала термодинамики к системам, содержащим небольшое число частиц, а ведь столь же ошибочно применение этого закона и к системам с бесконечно большим числом частиц. Кроме того, второе начало не учитывает целый ряд превращений, которые могут играть большую роль во Вселенной. Мы еще мало знаем о закономерностях взаимодействия элементарных частиц с полем, да и сами элементарные частицы, вероятно, не являются элементарными в обычном смысле этого слова, а имеют структуру, которую в скором времени придется учитывать. Функция состояния, называемая энтропией, определяющая равновесие изолированных систем с конечным числом частиц, имеет, вероятно, иной смысл, когда говорят о космических системах, понимая под последними даже не всю Вселенную, а отдельные звездные скопления. Неправильно механически переносить наши обычные представления, возникшие в результате наблюдения поведения макроскопических тел, на явления, разыгрывающиеся как в микромире, так и в космосе. Жидкость, находящаяся достаточно долго в идеальном термостате, достигает состояния термодинамического равновесия и может рассматриваться как пребывающая в состоянии тепловой смерти. В масштабах же микромира в подобной жидкости непрерывно происходят разнообразные процессы: сложные молекулы диссоциируют; электроны, вращающиеся вокруг атомных ядер в молекулах, изменяют свое первоначальное движение; присутствующие продукты диссоциации вновь соединяются с образованием недиссоциированных продуктов и т. д. С точки зрения атома подобное состояние никак нельзя рассматривать как состояние, неизменное во времени. Столь же неправильно переносить наши представления и на космические системы. Неправильно считать, что Вселенная когда-то возникла и затем развивалась, стремясь к равновесному состоянию. Вселенная — вечна. Астрономические исследования последних лет дают основания предполагать, что звездные миры продолжают возникать и в наше время. Вселенная, в которой мы живем, непрерывно обновляется. Есть все основания предполагать, что во Вселенной, наряду с процессами выравнивания температур, имеют место процессы, приводящие к значительной концентрации энергии и к возникновению областей с очень высокой температурой. Физик должен постоянно помнить об относительном характере законов науки, о том, что физическая теория является лишь «приблизительной копией с объективной реальности» (Ленин В. И., «Материализм и эмпириокритицизм»), и не допускать необоснованной экстраполяции физических законов. Закон сохранения энергии хорошо известен: энергия не возникает и не исчезает, а может лишь превращаться в другие виды энергии или переходить от одной физической системы к другой. Во всех процессах энергии изолированной системы сохраняется. Закон сохранения энергии говорит как о количественной неуничтожимости материи и движения, так и их качественной неуничтожимости. Величиной, определяющей качество энергии, является энтропия. Понятие «энтропия» возникло в рамках термодинамики и связано с анализом тепловых процессов, оно характеризует направление протекания самопроизвольных процессов в замкнутой термодинамической системе и является мерой их необратимости. Понятие энтропии лежит в основе второго начала термодинамики, открытого в 60-е года ХIХ в. Клаузиусом, согласно которому энтропия изолированной системы постоянно возрастает. Другими словами, энтропия теплоизолированной системы всегда только увеличивается, т.е. такая система стремится к тепловому равновесию, при котором энтропия максимальна. Согласно этому закону, тепло не может само собой перейти от системы с меньшей температурой к системе с большей температурой. Распространив второй закон термодинамики о возрастании энтропии, справедливой для замкнутых систем, не всю бесконечную Вселенную, Клаузиус пришел к выводу о тепловой смерти Вселенной. Согласно его «теории», все виды энергии превращаются в тепловую, энергия обесценивается, утрачивает способность к превращениям, а Вселенная приходит в наиболее вероятное состояние термодинамического равновесия. Энергия хотя и сохраняется количественно, но обесценивается в качественном отношении. Она теряет способность превращаться в другие виды энергии. Любые изменения и существование жизни становится невозможным. При всей своей внешней логичности «теория» тепловой смерти ведет к парадоксальным выводам. Вселенная существует бесконечно долгое время и в принципе должна бы уже давно достичь состояния равновесия. Однако мы наблюдаем в мире существование многообразных видов энергии и движения, что с точки зрения сторонников этой «теории» является необъяснимым фактом. Выход может быть предложен двоякий: можно допустить, что наша Вселенная, либо существовала конечное время, недостаточное для достижения состояния теплового равновесия, либо она много раз достигала такого состояния, но некоторая сила время от времени выводила из него Вселенную. Оба эти предположения ведут к идее сотворения мира или вмешательства в ход физических процессов сверхъестественных сил. Существенный вклад в критику «теории» тепловой смерти Вселенной внесли идеи Больцмана, который дал статистическое обоснование второго начала термодинамики. Он исходил из того, что бесконечная Вселенная в бесконечное время имеет вероятность, значительно отклоняющуюся от своего среднего наиболее вероятного состояния, поэтому в отдельных ограниченных областях возможны гигантские спонтанные отклонения от состояния равновесия. Только после такого отклонения (флуктуации) вступает в силу закон возрастания энтропии, снова приводящей к наиболее вероятному состоянию. Некоторые ученые очень высоко оценили флуктуационную гипотезу Больцмана. Болгарский физик и философ А.Поликаров писал, что только больцмановская теория избавляет нас от «тепловой смерти». По мнению Я.П. Терлецкого, космологическая флуктуационная гипотеза Больцмана «впервые выразила языком физики идею о вечном кругообороте материи во Вселенной, ранее высказанную Энгельсом». Он считает, что для модели Вселенной Больцмана допущение сотворения является излишним, так как тепловая смерть – удел каждой определенной области пространства и то не на вечные времена, поскольку через достаточно большой промежуток времени возможна новая флуктуация, приводящая этот ограниченный мир вновь в неравновесное состояние. Одно из главных возражений против флуктуационной теории Больцмана, Терлецкий видит в исчезающее малой вероятности больших флуктуаций во Вселенной. Однако не только в этом несостоятельность теории Больцмана. Она хотя и сыграла положительную роль, но по существу не решает проблемы, так как фактически предполагает состояние абсолютного равновесия, «тепловой смерти» во Вселенной, нарушаемое отдельными флуктуациями, носящими случайный характер. Неудовлетворительность гипотезы Больцмана обычно рассматривается как свидетельство неприменимости статистических идей Больцмана к бесконечию большим объектам. Возражая против этого, российский математик И.П.Плоткин утверждает, что из статистики Больцмана логически следует не флуктуационная гипотеза, а наоборот – полное отсутствие состояния равновесия у бесконечно большой системы, т.е. не ограниченное ничем развитие Вселенной. Статистическая физика не обнаруживает у бесконечно большой системы наиболее вероятного, т.е. равновесного состояния. Вероятность повторения однажды пережитого такой системой состояния равна нулю. Каждое состояние бесконечно большой системы является, поэтому, совершенно новым и неповторимым: все состояния равновероятны. Со времени открытия второго закона термодинамики встал вопрос о том, как согласовать вывод о возрастании энтропии в замкнутых системах (возрастание неопределенности, хаоса) с процессами самоорганизации в живой природе, с теорией Дарвина. Ведь она показала, что процесс развития растительного и животного мира характеризуется его непрерывным усложнением, нарастанием высоты организации и порядка. Живая природа почему-то стремилась прочь от термодинамического равновесия и хаоса. Налицо была явная нестыковка законов развития неживой и живой природы. После замены модели стационарной Вселенной на развивающуюся, в которой ясно просматривалось нарастающее усложнение организации материальных объектов – от элементарных субэлементарных частиц в первые мгновения после Большого взрыва до звездных и галактических систем, - несоответствие законов стало ещё более явным. Ведь если принцип возрастания энтропии универсален, то, как же могли возникнуть такие сложные структуры? Стало ясно, что для сохранения непротиворечивости общей картины мира необходимо постулировать у материи в целом не только разрушительной, но и созидательной тенденции, Материя способна осуществлять работу и против термодинамического равновесия, самоорганизовываться и самоусложняться. Постулат о способности материи к саморазвитию в философии был разработан достаточно давно. А вот его необходимость в фундаментальных естественных науках начала осознаваться только в последнее время. Исследования показали, что процессы самоорганизации имеют место в системах самой различной природы, в том числе и неорганической. Эти закономерности изучает синергетика - теория самоорганизации. |