1физ химия срс. Теплота растворения
 Скачать 303.22 Kb. Скачать 303.22 Kb.
|
|
Раздел 3 Фаза. Фаза- это совокупность гомогенных частей гетерогенной системы одинаковых по химическим и физическим свойствам, отдаленная от других частей видимыми поверхностями раздела. Различают простую и смешанную фазы. Простая (или чистая) фаза- это фаза, состоящая из одного химически индивидуального веществ (например, бензол в виде эмульсии в воде образует чистую фазу). Смешанная фаза- это фаза, состоящая из двух и более химически индивидуальных веществ (например, различные жидкие и твердые растворы). Компонент. Степень свободы. Составляющие вещества системы называются компонентами. Химически индивидуальные вещества, которые могут существовать отдельно вне системы, называются независимыми компонентами. Так, в водном растворе хлорида натрия содержатся вещества:H2O,NaCl, гидратированные ионы Na+,Cl-,H3O+ и OH-, а независимых компонентов только два (H2O,NaCl), так как ни один из перечисленных ионов не может быть извлечен из данной системы в отдельности. Наименьшее число составных частей, достаточное для образования всех фаз равновесной системы, называется числом независимых компонентов (К). Так, например, в системе, в которой происходит химическая реакция Компонентов три: СаСО3, СаО и СО2, а независимых два (любые два вещества из этих трех). Значит система двухкомпонентная. Таким образом, число независимых компонентов в химической системе равно сумме составляющих веществ минус число возможных реакций между ними. Если же между составными частями системы невозможны никакие химические реакции (физическая система), то число компонентов равно числу составных частей. Например, в равновесной гетерогенной системе: хлорид натрия (кристаллический) Наибольшее число факторов (концентрация, температура и давление), которые можно произвольно менять без изменения числа фаз в системе, называют числом степеней свободы (С). Правило фаз Д.Н.Гиббса. Правило, дающее возможность определить условия, при которых в равновесной гетерогенной системе сохраняется существующее число фаз, называется правилом фаз. М Для конденсированных систем, т.е. систем, состоящих только из твердых и жидких фаз, давление очень мало влияет на состояние равновесия в них. Для этих систем примем за постоянную величину, тогда По числу фазсистемы делятся на однофазные, двухфазные, трехфазные и т.д. По числу независимых компонентов системы делятся на однокомпонентные, двухкомпонентные (двойные), трехкомпонентные (тройные) и т.д. По числу степеней свободы-на безвариантные (при С=0), одновариантные (С=1), двухвариантные (С=2), трехвариантные (С=3) и т.д. Например, в системе имеются три фазы: две твердые-SrCO3и SrO и одна газообразная-CO2. Система эта содержит, как это было показано выше, два независимых компонента. Поэтому С=2-3+2=1, т.е. система одновариантная. Правило фаз сформулировано Д.Н. Гиббсом в 1976 г. Это правило служит основой классификации и изучения гетерогенных систем. Правило фаз широко применяют в ряде областей химии, химической технологии и в особенности металлургии (теория сплавов), а также галургии (получение солей). Уравнение правила фаз устанавливает связь между числом степеней свободы, числом компонентов и числом фаз в данной равновесной системе. Правило может быть сформулировано так: Число степеней свободы равновесной термодинамической системы, на которую из внешних факторов влияют только температура и давление, равно числу независимых компонентов системы минус число фаз плюс два. С=К-Ф+n где n- число внешних факторов, влияющих на равновесие в системе. Правило фаз показывает, что число степеней свободы возрастает с увеличением числа компонентов и уменьшается с увеличением числа фаз системы. Е Число степеней свободы в этом случаем уменьшается на единицу. Такого рода вариантность называют условной, и можно говорить об условно инвариантном, условно моновариантном (и т.д.) равновесии. При постоянстве двух внешних факторов (р=const, Т=const) число степеней свободы вычисляют по уравнению: С=К-Ф Число степеней свободы системы уменьшается и в тех случаях, когда концентрация какого-либо компонента одинакова в двух или более фазах. Однокомпонентная система. Однокомпонентной системой является любое простое вещество или химическое соединение, обладающее строго определенным составом в газообразном, жидком и твердом состояниях. Д 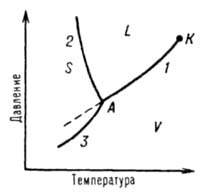 иаграмму состояния обычно строят на плоскости в координатах T-p (рис. 1). Фазовые поля (области существования) пара V, жидкости L и твердой фазы S дивариантны, т.е. допускают одновременное изменение двух параметров состояния - Т и р. иаграмму состояния обычно строят на плоскости в координатах T-p (рис. 1). Фазовые поля (области существования) пара V, жидкости L и твердой фазы S дивариантны, т.е. допускают одновременное изменение двух параметров состояния - Т и р.Рис. 5. Диаграмма состояния однокомпонентной системы. Где: S, L и V - соответственно области существования твердой, жидкой и паровой фаз; 1, 2 и 3 - кривые кипения (испарения), плавления и возгонки (сублимации) соответственно; К - критическая точка; А - тройная точка. Двухфазное равновесие между жидкостью и паром изображается кривой кипения (или испарения) 1, между жидкостью и кристаллами - кривой плавления 2, между кристаллами и паром - кривой возгонки (или сублимации) 3. Все двухфазные равновесия моновариантны, т.е. не нарушаются при произвольном изменении только одного из параметров, Т или р; при этом значение другого определяется из диаграммы состояния. Кривая кипения 1 характеризует зависимость давления насыщенного пара вещества от температуры или зависимость температуры кипения вещества от внешнего давления. Со стороны повышенных T и р эта кривая заканчивается в критической точке К, где исчезает различие в свойствах между жидкостью и ее паром. Жидкость может находиться в переохлажденном состоянии (пунктирная линия на рис. 1). Аналогично кривая плавления характеризует зависимость температуры плавления от внешнего давления, кривая возгонки - температурную зависимость давления насыщенного пара над твердым веществом. На рис. 1 ход кривой плавления соответствует повышению температуры плавления с ростом давления, однако возможно и понижение температуры плавления с давлением. Все три кривые моновариантных фазовых равновесий сходятся в тройной точке А, отвечающей параметрам состояния, при которых находятся в нонвариантном равновесии три фазы. Диаграмма состояния усложняется, если вещество в твердом состоянии может существовать в различных кристаллических модификациях. Каждой модификации отвечает свое фазовое поле. Линии моновариантных равновесий, разграничивающие эти поля, называют кривыми превращений. Двухкомпонентная система. Рассмотрим условия, при которых из двухкомпонентной жидкости выделяются твердые фазы. Учитывая, что давление постоянно, используем правило фаз в виде уравнения (VII.2). Если система состоит только из одной жидкой фазы, то С = 2 + 1 - 1 = 2. Это означает, что в известных пределах можно произвольно изменять и температуру, и состав жидкости, оставляя систему однофазной. Таким образом, на диаграмме равновесия (в координатах состав - температура) однофазной двухкомпонентной системе соответствует плоскость. Если из жидкости при ее охлаждении выделяется одна твердая фаза, то С=1, и, следовательно, это моновариантное равновесие изображается линией. Такие линии ограничивают фазовые поля, т.е. области существования фаз, например, твердой или жидкой. Очевидно, точка пересечения двух линий соответствует одновременному существованию трех фаз - двух твердых и одной жидкой. Такое равновесие является нонвариантным (С = 0), и изменение любого параметра (температуры или состава) приведет к исчезновению одной из фаз. Рассмотрим основные диаграммы равновесий (или состояний) в двухкомпонентных системах. К основным элементам строения двухкомпонентных (бинарных) диаграмм состояния относятся: координатные оси, вертикали составов, изотермы, точки составов химических соединений, кривые ликвидуса и солидуса, точки эвтектики и перитектики, эвтектоидные точки, изотермы полиморфных превращений, бинодальные кривые. На рис.22. изображена общая (буквенная) диаграмма состояния двухкомпонентной системы, на которой показаны практически все основные элементы строения двухкомпонентных диаграмм. Все поле диаграммы разделяется этими элементами строения на ряд областей, соответствующих равновесному существованию определенных фаз (обозначение этих фаз обычно пишется в соответствующей области диаграммы). Рис. 6. Основные элементы строения диаграммы состояния двухкомпонентной системы 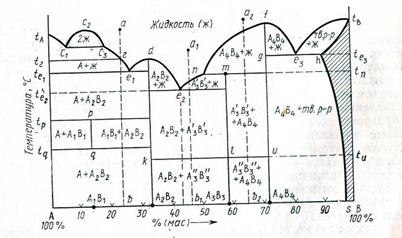 Координатные оси. Двухкомпонентные диаграммы состояния строятся в координатах температура (ось ординат)—концентрация (содержание) компонентов (ось абсцисс). Параметр давление (упругость пара) для двухкомпонентных силикатных систем принимается за постоянную величину, т. е. правило фаз Гиббса при работе с ними используется в виде F=K+1-Р. Цифры на оси абсцисс (см. рис. 22) указывают содержание какого-либо одного компонента (например, В на рис.22) чаще всего в % (мас.) (содержание другого компонента находится по разности: %А= = 100—%В). Точки А и В в начале и конце оси абсцисс соответствуют 100%-ному содержанию компонента, обозначение которого стоит в этой точке. Вертикали составов.Изотермы. Вертикалью состава называется перпендикуляр, опущенный из любой точки диаграммы на ось концентраций или восстановленный к ней из какой-либо точки этой оси (например, вертикали ab, d—А2В2, а1в1, m—А3В3 и т.д.). Всем точкам этого перпендикуляра соответствует один и тот же состав с одинаковым содержанием компонентов. Изотермами на двухкомпонентных диаграммах состояния являются прямые, проведенные параллельно оси концентраций (например, прямые, соответствующие точкам te1, te2,t p, tqи т. д. на оси температур). Точки составов химических соединений. Составы бинарных химических соединений обозначаются точками на оси концентраций (например, точки A1B1 A2B2 и т. д. на рис.22), соответствующими содержанию компонентов в этих соединениях. Каждому химическому соединению соответствует своя вертикаль состава (например, вертикали А2В2—d, A3B3—т и т. д.). В зависимости от характера процесса, происходящего при нагревании соединений и возникающих при этом фазах, различают три типа химических соединений: плавящиеся без разложения (конгруэнтно), плавящиеся с разложением (инконгруэнтно) и разлагающиеся (или образующиеся) при изменении температуры в твердом состоянии. Плавление без разложения означает, что при плавлении кристаллического соединения определенного состава образуется только жидкость (расплав) того же состава; при плавлении с разложением образуется жидкость и выделяются кристаллы другого соединения, при этом, естественно, составы как жидкости, так и образующегося соединения отличаются от состава исходного плавящегося соединения; к третьему типу соединений относятся соединения, которые еще до образования жидкой фазы разлагаются (или образуются) при изменении температуры в твердом состоянии. Кривые ликвидуса и солидуса. Важнейшим элементом строения двухкомпонентных диаграмм состояния являются кривые ликвидуса (например, кривые tAс1, с3е1, e1d, de2, e2n, nf, fe3, e3tBна рис.22). Точки кривых ликвидуса показывают состав жидкой фазы (расплава), насыщенной при соответствующей температуре (температуре ликвидуса) по отношению к одной твердой кристаллической фазе, т. е. существующей с ней в равновесии (например, на кривой с3е1в равновесии с жидкой фазой находятся кристаллы соединения А, на кривой fе3 — кристаллы соединения А4В4 и т. д.). Точки кривых ликвидуса показывают также температуру начала кристаллизации расплава при его охлаждении или температуру конца плавления твердого вещества при его нагревании. Точки эвтектики и перитектики. Эвтектоидные точки. Ветви кривых ликвидуса пересекаются в точках, называемых точками эвтектики (например, точки е1 е2, е3и т. д. на рис. 22), а составы, соответствующие этим точкам, называются эвтектическими. Эвтектический состав строго постоянен для каждой данной частной двухкомпонентной системы (на рис. 22) частными по отношению ко всей системе А—В являются системы А—А2В2, А2В2—А4В4, A4B4—В) и расположен между точками составов соединений, образующих эту частную систему. Плавление или кристаллизация любого состава таких систем происходит (начинается и заканчивается) при одной и той же строго постоянной (по сравнению со всеми другими составами этой частной системы) температуре, называемой эвтектической температурой (например, температуры tе1, tе2, на рис.22). В точках эвтектики в равновесии находятся три фазы: одна жидкая и две твердые (например, в точке эвтектики е2 — жидкая фаза состава этой точки и твердые фазы А2В2 и А3Вз), поэтому в соответствии с правилом фаз точки эвтектики выражают инвариантное состояние системы (f=К+1—Р = 2+1—3=0). Это означает, что система из характеризуемой точкой эвтектики состояния не может перейти в другое состояние (т. е. не может изменить свои параметры — температуру и концентрацию), пока не исчезнет хотя бы одна фаза. Следует отметить, что в точках эвтектики происходит только физический процесс кристаллизации (при охлаждении) или плавления (при нагревании) и кристаллизация в этой точке всегда заканчивается (т. е. жидкая фаза исчезает). Изотермы полиморфных превращений.При наличии в двухкомпонентной системе соединений, существующих в нескольких полиморфных модификациях (например, соединение А3Вз на рис.22 существует в виде полиморфных форм Аз'Вз' и Аз"Вз"), на диаграмме состояния появляется изотерма (klu), разделяющая температурные области стабильного существования этих форм (выше температуры tuсоединение А3Вз существует в виде Аз'В3'-, а ниже — в виде А3"В3"-формы). Бинодальные кривые. Если в двухкомпонентной системе имеет место явление ликвации (фазового разделения однородной жидкой фазы на две несмешивающиеся жидкости), то на кривой ликвидус появляется характерная горбообразная кривая (например, с1, с2, с3на рис.22), называемая бинодальной кривой, ограничивающая область ликвации. Точки левой и правой ветвей этой кривой (с2с1и с2с3) характеризуют составы двух жидких фаз, находящихся при данной температуре в равновесии. В области ликвации до начала кристаллизации расплава двухкомпонентная система моноварианта, а после начала кристаллизации — инвариантна. |
