1физ химия срс. Теплота растворения
 Скачать 303.22 Kb. Скачать 303.22 Kb.
|
|
Правила работы с диаграммами состояния двухкомпонентных систем различных типов Диаграммы состояния позволяют прежде всего определить для любого состава в данной системе путь кристаллизации и путь плавления. Под условным термином «путь кристаллизации» понимается описываемая на диаграмме последовательность фазовых изменений и изменений составов жидкой и твердой фаз при охлаждении расплава данного состава; под «путем плавления» — та же последовательность, но для твердой смеси, подвергающейся нагреванию вплоть до ее полного расплавления. Следует отметить, что для одного и того же состава графически путь кристаллизации и путь плавления идентичны, но противоположны по направлению и последовательности фазовых превращений. Определение последовательности фазовых изменений на диаграммах состояния основывается на правилах работы с ними. Эти правила удобно рассматривать на отдельных типах двухкомпонентных диаграмм состояния в их общем выражении (тип диаграммы определяется наиболее характерным набором элементов строений этой диаграммы). При графическом построении путей кристаллизации или плавления следует иметь в виду, что при пересечении любого элемента строения на диаграмме происходят определенные фазовые изменения. Условия равновесия в гетерогенных системах. Химические реакции, протекающие на границе раздела фаз, называются гетерогенными химическими реакциями. При равенстве скоростей прямой и обратной реакции наступает химическое равновесие в гетерогенной системе. Примерами гетерогенных процессов является пароводяная конверсия углерода, или восстановление оксидов металлов водородом: С(к) + 2Н2О = СО2 + 2Н2 , МеО(к) + Н2 = Ме(к) + Н2 О. Как и для любого равновесия, условием гетерогенного химического равновесия является равенство энергии Гиббса нулю, ΔG= 0. В равновесной гетерогенной системе все фазы должны иметь одинаковую температуру, так как в противном случаем система не будет находится в состоянии теплового равновесия. Это же относится и к давлению, так как в противном случае система не будет находиться в состоянии механического равновесия. Для равновесных систем переменного состава при р = const,Т= const согласно второму закону термодинамики имеем dG=Ʃi(μidni)=0 т.е. химические потенциалы компонентов во всех фазах равновесной системы должны быть одинаковыми, так как в противном случае будет наблюдаться перенос вещества между сосуществующими фазами. Таким образом, условия термодинамического равновесия в гетерогенной системе могут быть представлены следующими уравнениями (идекс внизу обозначает номер компонента, вверху- номер фазы): Т,=Т,,=Т,,,=…=ТФ Р,,=р,,=р,,,…=рФ μ1,=μ1,,=μ1,,,=μ1Ф μ2,=μ2,,=μ2,,,=μ2Ф … Μк,=μк,,=μк,,,=μкФ Константа равновесия гетерогенной реакции Как и в случае гомогенной химической реакции, константа гетерогенного равновесия равна отношению произведения равновесных концентраций (активностей) или парциальных давлений продуктов реакций к произведению равновесных концентраций (активностей) или парциальных давлений исходных веществ в степенях, равных стехиометрическим коэффициентам в уравнении. Для реакции пароводяной конверсии углерода константа равновесия имеет вид: Кр = (рСО2)р (рН2)2р/(рН2О)2р, для восстановления металла Кр = (рН2O)р/(рН2)р. Из приведенных выражений следует, что в уравнения констант гетерогенного химического равновесия не входят концентрации твердых веществ, участвующих в прямой и обратной реакциях.Это особенность гетерогенного химического равновесия. Так как прямая и обратная реакции протекают на одной и той же поверхности раздела фаз, то площадь поверхности раздела фаз также не входит в уравнение константы химического равновесия. Константа гетерогенного химического равновесия зависит от температуры. Она возрастает с увеличением температуры для эндотермической прямой реакции и уменьшается с увеличением температуры в случае экзотермической прямой реакции. Расчеты проводятся по тем же формулам, что и для гомогенных реакций. Смещение равновесия гетерогенных реакций подчиняется принципу Ле Шателье. При повышении температуры оно смещается в сторону эндотермической реакции. При повышении давления или концентрации исходных веществ равновесие смещается в сторону образования продуктов реакции, при повышении концентрации или давления продуктов реакции равновесие смещается в сторону обратной реакции. При повышении общего давления равновесие сдвигается в направлении уменьшения числа молекул газообразных веществ. Твердые исходные вещества и продукты реакции не влияют на смещение гетерогенного химического равновесия. Термический анализ. Для определения равновесия между кристаллическими веществами и жидкой фазой существует несколько физико-химически методов. Наиболее распространен из них термический анализ. Простая разновидность этого метода анализа основана на визуальном (зрительном) наблюдении за раствором. Для раствора известной известной концентрации устанавливают температуру, при которой появляются кристаллы и при которой они исчезают. Применяется этот способ для систем из прозрачных компонентов при температурах не слишком высоких и не слишком низких. Для систем, содержащих вещества непрозрачные или плавящиеся при высоких температурах, используют другой вид метода термического анализа, основанного на наблюдении за изменением температуры системы при равномерном ее охлаждении или нагревании. Изменяют температуру кварцевыми термометрами или термопарами. В сосуд (тигель) с расплавленным металлом (или другим веществом) погружают термопару (термометр) и при равномерном охлаждении системы записывают температуру через определенные промежутки времени. Пока металл, охлаждаясь, находится в жидком состоянии, температура понижается равномерно. Когда металл охладится до некоторой температуры, начинается кристаллизация, дальнейшее падение температуры прекратиться и на кривой появляется горизонтальный участок. Но тигель вместе с металлом все время охлаждается окружающим воздухом. Выделяющаяся при процессе кристаллизации теплота компенсирует потери теплоты при охлаждении. Когда кристаллизация заканчивается, температура опять постепенно понижается. На оси ординат наносят температуру, а на оси абсцисс-время (рис.23). Кривые, изображающие зависимость температуры системы от времени при охлаждении, называются кривыми охлаждения. К 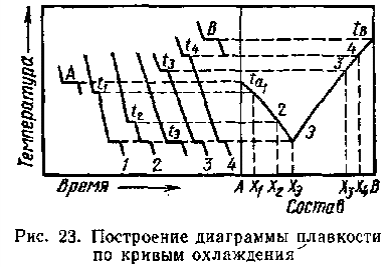 ривые А и В относятся к процессу кристаллизации чистых металлов. Кривые охлаждения смесей имеют более сложную форму. Так, например, кривая 1 охлаждения расплава с содержанием х компонента В показывает, что до температуры, отвечающей t1, понижение температуры происходит равномерно. Перегиб в точке t1 соответствует началу образования кристаллов одного из компонентов, сопровождающееся выделением теплоты. ривые А и В относятся к процессу кристаллизации чистых металлов. Кривые охлаждения смесей имеют более сложную форму. Так, например, кривая 1 охлаждения расплава с содержанием х компонента В показывает, что до температуры, отвечающей t1, понижение температуры происходит равномерно. Перегиб в точке t1 соответствует началу образования кристаллов одного из компонентов, сопровождающееся выделением теплоты. Уменьшением наклона кривой связано с уменьшением скорости изменения температуры при образовании кристаллов. Когда происходит кристаллизация обоих компонентов, температура остается постоянной и на кривой охлаждения появляется горизонтальный участок. Аналогичный вид имеют кривые охлаждения расплавов и другого состава (х1, х2, х3). Расплав, отвечающий кривой охлаждения э, кристаллизуясь при постоянной температуре, образует, подобно чистым компонентам, плавную кривую охлаждения с горизонтальным участком при температуре кристаллизации. По кривым охлаждения можно построить диаграмму состояния- графическое изображение зависимости изменения температуры от состава системы, как показано на рисунке 23. Диаграммы состояния системы позволяют судить о внутренней структуре сплавов, об образовании соединений между компонентами, а также используются для определения рациональных способов выделения отдельных компонентов. В совершенствовании метода термического анализа важнейшая роль принадлежит работам Н.С. Курнакова. С целью повышения точности измерения он применил дифференциальный регистрирующий пирометр (1903), с помощью которого отсчитывает разность температур исследуемого образца и другого образца, помещенного рядом с ним, с тем же режимом охлаждения, но не подвергающегося превращениям. Экстрагирование. Экстрагирование (извлечение) - способ очистки или разделения веществ, основанный на их различной растворимости в индивидуальном растворителе или в двух несмешивающихся растворителях. Экстрагирование позволяет с минимальными потерями выделять нужные вещества из сложных смесей даже в тех случаях, когда применение других методов не дает результата из-за ничтожного содержания целевого продукта в смеси. Обычно экстрагирование предшествует кристаллизации, перегонке или другим способам очистки, но иногда оно приводит сразу к получению чистого продукта. Экстрагирование твердых тел В простейшем случае тщательно измельченную смесь твердых веществ суспендируют в растворителе, не растворяющем примеси, но обладающем растворяющей способностью по отношению к искомому продукту. После фильтрования или декантирования получают раствор, который может быть упарен или подвергнут другим обработкам с целью выделения вещества в чистом виде. Значительно реже экстрагирование применяют для избирательного извлечения легкорастворимых примесей. В этом случае растворитель, разумеется, должен как можно меньше растворять основное вещество. Поскольку растворение - процесс медленный, целесообразно оставить смесь в контакте с растворителем на некоторое время. Перемешивание суспензии способствует более быстрому извлечению продукта. Большое значение имеет также степень измельчения исходной смеси. Как известно, при повышении температуры резко увеличивается не только растворимость веществ, но и скорость растворения. Поэтому экстрагирование горячим растворителем предпочтительнее, если это, конечно, допустимо по другим соображениям. При экстрагировании труднорастворимых веществ не следует использовать сразу все количество растворителя. Наиболее полного извлечения можно добиться, обрабатывая смесь несколько раз небольшими порциями экстрагента (растворителя). Если извлекаемое соединение бесцветно, об окончании экстрагирования судят по отсутствию остатка при упаривании досуха на часовом стекле нескольких капель последней порции экстракта. Для этой же цели могут быть использованы простейшие качественные реакции. Экстрагирование жидкостей В лабораторной практике чаще всего возникает необходимость в извлечении твердых или жидких веществ из водных растворов, хотя изложенные ниже принципы в равной мере применимы и к экстрагированию из других жидкостей. Эффективность извлечения зависит от того, насколько удачно выбран растворитель, который должен удовлетворять следующим основным требованиям: 1) не смешиваться с водой и как можно меньше в ней растворяться; 2) хорошо растворять целевой продукт и плохо - примеси, если таковые присутствуют в растворе (или наоборот: плохо - продукт, хорошо - примеси); 3) легко удаляться из вытяжки или обеспечивать простое выделение экстрагируемого вещества. Для извлечения веществ, плохо растворимых в воде, экстрагент выбирают из неполярных растворителей, таких как бензин, циклогексан, четыреххлористый углерод и т.д. Вещества, обладающие средней растворимостью в воде, извлекают бензолом, хлороформом, дихлорэтаном, хлористым метиленом, эфиром. Успешное экстрагирование хорошо растворимых в воде соединений может быть осуществлено растворителями с высокой растворяющей способностью - этилацетатом, бутилацетатом, бутиловым спиртом и др. Часто смеси растворителей обладают более высокой экстракционной способностью, чем чистые растворители в отдельности. При обработке подлежащего экстрагированию водного раствора некоторым объемом выбранного растворителя извлекаемое вещество распределяется между водой и растворителем в соотношении, зависящем от взаимной растворимости вещества в каждой из жидкостей. Ясно, что однократная обработка не приводит к исчерпывающему извлечению целевого продукта. Обычно экстрагирование проводят последовательно несколькими небольшими порциями растворителя. Эффективность и полнота извлечения могут быть повышены также путем уменьшения растворимости целевого продукта в водном слое. В таких случаях растворимость органического соединения в воде заметно снижается в присутствии растворенных солей, обычно хлорида натрия для нейтральных или основных веществ, или сульфата аммония - для кислых веществ. Многие органические вещества кислого характера, диссоциирующие в воде, полнее извлекаются при подкислении раствора минеральными кислотами. Аналогично, добавление щелочей способствует лучшему извлечению из водного раствора некоторых органических соединений основного характера. С другой стороны, с помощью солеобразования можно предотвратить переход в экстракт примесей щелочного или кислого характера. Загрязнения кислого характера связывают добавлением щелочей, основного - кислот. Процесс экстракции Выберите делительную воронку соответствующего размера, которую можно было бы заполнять не более чем на две трети объема. Проверьте кран и убедитесь, что он свободно вращается (нанесите немного смазки на наружные края стеклянных кранов, краны из тефлона не смазывают). Закройте кран и залейте органический раствор (через воронку). Добавьте воды (или водной кислоты или основания) и заткните пробкой. Придерживая пробку одной рукой и закрытый кран - другой, переверните воронку и плавными круговыми движениями вращайте ее в течение нескольких секунд, чтобы образовался водоворот (но НЕ трясите). При перевернутой воронке откройте кран, чтобы стравить давление (рис. 6) (давление может значительно возрасти при использовании летучих растворителей, например, эфира). Закройте кран, повращайте более энергично и стравите давление снова. Проделайте это несколько раз до прекращения увеличения давления. После этого делительную воронку можно потрясти, чтобы перемешать ее содержимое, но не трясите слишком энергично или долго, поскольку может образоваться эмульсия, которую будет трудно разрушить. 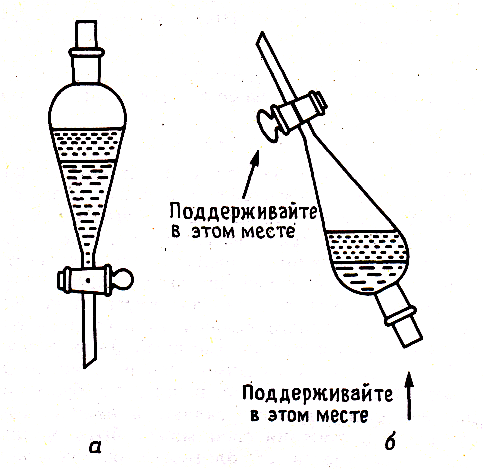 рис.7 Экстрагирование а - делительная воронка; б - положение для стравливания избыточного давления. Уравнения изохоры, изобары химической реакции Зависимость К от температуры 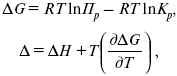 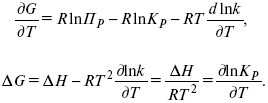 Уравнение изобары: Уравнение изохоры: По ним судят о направлении протекания реакции: 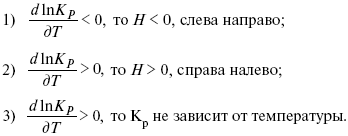 Температура абсолютного нуля. Абсолютный нуль температуры — минимальный предел температуры, которую может иметь физическое тело во Вселенной. Абсолютный нуль служит началом отсчёта абсолютной температурной шкалы, например, шкалы Кельвина. В 1954 году X Генеральная конференция по мерам и весам установила термодинамическую температурную шкалу с одной реперной точкой — тройной точкой воды, температура которой принята 273,16 К (точно), что соответствует 0,01 °C, так что по шкале Цельсия абсолютному нулю соответствует температура −273,15 °C. В рамках применимости термодинамики абсолютный нуль на практике недостижим. Его существование и положение на температурной шкале следует из экстраполяциинаблюдаемых физических явлений, при этом такая экстраполяция показывает, что при абсолютном нуле энергия теплового движения молекул и атомов вещества должна быть равна нулю, то есть хаотическое движение частиц прекращается, и они образуют упорядоченную структуру, занимая чёткое положение в узлах кристаллической решётки (жидкий гелий составляет исключение). Однако, с точки зрения квантовой физики и при абсолютном нуле температуры существуют нулевые колебания, которые обусловлены квантовыми свойствами частиц и физического вакуума, их окружающего. |
