тесты. Тесты по неорганической химии. Тест по теме Первоначальные химические понятия
 Скачать 1.09 Mb. Скачать 1.09 Mb.
|
Вариант 11. Какие растворы проводят электрический ток? а) раствор хлорида калия в воде; б) раствор хлорида натрия в бензоле; в) раствор бромида меди в ацетоне; г) раствор сахара в воде; 2. Какое вещество диссоциирует в соответствии с данной схемой? 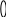 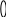 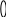    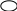  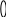 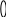    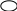   + + а) Вг2; б) НВr; в) КВr; г) К2S 3. Диссоциации какого вещества соответствует приведенное уравнение? Н2А = 2Н+ + А2- (А — кислотный остаток) а) Н2S , б) Н2O , в) НС1 , г) правильного ответа нет 4. При диссоциации какого вещества не образуются гидроксид-ионы? а) NаОН , б) Ca(NO3)2 , в) Са(ОН)2 , г) АlOНSO4 5. Какое из приведенных веществ является слабым электролитом? а) Nа2S04 , б) HNO3 , в) Н2S , г) НС1 6. Индикатор лакмус изменит окраску в водном растворе: а) гидроксида железа (III) б) гидроксида кальция в) гидроксида цинка г) гидроксида алюминия 7. Какие ионы могут находиться в растворе одновременно? а) Nа+, Ва2+, NO б) Н+, К+, С1-, ОН- в) Ва2+ ,ОН-, СО г) Н+, SO 8. Водный раствор сульфата меди (II) не будет взаимодействовать с: а) раствором КС1 б) раствором BaCl2 в) Fe г) раствором NаОН 9. Гидроксид железа (III) будет взаимодействовать с: а) раствором Nа2SO4 б) раствором NаОН в) раствором НNОз г) Са3(РO4)2 10. Разбавленная серная кислота будет реагировать с: а) АgС1 , б) NаС1 , в) Н2S , г) Nа2S 11. Карбонат кальция образуется при реакции ионного обмена между: а) СаО и СO2 б) раствором СаCl2 и раствором Nа2СОз в) Са и Н2СОз г) раствором Са(ОН)2 и ВаСОз 12. Гидроксид цинка можно получить взаимодействием: а) Zn и Н2O , б) ZnO и Н2O , в) раствора Zn(NОз)2 и раствора КОН г) раствора ZnCl2 и Н2SiOз 13. Составьте полное и сокращенное ионное уравнения реакций между гидроксидом железа (II) и азотной кислотой. Найдите суммы всех коэффициентов в полном и сокращенном ионном уравнениях соответствено: а) 8 и 6 , б) 10 и 6 , в) 12 и 6 , г) 12 и 3 14. Ионное уравнение Zn2+ + S2- = ZnS соответствует взаимодействию между: а) Zn и S , б) Zn(ОН)2 и Н2S , в) раствором ZnCl2 и СuS , г) раствором Zn(NОз)2 и раствором К2S 15. Найдите количество вещества, выпадающего в осадок при сливании раствора, содержащего 0,2 моль хлорида железа (III), и раствора, содержащего 0,3 моль гидроксида натрия. а) 1 моль, б) 0,1 моль, в) 0,2 моль, г) 0,3 моль 16. Найдите массу осадка, образующегося при сливании раствора, содержащего 16,25г хлорида железа (III) и раствора, содержащего 16г гидроксида натрия. а) 0,1моль, б) 16г, в) 10,7г, г) 14,27г Вариант 2 1. Какое вещество проводит электрический ток? а) безводная серная кислота б) раствор иодида натрия в бензоле в) раствор хлорида кальция в воде г) раствор кислорода в воде 2 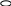 . Какое вещество диссоциирует в воде в соответствии с приведенной схемой? . Какое вещество диссоциирует в воде в соответствии с приведенной схемой?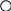 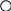 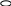 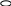 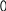  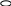   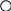 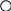 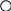 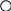 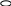 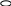 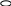 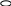  + +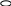 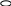   а) Н2; б) КОН; в) НI; г) правильного ответа нет 3. Какое вещество диссоциирует в воде в соответствии с приведенным уравнением? М(ОН)2 = М2+ + 2OН- (М - металл) а) K2SO4 ,б) NaOH , в) Ва(ОН)2 , г) Са(NOз)2 4. При диссоциации какого вещества не образуются ионы гидроксония НзO+? а) А1(НSO4)3 , б) NаНСОз , в) NаОН , г) НзАsO4 5. Какое из приведенных веществ является наиболее сильным электролитом? а) НNOз , б) Н2СО3 , в) Н2SiO3 , г) Н3РO4 6. Лакмус не изменит окраску в водном растворе: а) оксида кремния б) гидроксида бария в) азотной кислоты г) оксида кальция 7. Какие ионы не могут присутствовать в растворе одновременно? а) Н+, К+, NO б) Nа+, Cu2+ , NO в) Н+ , Са2+, С1-, NO г) Мg2+, H+ , Вг -, С1- 8. С каким веществом будет взаимодействовать водный раствор сульфата меди (II)? а) НС1 , б) NаNОз , в) Аg , г) КОН 9. Гидроксид цинка будет взаимодействовать с: а) Мg, б) раствором Nа2SO4 , в) СаСОз, г) раствором КОН 10. Разбавленная серная кислота не будет реагировать с: а) А1(ОН)з , б) Мg , в) раствор К2SiO3, г) правильного ответа нет 11. Сульфат свинца (II) можно получить при помощи реакции ионного обмена между: а) Рb и разбавленной Н2SO4 б) раствором Pb(NO3)2 и ВаSO4 в) раствором Pb(NO3)2 и Н2SO4 г) РbO и SO3 12. Гидроксид железа (III) образуется при реакции между: а) раствором FeСlз и раствором КОН б) раствором FeCl2 и раствором КОН в) Fe и Н2O г) Fe2 O3 и Н2O 13. Составьте полное и сокращенное ионное уравнения реакций между гидроксидом меди (II) и серной кислотой. Найдите суммы всех коэффициентов в полном и сокращенном ионном уравнениях соответственно: а) 12 и 3 , б) 8 и 6 , в) 10 и 6 , г) 10 и 3 14. Ионное уравнение Са2+ + СО соответствует взаимодействию между: а) СаSiO3 и раствором Na2СО3 б) раствором Са(ОН)2 и СО2 в) СаО и СO2 г) раствором Са(NO3)2 и раствором К2СО3 15. Найдите количество вещества, выпадающего в осадок при сливании раствора, содержащего 0,2 моль сульфата меди (II), и раствора, содержащего 0,3 моль гидроксида калия. а) 0,3 моль , б) 0,2 моль , в) 0,15 моль , г) 0,1 моль 16. Найдите массу осадка, образующегося при сливании раствора, содержащего 4г сульфата меди (II) и раствора, содержащего 4г гидроксида натрия. а) 2,45г , б) 4,9г , в) 4г , г) 0,1г Галогены Вариант 1 1. Назовите жидкий галоген: а) хлор; б) фтор; в) бром; г) йод 2. Определите степень окисления хлора в веществе KClO3 : а) –1; б) +1; в) +5; г) +7 3. Какой из галогенов обладает наименьшей активностью: а) йод; б) фтор; в) хлор; г) бром 4. Какая из предложенных реакций осуществима: Напишите уравнение а) NaJ + F2 = б) KJ + Cl2 = в) NaF + Cl2 = г) KCl + J2 = 5. Какой объем хлороводорода образуется при взаимодействии 5л хлора и 2л водорода (н.у.)? а) 2л; б) 5л; в) 3л; г) 4л 6. HСlO3 – это кислота: а) хлорноватистая; б) хлористая; в) хлорноватая; г) хлорная 7. Назовите вещество А, напишите уравнения реакций: +H2 +KOH +AgNO3 +HNO3 +KBr      I2 X1 X2 X3 X4 A I2 X1 X2 X3 X4 Aа) иодид серебра; б) нитрат серебра; в) бромид серебра; г) серебро 8. Сколько литров кислорода выделяется при разложении на свету 400 мл 12% раствора хлорноватистой кислоты? (н,у.) (= 1,12 г/мл)? 9. Соляная кислота – это: а) раствор хлороводорода в спирте; б) раствор хлора в воде; в) раствор хлороводорода в воде; г) раствор хлора в спирте 10. Пищевая соль – это: а) KI; б) NaCl; в) KCl; г) AgI Вариант 2 1. Назовите твердый галоген: а) бром; б) йод; в) хлор; г) фтор 2. Определите степень окисления хлора в хлорной кислоте HClO4: а) +5; б) +1; в) -1; г) +7 3. Какой из галогенов наиболее электроотрицателен: а) йод; б) бром; в) хлор; г) фтор 4. Составьте уравнение реакции взаимодействия брома с водой. Назовите получившиеся продукты. 5. Сколько литров кислорода выделится при термическом разложении 12,25г хлората калия? ( н.у.) а) 3,36л; б) 2,24л; в) 11.2л; г) 22,4л 6. HIO– это кислота: а) йодистая; б) йодная; в) йодноватая; г) йодноватистая 7. Определите вещество А, напишите уравнения реакций: +Cl2 +H2 +Na Cl2 AgNO3      NaBr X1 X2 X3 X4 A NaBr X1 X2 X3 X4 Aа) фторид серебра; б) хлор; в) хлорид серебра; г) хлорат серебра 8. Какой объем хлора выделится при реакции оксида марганца (IV) c 400 мл 18% раствора соляной кислоты(= 1,12 г/мл)? (н.у.) 9. В растворе соляной кислоты лакмусовая бумажка: а) не изменяет окраску; б) синеет; в) краснеет; г) становится фиолетовой 10. Для получения хлора в лаборатории применяется: а) бертолетова соль; б) соляная кислота; в) азотная кислота; г) серная кислота Вариант 3 1. Какую окраску имеет хлор: а) красно-бурую; б) желто-зеленую; в) фиолетовую; г) черную 2. Какой из галогенов из твердого состояния может переходить в газообразное, минуя жидкое состояние: а) фтор; б) бром; в) хлор; г) йод 3. Определите степень окисления хлора в хлорноватистой кислоте: а) +1; б) -1; в) +3; г) +5 4. С каким из данных веществ реагирует хлор? Напишите уравнение. а) NaCl; б) H2SO4; в) NaOH; г) HF 5. Какая масса йода выделится при реакции 40г иодида натрия с 6,72л хлора? (н.у.) 6. Бертолетова соль - это: а) хлорит калия; б) хлорат калия; в) перхлорат калия; г) хлорат натрия 7. Определите вещество А, напишите уравнения реакций: +H2 +Cl2 +Mg +Cl2 +AgNO3      Br2 X1 X2 X3 X4 A Br2 X1 X2 X3 X4 Aа) нитрат серебра; б) бромид серебра; в) йодид серебра; г) хлорид серебра 8. Какой объем хлора должен вступить в реакцию с водородом для получения 250 мл 15% раствора соляной кислоты (= 1,16 г/мл? (н.у.) 9. Соляная кислота не реагирует с: а) оксидами неметаллов; б) с металлами в ряду активности до водорода; в) со щелочами; г) с нерастворимыми основаниями Минерал KCl NaCl это: а) лазурит; б) сильвинит; в) карналлит; г) доломит |
