Глава 4. ТИТАН И ЦИРКОНИЙ. Титан и цирконий общие сведения
 Скачать 2.64 Mb. Скачать 2.64 Mb.
|
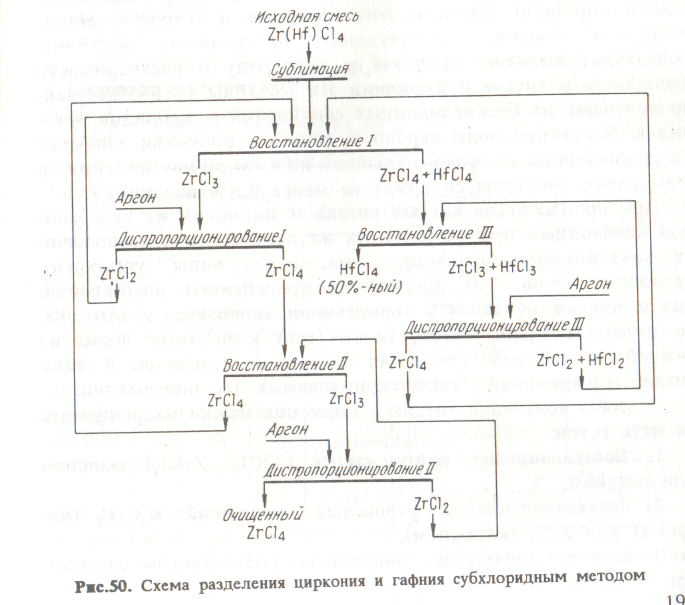
0,1 МПа и температурах 390-405 С реакция протекает вправо с образованием малолетучего ZгС13. При этом НЕС14 не восстанавливается и отгоняется. При температурах 420-450 °С трихлорид диспропорционирует с образованием ZгС14 и ZгС12, причем первый отгоняется.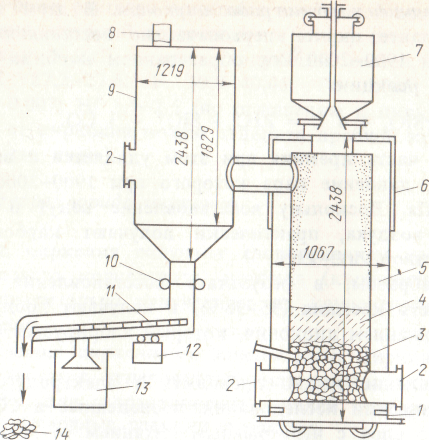 Рис.47. Схема печи для хлорирования карбонитрида циркония: 1 - патрубок для подачи хлора; 2 - люк; 3 - коксовая постель; 4 - карбонит-рид; 5 - динасовая футеровка; 6 - расширительное соединение; 7 - бункер с карбонитридом; 8 - вытяжная труба; 9 - конденсатор 2гС14; 10 - гибкое соединение; 11 - сито; 12 - электромагнитный вибратор; 13 - сборник мелкой фракции; 14 - крупная фракция Тетрахлорид циркония конденсируется в никелевом конденсаторе при температуре 150 С. Полученный хлорид затем очищают возгонкой. Карбонитрид можно также эффективно хлорировать в печи кипящего слоя. Разделение циркония и гафния Для применения в атомной энергетике необходим цирконий, содержащий менее 0,01 % гафния. Между тем минералы циркония всегда содержат гафний. Его содержание в цирконе составляет 0,5-2,5 % (по отношению к цирконию). Представляет интерес также попутное получение чистого гафния. Среди разработанных методов разделения циркония и гафния промышленное значение имеют: фракционная кристаллизация комплексных фторидов; жидкостная экстракция; ректификация хлоридов; 4) избирательное восстановление хлоридов (субхлоридный способ). Возможно разделение гафния и циркония ионообменными способами, но в настоящее время их не применяют в промышленности из-за малой производительности по сравнению с экстракционными методами. Фракционная кристаллизация комплексных фторидов. Метод основан на различии растворимости К2ZгF6 и К2НfF6. Растворимость гафниевой соли в воде примерно в 2-2,4 раза выше растворимости циркониевой соли. Это позволяет осуществить дробную кристаллизацию, концентрируя гафний в маточном растворе. Учитывая значительное изменение растворимости солей с температурой (растворимость при 20 °С примерно в 9 раз ниже, чем при 80°С), осуществляют кристаллизацию путем охлаждения насыщенного при 80-90 С раствора до 15-20 С. При растворении кристаллов соблюдается отношение Т:Ж = 1:7, что соответствует концентрации 0,5 моль/л К2ZrF6 (или около 140 г/л). При содержании в К2ZrF6 2,5 % Hf (по отношению к цирконию) за 16-18 последовательных кристаллизации получают соль циркония, содержащую менее 0,01 % Hf. Для повышения выхода чистых кристаллов К2ZrF6 каждую фракцию кристаллов растворяют в маточных растворах предыдущих кристаллизации. Это обеспечивает выход кристаллов около 80%. Первые и вторые маточные растворы, наиболее богатые гафнием, выводят из цикла кристаллизации, упаривая до 1/5-1/6 первоначального объема. Выделившиеся из упаренного раствора кристаллы К2ZrF6 с примесью гафния возвращают на первую стадию кристаллизации, а из маточного раствора осаждают аммиаком гидроксид циркония с содержанием около 6% гафния. Он служит исходным продуктом для получения гафния методом экстракции. Преимущества метода дробной кристаллизации заключаются в его простоте, отсутствии затрат на реагенты. Недостаток его - периодичность проведения операций. Жидкостная экстракция. Цирконий и гафний можно разделить экстракцией из водных растворов экстрагентами различного типа: фосфорорганическими соединениями, кетонами, аминами. В качестве примера рассмотрим экстракцию ТБФ, который широко используют в промышленной практике. ТБФ - бутиловый эфир фосфорной кислоты, экстрагирует цирконий и гафний из кислых растворов основных хлоридов или нитратов этих элементов. Наиболее удобны для разделения растворы нитратов, содержащие свободную азотную кислоту. Экстракция протекает с образованием сольвата по реакции: Zг(ОН)22+ +2Н+ + 4 N0-3 + 2 ТБФ = Zг(NO3)4*2ТБФ +2Н2О. Так как ТБФ имеет высокую плотность и вязкость, его иногда разбавляют инертным разбавителем (керосином, углеводородами). Экстракцию проводят в колоннах или каскаде экстракторов типа смеситель-отстойник по схеме полного противотока. В качестве примера на рис. 49 приведен один из режимов разделения. Питающий раствор (125 г/л ZгО2, 5 н. НNО3 и 2,4 % Hf (по отношению к цирконию) вводят в пятую ступень каскада смесителей-отстойников. Здесь он соединяется с промывочным раствором (5,4 н НNО3), движущимся от первой ступени противотоком к органической фазе, которая поступает на 14-ю ступень. Экстракцию осуществляют раствором 40 % ТБФ в n-гептане (С7Н16). Цирконий и азотную кислоту реэкстрагируют из органической фазы водой. В результате экстракционного разделения получают циркониевый продукт с содержанием гафния ниже 0,01 %. Гафниевый рафинат содержит более 90 % гафния. Другой распространенный вариант - экстракция ТБФ или кетонами (например, МИБК) из солянокислых растворов, содержащих ионы роданида SСN- 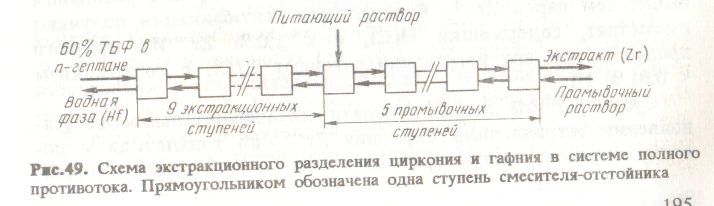 В растворах, содержащих роданид-ионы, цирконий и гафний присутствуют в форме малодиссоциированных молекул Ме(SСN)4 и Ме(ОН)2(SСN)2. Из таких растворов ТБФ и кетоны экстрагируют преимущественно гафний с образованием сольвата Ме(ОН)2(SСN)2 • 2 ТБФ (или 2 Кеt). В результате разделения получают гафниевый продукт с содержанием 98 % Hf и циркониевый продукт с содержанием Hf < 0,1 %. Эти продукты, если необходимо, могут быть дополнительно очищены. Ректификация и избирательное восстановление хлоридов. Эти методы представляют значительный интерес, так как в результате разделения получаются чистые хлориды ZгС14 и HfС14, которые можно непосредственно использовать для производства металлов. Ректификация хлоридов. Усложняющим обстоятельством для ректификационного разделения является то, что при нормальном давлении тетрахлориды циркония и гафния возгоняются до плавления. Они плавятся лишь под давлением своих паров. Так, ZгС14 плавится при 437 С под давлением |