Глава 4. ТИТАН И ЦИРКОНИЙ. Титан и цирконий общие сведения
 Скачать 2.64 Mb. Скачать 2.64 Mb.
|
2,5 м футерована динасовым кирпичом. Хлор поступает в печь через дырчатую графитовую плиту, на которую загружают слой кускового кокса. Процесс начинается с разогрева коксовой постели нагретым воздухом. Затем на нагретую постель загружают карбонитрид и впускают хлор. Интенсивное хлорирование начинается при 400 С и далее продолжается за счет теплоты реакции.
125кДж недостаточно для самопроизвольного протекания процесса, необходим постоянный подвод тепла. Хлорирование проводят в шахтных хлораторах непрерывного действия, куда загружается брикетированная шихта. При содержании в брикетах 25-30 % углерода брикеты при температуре хлорирования обладают достаточной электропроводностью, что позволяет нагревать шихту с помощью графитовых электродов, вмонтированных в стенках хлоратора. Для прохождения тока через горячую шихту требуется напряжение
25 г/л), что позволяет после охлаждения раствора выделить в кристаллы 70-80 % циркония, содержащегося в растворе. Основной хлорид выделяется в виде крупных кристаллов, имеющих форму тетрагональных призм, легко отделяемых от маточного раствора.
6 т на 1т ZrО2) многократно промывают водой. В некоторых производственных схемах рационально сочетается выщелачивание известковых спеков соляной и серной кислотами, что обспечивает получение различных соединений циркония (рис. 45).ПРОИЗВОДСТВО ХИМИЧЕСКИХ СОЕДИНЕНИЙ ЦИРКОНИЯ И ГАФНИЯ Циркониевые минералы, руды и рудные концентраты Содержание циркония в земной коре относительно высокое - 0,025 % (по массе). По распространенности он превосходит медь, цинк, олово, никель и свинец. Известно около 20 минералов циркония. Они концентрируются главным образом в гранитных и щелочных (нефелин-сиенитовых) пегматитах. Основными промышленными источниками в настоящее время служат минералы бедделеит и циркон. Сырьем могут служить также минералы эвдиалит и эвколит, но они значительно бедней по содержанию циркония. Бадделеит. По составу представляет собой почти чистый диоксид циркония. В наиболее чистых образцах до 98 % ZrО2. Обычно содержит примесь гафния (до нескольких процентов), изредка уран (до 1 %) и торий (до 0,2 %). Месторождения редки. Плотность минерала 5,5-6. Наиболее крупное месторождение найдено в Бразилии. Основные методы обогащения руд - гравитационные. Для отделения минералов железа и ильменита используют электромагнитное обогащение. Циркон - ортосиликат циркония ZrSiО4 (67,2 % ZrО2, 32,8 % SiО2). Это наиболее распространенный минерал циркония. Концентрируется главным образом в пегматитах гранитной и особенно щелочной магмы. Часто встречается в россыпях, образующихся при разрушении коренных пород. Циркон большей частью имеет коричневый цвет, плотность минерала 4,4-4.7 г/см3, твердость 7,5 по минералогической шкале. Минерал обычно содержит гафний (0,5-4 %). Основные запасы циркона сосредоточены в прибрежно-морских россыпях. Здесь циркон накапливается вместе с ильменитом, рутилом, монацитом и рядом других минералов. Руды, содержащие циркон, обогащают гравитационными методами в сочетании с магнитной и электростатической сепарациями. Выпускаемые цирконовые концентраты первого сорта должны содержать не менее 65% ZrО2. В них лимитируется содержание следующих примесей, % (не 6oлее): FeO 0,1; TiО2 0,4; A12O3 2,0; СаО и MgO 0,1; P2O5 0,15. Концентраты второго сорта должны содержать не менее 60% ZrО2, примеси не лимитируются. Наиболее крупные месторождения циркона за рубежом расположены в Австралии, Индии, Бразилии, ЮАР, США. В СНГ циркон найден на Урале, Украине и в других районах страны. Эвдиалит и эвколит. Состав эвдиалита может быть выражен общей эмпирической формулой: (Nа, Са)6 Zr [Si 6О18][ОН,С1]2. Эвколит - разновидность эвдиалита, содержащего ионы Fе2+. Химический состав эвдиалита, %: Nа2О 11,6-17,3; ZrO2 12-14,5; FеО 3,1-7,1; SiO2 47,2-51,2; С1 0,7-1,6. Цвет минерала - розовый или малиновый. Минерал легко разлагается кислотами. Эвдиалит и эвколит встречаются в магматических щелочных породах (нефелиновых сиенитах). Известны месторождения в СССР (на Кольском полуострове), Португалии, Гренландии, Трансваале, Бразилии и других странах. В капиталистических странах в 1986г. было добыто 830 тыс.т цирконовых концентратов, в том числе в Австралии - 470, ЮАР - 150, США - 85. Продукты переработки цирконовых концентратов Цирконовые концентраты служат исходным материалом для производства ферросиликоциркония, ферроциркония и химических соединений циркония: диоксида циркония, фтороцирконата калия и тетрахлорида циркония, а также соединений гафния. Ферросиликоцирконий непосредственно выплавляют из цирконовых концентратов. Технический диоксид циркония служит исходным материалом для получения ферроциркония и используется в производстве огнеупоров и керамики. Диоксид циркония высокой чистоты применяют для производства высококачественных огнеупорных изделий и порошкообразного циркония. Фтороцирконат калия и тетрахлорид циркония используют главным образом для производства металлического циркония. Ниже рассмотрены основные способы производства соединений циркония. Производство диоксида циркония Разложение концентрата Циркон практически не разлагается соляной, серной и азотной кислотами. Для его разложения с целью перевода циркония в раствор используют большей частью спекание (или сплавление) с содой или спекание с карбонатом кальция (мелом). Образующиеся цирконаты натрия или кальция растворяются в кислотах, из раствора затем выделяют гид-роксид или основные соли циркония. Последние термически разлагают, получая диоксид циркония. Разложение циркона спеканием с карбонатом натрия. При 1100-1200 °С сода реагирует с цирконом с образованием метацирконата и ортосиликата натрия: ZrSiO4 + 3Na2CO3= Na2ZrO3+Na4SiO4+2CO2. (4.23) Процесс можно проводить в барабанных печах непрерывного действия, питая печь гранулированной шихтой (размер гранул 5-10 мм). Грануляцию проводят на чашевом грануляторе при увлажнении шихты. Измельченный спек первоначально выщелачивают водой для извлечения в раствор большей части ортосиликата натрия. Осадки после водного выщелачивания обрабатывают соляной или серной кислотой. В первом случае получают солянокислый раствор, содержащий основной хлорид цирконила ZrОС12, во втором случае - растворы, содержащие основной сульфат циркония Zr(ОН)2SО4. При кислотной обработке образуется кремниевая кислота, для коагуляции которой в пульпу добавляют флокулянт полиакриламид. Осадки отделяют от цирконийсодержащих растворов фильтрацией. Разложение циркона спекании с карбонатом кальция. Процесс основан на взаимодействии циркона с СаСО3: ZrSiO4 + 3СаСО3 = СаZrО3 + Са2SiO4 + 3 СО2. (4.24) Эта реакция протекает с достаточной скоростью лишь при 1400-1500 °С. Однако добавки в шихту небольшого количества хлорида кальция ( |
Выделение циркония из растворов и получение ZrО2
Растворы, полученные в результате выщелачивания содовых или известковых спеков, содержат цирконий (100-200 г/л) и примеси железа, титана, алюминия, кремния и др. В промышленной практике применяют четыре способа выделения циркония из растворов:
Выделение основного хлорида Zr(ОН)2С12•7 Н2О.
Выделение основных сульфатов циркония.
Осаждение кристаллогидрата сульфата циркония Zг(S04)2•4 Н20.
Кристаллизация сульфато-цирконатов натрия или аммония (дубитель для кожевенной промышленности).
Ниже рассмотрены наиболее распространенные первые два способа.
Выделение основного хлорида. Способ основан на малой растворимости кристаллогидрата Zг(ОН)2С12•7 Н2О в концентрированной соляной кислоте, в то время как в воде и разбавленной НС1 растворимость высокая.
| Концентрация HCI, г/л | 7,2 | 135,6 | 231,5 | 318 | 370 |
| Растворимость при 20 °С Zг(ОН)2С12•7 Н2О г/л | 567,5 | 164,9 | 20,5 | 10,8 | 17,8 |
Растворимость основного хлорида в концентрированной НС1 при 70 °С примерно в 5 раз выше, чем при 20 °С. Выпариванием нельзя достигнуть концентрации НС1 выше
Способ дает возможность получить соединения циркония высокой чистоты, так как большинство примесей остается в солянокислом маточном растворе.
Из основного хлорида легко можно получить другие соединения циркония. Для получения ZгО2 основной хлорид растворяют в воде и осаждают добавлением раствора аммиака гидроксид циркония. Прокаливанием последнего при 600-700 °С получают диоксид с содержанием ZгО2 99,6-99,8 %. Для получения других соединений (нитрата, фторидов) гидроксид растворяют в соответствующей кислоте.
Выделение основных сульфатов. Малорастворимые основные сульфаты, состав которых можно выразить общей формулой х ZгО2• у SО3•z Н2О (х>у), выделяются из растворов при рН = 2+3 и мольном отношении SО3:ZгО2 в исходном растворе в пределах 0,55-0,9.
При нейтрализации сернокислого раствора, содержащего значительный избыток кислоты, содой или аммиаком, гидролитическое выделение основного сульфата циркония не происходит. Это объясняется тем, что в таких растворах цирконий находится в составе прочных анионов [ZгО(SО4)2]2-, образующих с катионами натрия и аммония хорошо растворимые соли. Гидролиз наступает лишь в случае вывода части ионов
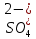 из растворов, например добавлением ВаС12 или СаС12, что усложняет технологию.
из растворов, например добавлением ВаС12 или СаС12, что усложняет технологию.Значительно проще гидролитическое выделение основных сульфатов из солянокислых или азотнокислых растворов, так как в этом случае в раствор вводится дозированное количество сульфат-ионов (добавляют Н2SО4 или Ка2SО4).
Для осаждения основного сульфата в солянокислый раствор, содержащий 40-60 г/л циркония, добавляют Н2SО4 (0,5-0,7 моля на 1 моль ZгО2), нейтрализацией и разбавлением доводят кислотность до 1-1,5 г/л по НС1, а затем нагревают раствор до 70-80 °С. В осадок выделяется 97-98 % циркония, его состав примерно соответствует формуле 2ZгО2-SО3-5 Н2О.
Осадок основного сульфата после промывки, фильтрации и сушки прокаливают для удаления SО3 при 850-900 С в муфельных печах, футерованных высокоглиноземистым огнеупором. Получаемый технический диоксид циркония содержит 97-98 % ZгО2. Основные примеси следующие, %: ТiO2 0,25-0,5; SO2 0,2-0,5; Fе2О3 0,05-0,15; СаО 0,2-0,5; SО3 0,3-0,4.
Получение фтороцирконата калия
Наиболее просто фтороцирконат калия можно получить из цирконового концентрата по технологии, разработанной Н.П.Сажиным и Е.А.Пепеляевой. Способ основан на реакции, протекающей при нагревании циркона с фторосиликатом калия:
ZrSO4 + К2SiF6 = К2ZrF6 + 2 SiO2.
Рuс.46. Диаграмма состояния системы
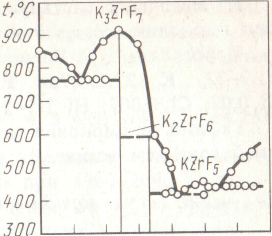
О Ю 20 30 40 50 60 70
КF %(мол.) ZrF4
Как видно из диаграммы состояния системы КF-ZrF4 (рис.46), выше 600 °С К22гР6 разлагается с образованием К3ZrF7 и расплава, содержащего КF и ZrF4:
2 К2ZrF6 = К3ZrF7 + КF + ZrF4.
Поэтому продукт спекания, помимо К2ZrF6, может содержать некоторое количество К3ZrF7.
Полно циркон разлагается в интервале 650—700 С при условии введения в шихту хлористого калия, подавляющего диссоциацию К2SiF6 с образованием летучего SiF4.
При температурах спекания в шихте в результате взаимодействия компонентов образуется жидкая фаза, что способствует быстрому протеканию процесса. Получающийся в результате разложения спек выщелачивают водой. Из раствора затем кристаллизуют К2ZrF6.
Шихту, состоящую из измельченного циркона, фторосиликата калия (взятого с избытком