Учебник для студентов фармацевтических вузов и факультетов Под редакцией
 Скачать 6.03 Mb. Скачать 6.03 Mb.
|
|
ХАРАКТЕРИСТИКА ВЫСОКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ Высокомолекулярными соединениями называются природные или синтетические вещества с молекулярной массой от нескольких тысяч (не ниже 10—15 тысяч) до миллиона и более. Молекулы этих соединений представляют гигантские образования, состоящие из сотен и даже тысяч отдельных атомов, связанных друг с другом силами главных валентностей, поэтому такие молекулы принято называть макромолекулами. Молекулы высокомолекулярных соединений (ВМС) чаще всего представляют собой длинные нити, переплетающиеся между собой или свернутые в клубки, причем длина их значительно больше поперечника. Так, длина молекулы целлюлозы равна 400—500 нм, а поперечник 0,3—0,5 нм. Следовательно, эти молекулы резко ани-зодиаметричны и при соприкосновении с соответствующим растворителем образуют истинные (молекулярные) растворы. Характерная особенность большинства ВМС — наличие в их молекулах многократно повторяющихся звеньев. Это повторение зависит от степени полимеризации. Отсюда эти вещества имеют еще и второе название — полимеры. Исследованиями последних десятилетий доказано, что растворы ВМС нельзя отнести к типичным коллоидным системам, хотя они обладают свойствами, характерными для коллоидных растворов: своеобразие частиц растворенного вещества; движение аналогичное броуновскому; малые скорости диффузии в их растворах из-за больших размеров молекул ВМС, вследствие чего они не способны проникать через полупроницаемые мембраны; малые значения осмотического давления; более медленное протекание в растворах ряда процессов (включая и химические), повышенная склонность к образованию разнообразных химических комплексов и др. Все это указывает на то, что растворы ВМС совмещают в себе свойства как истинных, так и коллоидных растворов. Объясняется это тем, что в растворах ВМС растворенное вещество раздроблено на молекулы, и, следовательно, эти растворы представляют гомогенные и однофазные системы. При растворении ВМС растворы образуются самопроизвольно, то есть не требуется специальных добавок для их образования. Растворы ВМС — термодинамически равновесные системы, которые длительное время являются устойчивыми, если нет воздействия внешних факторов (например, растворов электролитов). Растворы ВМС по молекулярно-кинетическим свойствам ничем не отличаются от растворов низкомолекулярных соединений. Несмотря на то что макромолекулы не обнаруживаются в ультрамикроскопе, они обладают способностью светорассеяния, приводящей к опалес-ценции или некоторой мутности раствора. О свойствах ВМС и их растворов подробно изложен материал в курсах органической, физической и коллоидной химий. Все ВМС вследствие их большой молекулярной массы не летучи и не способны перегоняться. По этой же причине они весьма чувствительны к воздействию различных внешних факторов. Макромолекулы легко распадаются под воздействием самых незначительных количеств кислорода и других деструктивных агентов. Большинство ВМС при повышении температуры размягчаются постепенно и не имеют определенной температуры плавления. У этих веществ температура разложения ниже температуры кипения, в связи с чем они могут находиться только в конденсированном состоянии. Гигантские цепочкообразные молекулы ВМС по отдельным звеньям неоднородны, имеют дифильный характер. Отдельные звенья состоят из атомных групп, имеющих полярный характер. К числу полярных атомных групп принадлежат —СООН, —NH2, —ОН и др. Эти радикалы хорошо взаимодействуют с полярными жидкостями (водой, спиртом и др.) — гидратируются, иначе говоря, они гидрофильны. Наряду с полярными макромолекулы содержат неполярные, гидрофобные радикалы —СН3, —СН2 —С6Н5 и др., которые могут сольватироваться неполярными жидкостями (бензол, петро-лейный эфир и др.), но не могут гидратироваться. В природных ВМС почти всегда преобладают полярные группы, поэтому, попадая в воду, они ведут себя как гидрофильные вещества. Чем больше полярных участков в молекуле ВМС, тем лучше оно растворимо в воде. Свойства ВМС зависят от величины и от формы их молекулы. Так, ВМС, обладающие сферическими молекулами (гемоглобин, гликоген, пепсин, трипсин, панкреатин и др.), обычно представляют собой порошкообразные вещества и при растворении почти не набухают. Растворы этих веществ обладают малой вязкостью далее при сравнительно больших концентрациях и подчиняются законам диффузии и осмотического давления. ВМС с сильно асимметричными линейными (разветвленными), вытянутыми молекулами (желатин, целлюлоза и ее производные) при растворении сильно набухают и образуют высоковязкие растворы, не подчиняющиеся закономерностям, присущим растворам низкомолекулярных веществ. Растворение ВМС с линейными молекулами сопровождается набуханием, последнее является первой стадией их растворения. Причина набухания в том, что при растворении происходит не только диффузия молекул растворяемого вещества в растворитель, как это происходит при растворении низкомолекулярного вещества (НМВ), но и диффундирование растворителя в ВМС. Набухание заключается в следующем: молекулы низкомолекулярной жидкости-растворителя, подвижность которых во много раз больше подвижности макромолекул, проникают в погруженное в нее ВМС, заполняя свободные пространства между макромолекулами. Дальше растворитель начинает поступать внутрь набухающего вещества в нарастающем количестве благодаря гидратации полярных групп указанных соединений. Основное значение гидратации заключается в ослаблении межмолекулярных связей, разрыхлении этих соединений. Образующиеся просветы заполняются новыми молекулами растворителя. Раздвиганию звеньев и цепей макромолекул способствуют и осмотические явления, протекающие одновременно с гидратацией полярных групп высокомолекулярных соединений. После того, как будут разрушены связи между макромолекулами, то есть когда нити их будут достаточно отодвинуты друг от друга, макромолекулы, получив способность к тепловому движению, начинают медленно диффундировать в фазу растворителя. Набухание переходит в растворение, образуя однородный истинный (молекулярный) раствор. Таким образом, растворение ВМС с линейными макромолекулами протекает в две стадии: первая (сольватация-гидратация) сопровождается выделением тепла, то есть убылью свободной энергии и объемным сжатием. Основное назначение этой стадии при растворении сводится к разрушению связей между отдельными макромолекулами. Во второй стадии набухания жидкость поглощается без выделения тепла. Растворитель просто диффузно всасывается в петли сетки, образуемой спутанными нитями макромолекул. В этой стадии происходит поглощение большого количества растворителя и увеличение объема набухающего ВМС в 10—15 раз, а также смешивание макромолекул с маленькими молекулами растворителя, что можно рассматривать как чисто осмотический процесс. Следует иметь в виду, что набухание такого соединения не всегда заканчивается его растворением. Очень часто после достижения известной степени набухания процесс прекращается. Набухание может быть неограниченным и ограниченным. Неограниченное набухание заканчивается растворением. Соединение сначала поглощает растворитель, а затем при той лее температуре переходит в раствор. При ограниченном набухании высокомолекулярное соединение поглощает растворитель, а само в нем не растворяется, сколько бы времени оно не находилось в контакте. Ограниченное набухание такого соединения всегда заканчивается образованием эластичного геля (студня). Однако ограниченное набухание, обусловленное ограниченным растворением, часто при изменении условий переходит в неограниченное. Так желатин и агар-агар, набухающие ограниченно в холодной воде, в теплой воде набухают неограниченно, чем пользуются при растворении этих веществ. Набухание ВМС носит избирательный характер. Они набухают лишь в жидкостях, которые близки им по химическому строению. Так, соединения, имеющие полярные группы, набухают в полярных растворителях, а углеводородные — только в неполярных жидкостях. Растворы ВМС, если они находятся в термодинамическом равновесии, являются, как и истинные растворы, агрегативно устойчивыми. Однако при введении больших количеств электролитов наблюдается выделение ВМС из раствора. Но это явление не тождественно коагуляции типичных коллоидных систем, которая происходит при введении небольших количеств электролита и является необратимым процессом. Выделение из раствора ВМС происходит при добавлении больших количеств электролита и является обратимым процессом — после удаления из осадка электролита промыванием или диализом ВМС снова становится способным к растворению. Различен и механизм обоих явлений. Коагуляция происходит в результате сжатия двойного электрического слоя и уменьшения или полного исчезновения электрического заряда, являющегося основным фактором устойчивости. Выделение из раствора полимера при добавлении большого количества электролита объясняется простым уменьшением растворимости ВМС в концентрированном растворе электролита и принято называть в ы-саливанием. Высаливающее действие различных осадителей — следствие их собственной сольватации, при которой происходит затрата растворителя, ведущая к снижению растворимости ВМС. При добавлении нейтральных солей их ионы, гидратируясь, отнимают воду у молекул ВМС. При высаливании главную роль играет не валентность ионов, а их гидратируемость. Высаливающая роль электролитов, главным образом, зависит от анионов, причем по высаливающему действию анионы можно расположить в следующем порядке: сульфат-ион, цитрат-ион, ацетат-ион, хлорид-ион, роданид-ион. Высаливающим действием обладают не только анионы, но и катионы, такие, как литий, натрий, калий, рубидий, цезий. Из этих соединений чаще всего применяются соединения, содержащие катионы натрия и калия. Они занимают второе место после анионов по высаливающему действию. При добавлении электролита растворимость ВМС понижается и оно выпадает в осадок. Чем выше гидратируемость ионов, тем сильнее их высаливающее действие. Поэтому при приготовлении растворов ВМС по прописям, включающим осадители, целесообразно последние добавлять к раствору ВМС в виде раствора. ВМС необходимо обязательно растворять в чистом растворителе, так как в растворе солей растворение этих веществ происходит трудно. Дегидратация растворенного соединения, а следовательно, и высаливание его могут быть вызваны и неионизированными веществами, например спиртом. Высаливающе действуют также концентрированные растворы сахара (сиропы). Эти вещества гидратируются за счет макромолекул. Растворитель, затраченный на их гидратацию, уже теряет способность участвовать в растворении первоначально растворенного ВМС. Сахар и спирт оказывают сильно дегидратирущее действие при введении в значительных количествах, поэтому их необходимо добавлять к раствору ВМС частями при взбалтывании. Под действием перечисленных факторов наблюдается также явление коацервации — разделение системы на два слоя. Коацервация отличается от высаливания следующим. Вещество, то есть дисперсная фаза, не отделяется от растворителя в виде твердого хлопьевидного осадка, а собирается сначала в невидимые невооруженным глазом жирные капли, которые постепенно сливаются в капли большого размера, а затем происходит расслаивание на два слоя: первый — концентрированный слой полимера и растворителя; второй — разбавленный раствор того же полимера. Под действием низких температур возможны и такие явления, как желатинирование или застудневание, и синерезис. От высаливания застудневание отличается тем, что не происходит разделения системы с образованием осадка, а вся система в целом переходит в особую промежуточную форму своего существования — студень, или гель, причем это состояние характеризуется полной утратой текучести. Например, раствор желатина застудневает при понижении температуры, при ее повышении он приобретает текучесть и становится раствором, который можно применять. Процесс застудневания может происходить в самом студне, что может привести к разделению системы на две фазы: концентрированный студень и растворитель, который содержит молекулы ВМС. Это явление застудневания, которое происходит в студне, называется синерезис, что характерно для растворов крахмала. ВМС и их растворы имеют очень важное значение в самых различных отраслях промышленности, сельском хозяйстве, а также медицине и фармации. В медицине их используют как лекарственные средства (ферменты, полисахариды, слизи, экстракты и др.) и как вспомогательные вещества при приготовлении различных лекарственных форм (основы для суппозиториев и мазей, эмульгаторы, стабилизаторы, пролонгаторы, солюбилизаторы, корригенты как добавки при приготовлении кровезаменителей), а также в качестве упаковочного материала при отпуске лекарственных препаратов, для изготовления флаконов, пленок, пробок, банок и других упаковочных изделий. КЛАССИФИКАЦИЯ ВЫСОКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ Высокомолекулярные соединения (ВМС) принято классифицировать по следующим признакам: 1. По источникам получения: природные (белки, ферменты, пектины, камеди, полисахариды, растительные слизи, в том числе густые и сухие экстракты, многие смолы и др.), полу синтетические (эфиры целлюлозы — метилцеллюлоза, натрий-карбоксиметилцел-люлоза, ацетилфталилцеллюлоза) и синтетические (поливиниловый спирт, поливинилацетат, поливинилпирролидон, полисилоксаны, по-лиэтиленоксиды и др.). 2. По способности к растворению: ограниченно и неограниченно набухающие. 3. По применению: лекарственные (пепсин, трипсин, панкреатин и др.) и вспомогательные (стабилизаторы суспензий и эмульсий, основы для мазей, суппозиториев, пленкообразователи, жиро-сахара и др.) вещества. Природные высокомолекулярные вещества. В аптечной практике из природных ВМС наиболее широко применяют высшие полисахариды общей формулы (С4Н10О5)п. Представитель этой группы крахмал (Amylum). Официальными являются 4 сорта крахмала, которые допускаются к употреблению с медицинскими целями: пшеничный (AmylumTritici), кукурузный (AmylumMaydis), рисовый (AmylumOryzae) и картофельный (AmylumSolani). Большую часть сухой массы крахмалов составляют полисахариды (97,3—98,9 %), остальное — белковые вещества (0,28—1,5 %), клетчатка (0,2—0,69 %), минеральные вещества (0,3—0,62 %). Основная часть крахмала — амилаза и амилопектин. Молекулы амилазы представляют собой слабо разветвленные частицы, состоящие из гликозидных остатков (до 700), связанных между собой главными валентностями. Молекулярная масса ее находится в пределах 32000—160000. Амилаза растворима в горячей воде с образованием прозрачного раствора. Амилопектин имеет более сложное строение и состоит из более разветвленных молекул, содержащих до 2000 гликозидных остатков. Молекулярная масса его находится в пределах 100000—1000000. Содержание амилопектина в крахмале составляет 10—20 %. Переход крахмала в раствор может происходить только при нагревании: зерна крахмала набухают, разрываются и образуется густая жидкость — крахмальный клейстер в виде вязкого гидрозоля. Различные сорта крахмала имеют различные температуры клейстеризации: наиболее низкая у картофельного (55—60 °С) и наиболее высокая — у рисового (70—80 °С). Для предупреждения образования плохо распределяющихся в воде комков крахмал вначале смешивают с холодной водой, после чего растворяют в кипящей воде. Растворы крахмала называют: слизь крахмала (MucilagoAmyli), крахмальный отвар {DecoctumAmyli) или крахмальный клейстер. Крахмал используют в различных лекарственных формах: в порошках, присыпках, пилюлях, в виде 2 %-ных растворов — для внутреннего применения и клизм; 4—7 % -ные растворы на воде очищенной и глицерине — как основы для мазей; 10 %-ные растворы — в качестве стабилизатора для суспензий и эмульсий. Путем обработки крахмала ферментами (мальтозой), минеральными кислотами, окисляющими веществами при нагревании получают различные производные. Например, растворимые крахмалы получают после обработки раствором кислоты с последующей сушкой. Декстрин (Dextrinum) — продукт расщепления макромолекулы крахмала при быстром нагревании или в присутствии кислот на более мелкие молекулы — полисахариды крахмала того же состава, что и крахмал. Водные растворы декстрина обладают высокой вязкостью и большой склеивающей способностью. Благодаря этому с помощью декстрина можно получать хорошие пилюльные массы. Декстрин широко используется как эмульгатор в ряде стран (Германия, США и др.) в виде декстриновой слизи — MucilagoDextrini— для эмульгирования жидких лекарственных веществ, не смешивающихся с водой. Производные крахмала лучше растворимы в воде и более устойчивы. Их используют в качестве вспомогательных веществ при производстве таблеток, а растворы как основы для мазей. В результате жизнедеятельности специального вида бактерий образуется высокомолекулярный полисахарид — декстран, молекулярная масса которого находится в пределах от 15000 до 150000; 6 %-ный раствор декстрана с молекулярной массой 50000—60000, известный под названием полиглюкин (Polyglucinum), используют для внутривенного введения как кровезаменитель. Это прозрачная бесцветная жидкость без запаха с рН от 4,5 до 6,5. Растительные экстракты (густые и сухие) представляют собой концентрированные извлечения из лекарственного растительного сырья (ГФ XI, с. 160), содержащие в своем составе различные природные ВМС (камеди, слизи, белки, крахмал и др.). Густые экстракты (Extractaspissa) — вязкие массы с содержанием влаги не более 25 %; сухие экстракты (Extractasicca) — сыпучие массы с содержанием влаги не более 5 %. Для экстрагирования лекарственного растительного сырья применяют воду, спирт этиловый различной концентрации и другие экстраген-ты, иногда с добавлением кислот, щелочей, глицерина, хлороформа и др. Извлечения для густых и сухих экстрактов освобождают от балластных веществ осаждением спиртом, применением адсорбентов, кипячением и другими способами с последующим фильтрованием. Очищенные извлечения сгущают выпариванием под вакуумом до надлежащей консистенции (густые экстракты). Сухие экстракты получают высушиванием густых экстрактов или непосредственно из очищенной вытяжки с использованием методов, обеспечивающих максимальное сохранение действующих веществ: распыление, лиофилизация, сублимация и др. Пектин (Pectinum). Пектиновые вещества — это высокомолекулярные соединения, представляющие по структуре полигалактуроновую кислоту, частично этерифицированную метанолом. Они входят в состав клеточных стенок многих растений. Характерное свойство растворов пектина — высокая желатинирующая способность. Пектин представляет интерес для создания детских лекарственных форм. Микробные полисахариды относятся к классу природных полимеров, обладающих разнообразными свойствами, благодаря которым их применяют в качестве основ для мазей и линиментов, а также как пролонгаторы, стабилизаторы гетерогенных систем и т. п. В химико-фармацевтическом институте (г. Санкт-Петербург) разработана технология новых микробных полисахаридов, которые характеризуются апироген-ностью, малой токсичностью, что определяет возможность использования их в качестве вспомогательных веществ. Положительно и то, что запасы их практически неистощимы. Из группы этих веществ наибольшее распространение получил аубазидан -г- внеклеточный полисахарид, получаемый при микробиологическом синтезе с помощью дрожжевого гриба. Благодаря своему строению, разветвленной структуре, конфигурации и конформации моносахаридов в молекуле полимера (М. м. — 6—9 млн) он обладает хорошей растворимостью в воде, дает вязкие растворы, пластичные гели, может взаимодействовать с другими веществами, является эффективным стабилизатором и эмульгатором. Аубазидан в 0,6 % и более концентрации образует гели, которые используют как основы для мазей, 1 % — для пленок и губок, 0,1—0,3 % — как пролон-гатор глазных капель. Его растворы устойчивы при термической стерилизации до 120 °С. Альгинаты (Alginata). Альгиновая кислота представляет собой ВМС, которое получают из морских водорослей (ламинарий). Альгиновая кислота и ее натриевая соль практически безвредны. Они способны образовывать вяз-„ кие водные растворы и пасты; обладают гомогенизирующими, разрыхляющими, стабилизирующими свойствами. Это послужило основанием для широкого использования их в составе различных фармацевтических препаратов в качестве разрыхляющих, эмульгирующих, пролонгирующих, пленкообразующих вспомогательных веществ. Агароид (Agaroidum) представляет собой ВМС различной степени полимеризации с малой реакционной способностью, получаемое из водорослей. В состав полимера входят глюкоза и галактоза, а также минеральные элементы (кальций, магний, сера и др.). В 0,1 % концентрации обладает стабилизирующим, разрыхляющим и скользящим (важно для таблеток) действием; в 5 % — корригирующим эффектом; в 1,5 % — в смеси с глицерином используют в качестве мазевой основы. Коллаген (Collagenum) — основной белок соединительной ткани, состоит из макромолекул, имеющих трехспиральную структуру. Главный источник получения коллагена — кожа крупного рогатого скота, в которой его содержится до 95 %. Коллаген применяют в качестве раневого покрытия: пленки с фура-цилином, кислотой борной, маслом облепиховым, метилурацилом, а также глазные пленки с антибиотиками; губки гемостатические с различными лекарственными веществами. Он обеспечивает оптимальную активность лекарственных веществ, что связано с их глубоким проникновением и продолжительным контактом с тканями организма. Коллаген — хороший носитель глазных лекарственных форм (растворов, пленок). Белки также относятся к природным высокомолекулярным соединениям. В основе этих продуктов лежит полипептидная группировка, сложные молекулы которых построены из аминокислот. В зависимости от формы молекул белки разделяют на фибриллярные, имеющие линейную вытянутую форму, и глобулярные, имеющие свернутую шаровидную форму молекул—глобуль. Молекулярная масса белков колеблется в пределах от 27000 до 6800000. При растворении в воде молекулы белков диссоциируют на ионы. Эта диссоциация может происходить по кислотному или основному типу в зависимости от рН среды. В сильнокислой среде белок ведет себя как основание, его молекула диссоциирует за счет групп -NH2 по основному типу: HONH3—R—СООН-----► [NH3—R—СООН]+ + ОН" Кислотная диссоциация при этом подавлена. В щелочной среде, напротив, подавлена основная диссоциация, а идет преимущественно кислотная: HONH3—R—СООН------ [HONH3—R—COO]" + Н+ Однако, при определенном значении рН степень диссоциации амино- и карбоксильных групп приобретает одинаковые значения, тогда молекулы белков становятся электронейтральными. Значение рН, при котором молекула белка находится в электронейтральном состоянии, носит название изоэлектрической точки (ИЭТ). Для большинства белков ИЭТ лежит в области кислых растворов. В частности, для желатина — 4,7; козеина молока — 4,6; Y-глобулина крови — 6,4; пепсина — 2,0; химотрипсина — 6,0 ; альбумина яичного — 4,7; фармагеля А — 7,0; фармагеля В — 4,7. Необходимо учитывать ИЭТ, так как установлено, что от ее величины зависит устойчивость белков, а следовательно, и проявление их свойств. В некоторых случаях возможно даже выпадение белков в осадок. Это связано с тем, что в ИЭТ по всей длине белковой молекулы находится равное количество положительно и отрицательно заряженных ионогенных групп, что приводит к изменению конфигурации молекулы. Гибкая молекула сворачивается в клубок в силу притяжения разноименных ионов (рис. 111). Представителями группы природных ВМС являются также ферменты, в частности пепсин, трипсин, химотрипсин, гидролизин и др. Пепсин (Pepsinum) — протеолитический фермент желудочного сока (М. м. 35000). Высокогидрофильное вещество, хорошо растворимое в воде, свертывается при нагревании, осаждается крепким спиртом, солями тяжелых металлов, дубильными веществами. Концентрированные кислоты и щелочи разрушают пепсин. Фильтровальная бумага адсорбирует значительные количества пепсина, свет способствует инактивации фермента. Медицинский пепсин представляет собой стандартизованную смесь собственно пепсина, получаемого из слизистой оболочки свиных желудков, со свекловичным или молочным сахаром. Это белый или слегка желтоватый порошок, специфического запаха, сладкого вкуса. Доброкачественный пепсин легко растворяется в воде, образуя бесцветные опалесцирую-щие растворы слабокислой реакции. При хранении он может уплотняться или образовывать комки, рассыпающиеся при надавливании. Протеолитическую активность пепсин проявляет в кислой среде, поэтому его назначают, как правило, в растворах, подкисленных соляной кислотой (рН = 1,8—2,0). 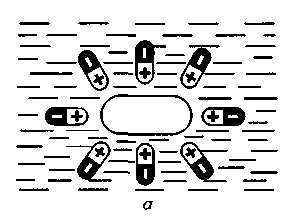 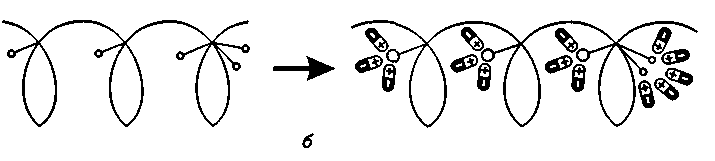 Рис. 111. Растворение в воде ВМС: а — со сферической; б — линейной формой молекул Кислота хлористо водородная не только активирует, но и стабилизирует пепсин, так как в неподкисленных растворах он быстро разрушается. Растворы пепсина следует хранить в прохладном защищенном от света месте. Применяют при расстройствах пищеварения: ахилии, гастритах, диспепсии и др. Трипсин (Trypsinum) — получают из поджелудочной железы крупного рогатого скота (М. м. 21000). Может быть в двух полимерных формах: кристаллической и аморфной. Это белый кристаллический порошок без запаха, легкорастворим в воде, изотоническом растворе натрия хлорида. Трипсин кристаллический применяют наружно в глазных каплях; в концентрации 0,2—0,3 % — при гнойных ранах, пролежнях, некрозах. Химотрипсин (Chymotrypsinum) — смесь химотрипсина и трипсина — рекомендуют только для местного применения в виде 0,1—0,5—1 %-ных растворов при гнойных ранах и ожогах. Гидролизин и аминопептид получают при гидролизе крови животных. Эти белковые вещества хорошо растворяются в воде, являются неограниченно набухающими ВМС, что объясняется строением их макромолекул, которые представляют собой свернутые, шаровидные глобули. Связи между молекулами невелики. Они легко сольватируются, образуя маловязкие растворы. Панкреатин (Pancreatinum) — высушенный экстракт поджелудочной железы свиней и крупного рогатого скота. Применяют в виде порошка или таблеток внутрь при расстройствах пищеварения, связанных с недостаточностью секреции поджелудочной железы, или нарушении функции почек. Желатин медицинский (Gelatinamedicinalis) — смесь белковых веществ, получаемая путем осторожного гидролиза коллагена и казеина, находящихся в составе кожи, сухожилий, костей. Представляет собой бесцветные или слегка желтоватые просвечивающие гибкие листочки или мелкие пластинки без запаха. Порошок желатина имеет белый или желтоватый цвет. Основные аминокислоты желатина — гликокол (25,5%), а также аланин (8,7%), аргинин (8,2 %), лейцин (7,1 %), лизин (5,9 %) и глютаминовая кислота. В молекулах желатина содержится много полярных групп (карбоксильных и аминогрупп), которые имеют большое сродство к воде. Желатин относится к числу фибриллярных, или волокнистых, белков, имеющих разветвленные макромолекулы в виде вытянутых нитей. Между сближенными сегментами фибрилл легко образуются «сшивающие» водородные мостики, превращающие макромолекулы в единую непрерывную сетку. Благодаря сшиванию макромолекул желатин при действии воды и при комнатной температуре (ниже 22 "С) ведет себя как нерастворимый ограниченно набухающий студень. Набухание сухого желатина сопровождается значительным поглощением воды, причем первоначальный объем вещества увеличивается до 14-кратного. При повышении температуры сшивающие связи в узлах молекулярной сетки желатинового студня разрываются, упругий желатиновый студень плавится и превращается в раствор. Теплый желатиновый раствор неограниченно смешивается с водой и глицерином. При понижении температуры растворы постепенно теряют текучесть и застудневают, если только их концентрация не оказывается слишком низкой (ниже 0,7—0,9 %). Плавление и застудневание желатинового студня можно повторять неограниченное число раз. Растворы желатина прописывают в больших концентрациях для остановки кровотечений (желудочных, кишечных, легочных и гемофилии). Желатин содержит соли кальция, чем, вероятно, обусловлена его способность повышать свертываемость крови; 10 %-ные растворы желатина используют для инъекционного введения. Растворы желатина в воде и глицерине применяют в качестве основы для мазей и суппозиториев. Он активный эмульгатор и стабилизатор, но из-за гелеобразующих свойств его редко применяют с этой целью в аптечной практике. Эмульсии получаются густыми, плотными. Они быстро подвергаются микробной контаминации. Желатин также используют для приготовления желатиновых капсул и основ для мягких лекарственных форм. Желатоза (Gelatosa) — это продукт неполного гидролиза желатина. Представляет собой слегка желтоватый гигроскопический порошок, не обладает способностью желатинироваться, но имеет высокие эмульгирующие свойства. Ограниченно растворима в воде. Отрицательная сторона — нестандартность вещества, поэтому в ряде случаев ее растворы могут обладать высокой вязкостью и упругостью. Используют для стабилизации гетерогенных систем (суспензий, эмульсий). Яичный желток (VitellumOvi) — содержит лецитин, от которого зависят его эмульгирующие свойства. Масса одного яичного желтка в среднем считается равной 18,0. Один желток может эмульгировать 15—20 г масла. Эмульсии с яичным желтком быстро портятся, поэтому в качестве эмульгатора его применяют редко, так же, как и сухое молоко. Сухое молоко (Lac. vaccinumexsicatum) — обладает высокой эмульгирующей способностью. На 10,0 г масла берут 10,0 г сухого молока. Для этих же целей Г. П. Пивненко и И. А. Маренич предложили применять сгущенное молоко, которое, являясь хорошим эмульгатором, одновременно может служить и корригирующим веществом, что очень важно в детской терапии. Применяют в качестве эмульгаторов также казеин и казеинат натрия. Они дают высокодисперсные эмульсии (в соотношении 1:1). Фосфатиды растительного и животного происхождения используют в качестве эмульгаторов не только в фармации, но и в пищевой промышленности. Синтетические и полусинтетические высокомолекулярные вещества. Целлюлоза (Cellulosa) относится к полисахаридам. Это клетчатка, представляющая собой главное вещество, из которого состоит древесина, растительные волокна. Молекулы целлюлозы, подобно крахмалу, построены из остатков глюкозы (а-формы), но отличаются от крахмала пространственным расположением этих звеньев. Макромолекулы целлюлозы линейные, в них много полярных гидро-ксильных групп, образующих между собой прочные межмолекулярные связи, которые сообщают молекуле жесткость. Целлюлоза не растворяется в холодной воде. Наличие в ее молекуле свободных гидроксилов дает возможность получать простые и сложные эфиры, частично или полностью растворимые в воде. Они представляют собой продукты замещения водородных атомов гидроксильных групп целлюлозы на спиртовые остатки — алкилы (при получении простых эфиров) или кислотные остатки — ацилы (при получении сложных эфиров). Эфиры целлюлозы используют в качестве стабилизаторов, пролонгаторов, основообразующих средств, а также для повышения качества многих лекарственных форм. Общая формула целлюлозы [С6Н702(ОН)3-х(OR)х]n где х — число замещенных ОН-групп в одном звене; п — число полимеризации. Метилцеллюлоза растворимая (Methylcellulosasolubile) С6Н702(ОН)х(ОСН3) (МЦ), называется еще тилоза, представляет собой простой эфир целлюлозы, получаемый путем взаимодействия щелочной целлюлозы и хлористого метила. В зависимости от количества введенных в молекулу целлюлозы метильных групп могут быть получены различные эфиры, растворимые в воде, щелочах или органических растворителях. Для фармацевтических целей применяют метилцеллюлозу, растворимую в воде, со степенью этерификации 1,6—2,0, содержащей 25—33 % метоксильных групп. Степень полимеризации п может быть от 150 до 900, что соответствует молекулярной массе от 30000 до 180000. По внешнему виду — это белый, иногда слегка желтоватый порошок, гранулированный или волокнистый продукт без запаха и вкуса. МЦ растворима в холодной воде, глицерине, нерастворима, но набухает в горячей воде. Растворы МЦ имеют нейтральную реакцию (рН = 7,0—7,8), устойчивы в широких пределах рН = 3,0—12,0; физиологически индифферентны, обладают хорошими поверхностно-активными свойствами. Концентрированные растворы псевдопластичны, почти не обладают тиксотропными свойствами. При высыхании образуют прозрачную пленку. Водные растворы МЦ обладают большой сорбционной, эмульгирующей и смачивающей способностью. Растворы МЦ в концентрации до 5 % используют как стабилизаторы гетерогенных систем, как загустители при производстве суспензий и эмульсий; в концентрации от 3 до 8 % иногда с добавлением глицерина (глицерогели) применяют как невысыхающую основу для мазей, паст, кремов; используют как пленкообразователь для покрытия таблеток. 1—2 %-ные растворы МЦ применяют в качестве пролонгаторов для приготовления глазных капель с атропина сульфатом, пилокарпина гидрохлоридом, скополамина гидробромидом и др. 0,25 % -ные растворы очищенной МЦ применяют как плазмозаменитель. Растворы МЦ совместимы с большой группой лекарственных средств (ртутными, цинковыми солями, салициловой, пировиноградной, фосфорной кислотами, натрия бензилпенициллином, местными анестетиками, рыбьим жиром и др.); несоместимы с резорцином, танином, 5 и 10 %-ными растворами йода, раствором аммиака, серебра нитратом, натрия тиосульфатом. Натри й-к арбоксиметилцеллюлоза (Methylcellulosa-natrium) (натрий-КМЦ) — представляет собой натриевую соль простого эфира целлюлозы и гликолевой кислоты [С6Н702(ОН)3JOCH2COONa)Jn M. м. 75000. Это белый или сероватый порошок без запаха и вкуса; в холодной и горячей воде набухает, а затем растворяется, образуя растворы различной вязкости в зависимости от молекулярной массы и концентрации. Применяют в качестве пролонгатора лекарственных веществ в глазных каплях и инъекционных растворах (0,5—1 %), эмульгатора (1 %), стабилизатора (2 %), формообразователя в мазях (4—6 %), а также как связывающее и разрыхляющее вещество в производстве таблеток. Гели натрий-КМЦ в отличие от метилцеллюлозы совместимы со многими консервантами. В меньшей мере изучены, но предлагаются для применения в области фармации смешанные эфиры целлюлозы. Это оксипропил-метилцеллюлоза (ОПМЦ), 1—2 % -ные растворы которой применяют для повышения устойчивости линиментов. Ацетилфталилцеллюлозу (АФЦ) используют для покрытия желатиновых капсул, драже, таблеток, растворимых в кишечнике. Поливинол (Polyvinolum) (поливиниловый спирт — ПВС) относится к синтетическим полимерам алифатического ряда, содержащим гидроксильные группы: 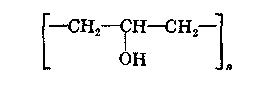 где п — число структурных единиц в макромолекуле полимера. По величине молекулярной массы ПВС делят на четыре группы: алигомеры (4000—10000), низкомолекулярные (10000—45000), среднемолекулярные (45000—150000) и высокомолекулярные (150000—500000). Получают поливинол при гидролизе поливинилацетата щелочью или кислотой в спиртовом растворе. ПВС представляет собой порошок белого или слегка желтоватого цвета, растворимый в воде при нагревании. Он обладает высокой реакционной способностью благодаря наличию гидроксильных групп. По своим химическим свойствам он сходен с низкомолекулярными вторичными спиртами (окисляется в кетоны, образует алкоголяты, подвергается реакциям этерификации). ПВС применяют как пролонгатор, стабилизатор, пленкообразователь; 10%-ный раствор ПВС в ГФ XI включен как пролонгирующий растворитель, а 2 % -ный — входит в состав кровезаменителя для увеличения вязкости; является компонентом мазевых основ. Поливинилпирролидон (Polyvinilpyrrolidonum) (ПВП) — это продукт полимеризации винилпирролидона: 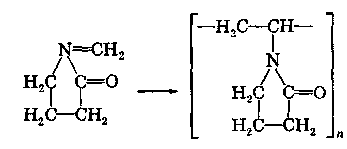 Представляет собой бесцветный и прозрачный гигроскопичный полимер с М.м. 1000000. Наиболее широкое применение находит ПВП с М.м. 12600— 35000. В зависимости от степени полимеризации имеет вид порошка или стекловидной массы светло-желтого цвета. ПВП растворим в воде, спиртах, глицерине, хлороформе, дихлорэтане, циклогексане, легко образует комплексы с лекарственными веществами (витаминами, антибиотиками). Это ограниченно набухающее вещество. ПВП широко применяют в фармацевтической технологии как стабилизатор эмульсий и суспензий, пролонгирующий компонент глазных лекарственных пленок, наполнитель для таблеток и драже. Гели на основе ПВП используют для приготовления мазей, в том числе предназначенных для слизистых оболочек; 3—3,5 %-ные растворы с ПВП с М.м. 30000—40000 применяют в качестве плазмозаменителей; 3,5 %-ный раствор ПВП носит название гемовинил, 2,5 %-ный — название перистон. ПВП способен адсорбировать токсины. Применяют при дизентерии. Полиакриламид (Polyacrilamidum). В последние годы получили очень широкое распространение полиакриламид (ПАА) и его производные: 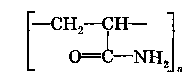 ПАА—полимер белого цвета, без запаха, растворим в воде, глицерине. Водные растворы являются типичными псевдопластическими жидкостями. Биорастворимый полимер широко используют в технологии глазных пленок и для пролонгирования глазных капель. Водные растворы ПАА совместимы со многими электролитами, поверхностно-активными веществами (ПАВ) и консервантами. Карбопол (Carbopolum) представляет собой сшитый сополимер акриловой кислоты и полифункциональных сшивающих агентов. Это мелкодисперсный белый порошок, который хорошо диспергируется в воде, образуя вязкие дисперсии с низким значением рН, что связано с большим количеством карбоксильных групп. В 0,1 % концентрации карбополы являются хорошими загустителями полярных сред (воды, спиртов). Карбополы применяют в технологии различных лекарственных форм: глазных капель, мазей, суппозиториев, эмульсий, суспензий, таблеток, микродраже. Полиэтиленоксиды (полиэтиленгликоли) (Polyaethylenoxyda) представляют собой полимеры этиленоксида Н(ОСН2—СН2)пОН. Полиэтиленоксиды (ПЭО) или полиэтиленгликоли (ПЭГ) получают путем полимеризации этилен-оксида в присутствии воды и калия гидроксида: 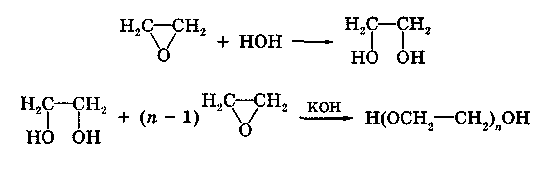 Консистенция и свойства ПЭО зависят от степени полимеризации. ПЭО-400 представляет собой вязкую прозрачную бесцветную жидкость, ПЭО-1500 — воски (температура плавления 35—41 °С), ПЭО-4000 — твердое вещество белого цвета с температурой плавления 53—61 °С. Характерная особенность ПЭО — их хорошая растворимость в воде и спирте. ПЭО мало чувствительны к изменению рН, стабильны при хранении, обладают крайне малой токсичностью, что обусловливает их широкое применение в технологии мазей, эмульсий, суспензий, суппозиториев, таблеток и других лекарственных форм. Основы для мазей чаще всего представляют композицию жидких и твердых ПЭО, имеющих вязкопластичную консистенцию (например, ПЭО-400 — 70 %, ПЭО-1500 — 30 %). М. X. Глузман и Г. С. Вашура предложили такой состав мазевой основы: ПЭО-400 — 47,5 % ; ПЭО-4000 — 47,5 % ; цетиловый спирт — 5 % . Полиэтилен (ПЭ) — продукт полимеризации этилена: Строение его можно выразить формулой (—СН2—СН2—)n M. м. 640—1250. По способу получения различают: ПЭ высокого, среднего и низкого давления. Полиэтилен высокого давления обладает наибольшей чистотой и используется в фармацевтической практике. Он обладает рядом положительных качеств: —■ химической нейтральностью и инертностью; — отсутствием вымывающихся токсических веществ; — стойкостью к воздействию широкого ассортимента лекарственных средств; — высокой эластичностью в сочетании с достаточной жесткостью и механической прочностью, что дает возможность использовать его в качестве упаковочного материала. Его можно перерабатывать в изделия самой различной формы, получать прозрачную пленку. Применяют для приготовления полиэтиленовых флаконов, капельниц для хранения глазных капель, а также лекарственных форм, содержащих пенициллин, хлорамфеникол, атропина сульфат, пилокарпина гидрохлорид, цинка сульфат, кислоту борную. Полиэтиленовые пленки используют для упаковки порошков: натрия салицилата, кислоты ацетилсалициловой, гексаметилентетрамина, дерматола, серебра нитрата, пепсина, калия йодида, калия бромида. Недостатки полиэтилена: — неустойчивость при температуре выше 100 °С; — поглощение веществ из окружающей среды, так как через ПЭ могут проникать жидкости, пары, газы. К группе полимеров относятся также силиконы (Siliconum), представляющие собой кремнийорганические соединения. По структуре они могут иметь различные расположения молекул: а) линейные 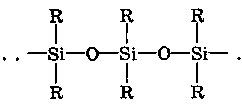 при линейном расположении молекул эти соединения представляют собой жидкости; б) сетчатые 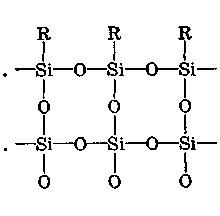 представляют собой воски, твердые вещества; в) циклические 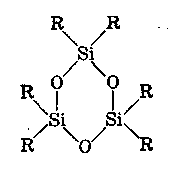 представляют собой твердые вещества. Среди кремнийорганических полимеров наибольший интерес с фармацевтической точки зрения представляют полиорганосилоксаны с линейными цепями молекул, выпускаемых в виде олигомеров (кремнийорганические жидкости). Основу силиконов составляют силоксановый скелет — цепь чередующихся атомов кремния и кислорода: 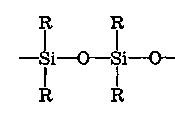 Свободные атомы кремния заполнены органическими радикалами (метиль-ным, этильным, фенильным). Наибольшее применение получили диэтилполи-органосилоксановые жидкости: 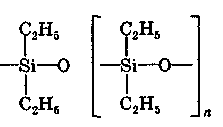 эсилон Полимер со степенью полимеризации 5 получил название Эсилон-4, а полимер со степенью конденсации 15 — Эсилон-5. Силиконы обладают целым рядом ценных свойств: высокой химической инертностью, не окисляются, не подвергаются действию агрессивных сред, обладают гидрофобными свойствами, термостойки, не смешиваются с водой, этанолом, маслами, в то же время совместимы с компонентами мазей и линиментов (вазелином, парафином, растительными маслами). В эсилонах хорошо растворяются неполярные и семиполярные вещества (ментол, камфора, фенол). Биологическая инертность силиконов свидетельствует об их перспективности для применения в качестве носителя в лекарственных препаратах при различных путях введения. Они используются для силиконизирования стеклянной тары с целью повышения химической и термической стойкости, для снижения гигроскопичности сухих экстрактов. Силиконовые жидкости используют для защиты кожи в качестве кремов, лосьонов и мазей. Широкое применение ВМС в технологии лекарств основано также на их поверхностно-активных свойствах. По определению академика П. А. Ребиндера, поверхностно-активными веществами называются вещества, положительно адсорбирующиеся на данной поверхности раздела двух фаз, то есть образующие на ней адсорбционный пограничный слой с повышенной концентрацией. По способности к ионизации в полярной среде ПАВ разделяют на ионогенные и неионогенные. Ионогенные ПАВ способны распадаться в водных растворах на ионы (например, мыла — соли жирных кислот, синтетические вещества, имеющие полярные группы и др.). Одним из больших классов ПАВ являются неионогенные (НПАВ), которые не образуют ионов, а их растворимость в воде определяется наличием полярных групп с сильным сродством к воде. К ним относятся оксиэтилированные кислоты, спирты, ПЭГ, блоксополимеры, жиросахара и др. Преимущества НПАВ — их устойчивость к воздействию кислот, щелочей, солей, совместимость с большинством лекарственных препаратов, низкая ионо-генная способность и высокая поверхностная активность, минимальная токсичность среди всех классов ПАВ, хорошая смешиваемость с органическими растворителями. Из этого класса применяются в настоящее время в технологии лекарственных препаратов твин-80, препарат ОС-20, эмульгаторы Т-1, Т-2 и др. С п е н ы — это эфиры сорбита с высшими жирными кислотами. В зависимости от входящих жирных кислот различают: спен-20 — эфир сорбита с лауриновой кислотой; спен-40 — эфир сорбита с пальмитиновой кислотой; спен-60 — эфир сорбита со стеариновой кислотой; спен-80 — эфир сорбита с олеиновой кислотой. Т в и н ы — это продукт этерификации спенов с этиленоксидами. В зависимости от применяемых кислот различают твины: 20, 40, 60, 80. Спены и твины синтезированы в ГНЦЛС М. X. Глузманом и Г. С. Башурой. Важное место среди НПАВ занимают водорастворимые полимерные ПАВ, которые вследствие хорошей адсорбирующей способности и слабой поверхностной активности являются хорошими стабилизаторами гетерогенных дисперсных систем: мазей, эмульсий, суспензий и т. п. Представителями полимерных ПАВ являются блоксополимеры (плю-роники — в Англии, полоксамеры — в США, проксанолы и гидроланы — в Украине) — это макромолекулы, состоящие из полиоксиэтиленовых (а) и поли-оксипропиленовых (ft) цепей, имеющие общие формулы: 1. R—О—(—СН2—СН2—О—)— — (—СН2—СН—(СН3)—О—)—— Н 2. R—О—(—СН2— СН—(СН3)—О—)— — (—СН2—СН2—О—)— — Н Полимеры первого типа имеют более низкие точки помутнения и образуют более высокую пену по сравнению со вторым типом; моющая способность их одинакова, но М. м. от 5000 до 20000 (представляют собой вязкие жидкости либо пастообразные или твердые вещества). Растворимость блоксополимеров в воде зависит от содержания в молекуле гидроксильных оксиэтиленовых цепей. Они мало гигроскопичны, растворимы в спиртах, хлорсодержащих растворителях, не растворимы в глицерине, минеральных кислотах; малотоксичны, не раздражают слизистые оболочки, биологически безвредны. Жиросахара (Adiposacchara) — это неполные сложные эфиры сахарозы с высшими жирными кислотами (стеариновая, пальмитиновая, лауриновая). Это сравнительно новый класс ПАВ твердой, вязкой и жидкой консистенции с весьма ценными свойствами. Они без запаха и вкуса, в организме распадаются на жирные кислоты, фруктозу и сахарозу. Жиросахара применяют в качестве солю-билизаторов, эмульгаторов (для парентеральных эмульсий), стабилизаторов. |
