Целая. Учебник для студентов высших учебных заведений, обучающихся по специальностям Летательные аппараты
 Скачать 32.33 Mb. Скачать 32.33 Mb.
|
|
Свойства жаропрочных сплавов
Обозначения: σв - прочность при растяжении; σ100 - то же при длительном нагружении в течение 100 часов; σ02/100- предел текучести при длительном нагружении в течение 100 часов; t - рабочая температура при длительных испытаниях. Для сравнения приведены свойства сплава ВТ5-1 с α-структурой. Двухфазные сплавы удовлетворительно обрабатываются резанием и свариваются. После сварки они требуют отжига для повышения пластичности сварного шва. (α+β)-сплавы куются, штампуются и прокатываются легче, чем сплавы с α- или β-структурой. Они поставляются в виде поковок, штамповок, прутков, листов, лент. Однофазные β- сплавы не имеют промышленного применения, так как для получения устойчивой β-структуры они требуют легирования большим количеством изоморфных β-стабилизаторов (V, Мо, Ni, Та) - дорогих, дефицитных и обладающих высокой плотностью. Стоимость таких сплавов высока, и они имеют пониженную удельную прочность. В настоящее время применяются так называемые псевдо-β-сплавы (ВТ15). В равновесном состоянии у сплава ВТ15 преобладает β- структура с небольшим количеством α-фазы. Он имеет небольшую плотность - 4800 кг/м3 и оттого – высокую удельную прочность. Недостатки сплава - пониженная пластичность сварных швов и низкая термическая стабильность. Поставляется в виде листов, полос, прутков, поковок; рекомендован к длительной работе при температуре до 350 °С. 9.3.3.2. ЛИТЕЙНЫЕ СПЛАВЫ У титановых сплавов хорошие литейные качества. Недостатком литейных титановых сплавов является большая склонность к поглощению газов и высокая активность при взаимодействии со всеми формовочными материалами. Поэтому их плавка и разливка ведутся в вакууме или в среде инертных газов. Для фасонного литья применяют сплавы, аналогичные по химическому составу некоторым деформируемым - ВТ15Л, ВТЗ-1Л, ВТ14Л, а также специальные литейные сплавы - ВТЛ1, ВТ21Л. У литейных сплавов, по сравнению с соответствующими деформируемыми, механические свойства худшие. Самый дешевый и распространенный сплав - ВТ15Л - обладает хорошими литейными свойствами, он достаточно вязок и пластичен, но прочность его невысока. К наиболее прочным из промышленных сплавов относятся ВТЗ-1Л, ВТ21Л. Литейные сплавы применяются для изготовления трубных заготовок и различных фасонных отливок. Рассмотренные примеры, безусловно, не исчерпывают всех возможностей применения титановых сплавов в ракетостроении. Однако и приведенные данные показывают широкие перспективы замены титановыми сплавами более тяжелых сталей и менее жаропрочных алюминиевых сплавов, предназначенных для ряда деталей ракетных конструкций [59 - 66]. 9.4. НИОБИИ И ЕГО СПЛАВЫ 9.4.1. КРАТКИЕ ИСТОРИЧЕСКИЕ СВЕДЕНИЯ Элемент, занимающий в таблице Менделеева 41-ю клетку, человечеству известен давно. Возраст его нынешнего названия - ниобий - почти на пол столетия меньше. Получилось так, что элемент № 41 был открыт дважды. Первый раз - в 1801 г., когда английский ученый Чарльз Гатчет исследовал образец черного минерала, присланного в Британский музей из Америки. Из этого минерала он выделил оксид неизвестного прежде элемента. Новый элемент Гатчет назвал колумбием, делая акцент тем самым на его заокеанском происхождении. А черный минерал получил название «колумбит». Год спустя шведский химик Экерберг выделил из колумбита оксид еще одного нового элемента, назвав его танталом. Сходство соединений Колумбия и тантала было так велико, что в течение 40 лет большинство химиков считали: тантал и колумбий - один и тот же элемент. В 1844 г. немецкий химик Генрих Розе, исследуя образцы колумбита, найденные в Баварии, вновь обнаружил оксиды двух металлов, одним из которых оказался уже известный тантал. Оксиды были похожи, и, подчеркивая их сходство, Розе назвал элемент, образующий второй оксид, ниобием - по имени Ниобы, дочери мифологического мученика Тантала, - хотя и не смог получить его в свободном состоянии. Металлический ниобий был впервые получен лишь в 1866 г. шведским ученым Блюметрандом при восстановлении хлорида ниобия водородом. В конце XIX в. были найдены еще два способа получения этого элемента. Именовать же элемент №41 продолжали по-разному: в Англии и США - колумбием, в других странах - ниобием. Конец разногласиям положил Международный Союз теоретической и прикладной химии в 1950 г. Было решено повсеместно узаконить название элемента - ниобий, а за основным минералом ниобия так и закрепилось наименование «колумбит». В бывшем СССР, в Гиредмете, ученые Н. П. Сажин, О. П. Калгин, Н. П. Пенкин и др. с 1934 г. занимались разработкой научных основ, технологии и аппаратуры карботермического способа получения ниобия, - затем он стал основным промышленным способом. Получать пластичный ниобий из натриетермического порошка в промышленном масштабе в СССР ученые О. П. Калгин, Н. П. Чувелева и др. начали в 1952 г. В земной коре находится 3,2-10“3 % (по весу) ниобия. В природе обычно встречаются смеси изоморфных соединений ниобия и тантала. Кроме того, в эти соединения входят железо, марганец, щелочные и щелочноземельные металлы, а также титан, цирконий, торий, уран, олово, сурьма, висмут, вольфрам и другие. В настоящее время найдено много минералов (около 100), содержащих ниобий, однако лишь немногие из них имеют промышленное значение ввиду трудности отделения ниобия от других находящихся с ним элементов. 9.4.2. СЫРЬЕВЫЕ ИСТОЧНИКИ Все минералы, содержащие ниобий, подразделяют на две основные группы: 1. Танталы - ниобаты, представляющие собой соли ниобиевой и танталовой кислот. Основные минералы этой группы: танталит и колумбит. Состав минералов может быть выражен общей формулой (Fе, Мn) [Та, NbO3]2. Примерный химический состав колумбита (%): 68 Nb2O5; 10 Та2O5; 6 FеО; 15 МnО; 0,5 ТiО; 0,5 ТiO2. Соотношение между этими элементами изменяется в широких пределах. В случае преобладания ниобия минерал называется колумбитом, при преобладании тантала - танталитом. Сумма окислов (Nb2О5+Та2O5) составляет 75...85 %. 2. Титано (тантало)-ниобаты - сложные соли титановой, ниобиевой (танталовой) кислот. Среди минералов этой группы наиболее важны: лопарит и пирохлор. Попарит представляет собой титано- ниобат натрия, кальция и редкоземельных элементов. Общая формула минерала - (Nа, Са...Се)2 (Nb, Ti)2O6. Встречаются минералы ниобия главным образом в гранитных пегматитах (танталит и колумбит) и в щелочных нефелин-селенитовых пегматитах (лопарит, пирохлор и др.). Кроме рудных месторождений известны и россыпные, где концентрируются танталит и колумбит. Для производства ниобия используются руды с различным содержанием этого элемента. Использование тех или иных руд часто зависит от содержания в них других элементов, которые извлекаются наряду с ниобием. В связи с этим промышленное значение имеют руды, содержащие в пересчете с Nb2O5 даже сотые доли процента ниобия. Вследствие низкого содержания ниобия в рудах их обогащают, после чего содержание Nb2O5 повышается до 40...50 %. Месторождения ниобиевых минералов находятся во многих местах земного шара. Месторождения танталитов и колумбитов сосредоточены главным образом в бывшем СССР, Норвегии, Франции, США, Аргентине, Канаде, Африке, Австралии, Гренландии и др., месторождения пирохлора – в Швеции, Африке. 9. 4. 3. ФИЗИЧЕСКИЕ СВОЙСТВА НИОБИЯ
Температурный коэффициент линейного расширения:
Теплопроводность в зависимости от температуры:
Удельная теплоемкость в зависимости от температуры:
Удельное электрическое сопротивление в зависимости от температуры:
9.4.4. ХИМИЧЕСКИЕ СВОЙСТВА НИОБИЯ Окисление компактного ниобия в среде воздуха наблюдается начиная с температур 200...215 °С, о чем свидетельствует появление цветов побежалости. При температуре выше 550°С окисление происходит с возрастающей скоростью с образованием оксида Nb2O5. 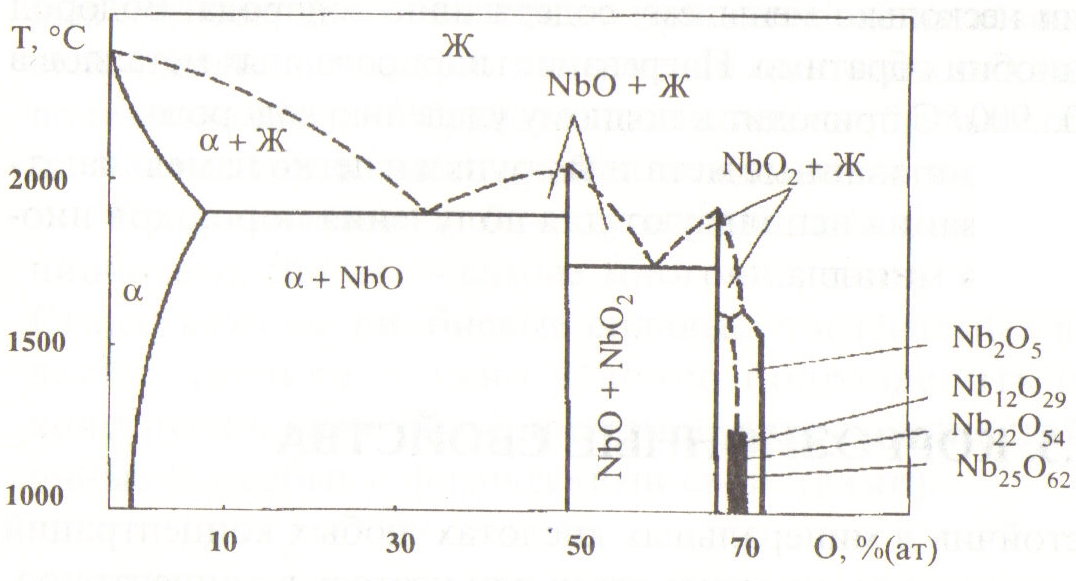 Рис. 87. Диаграмма состояния системы ниобий-кислород 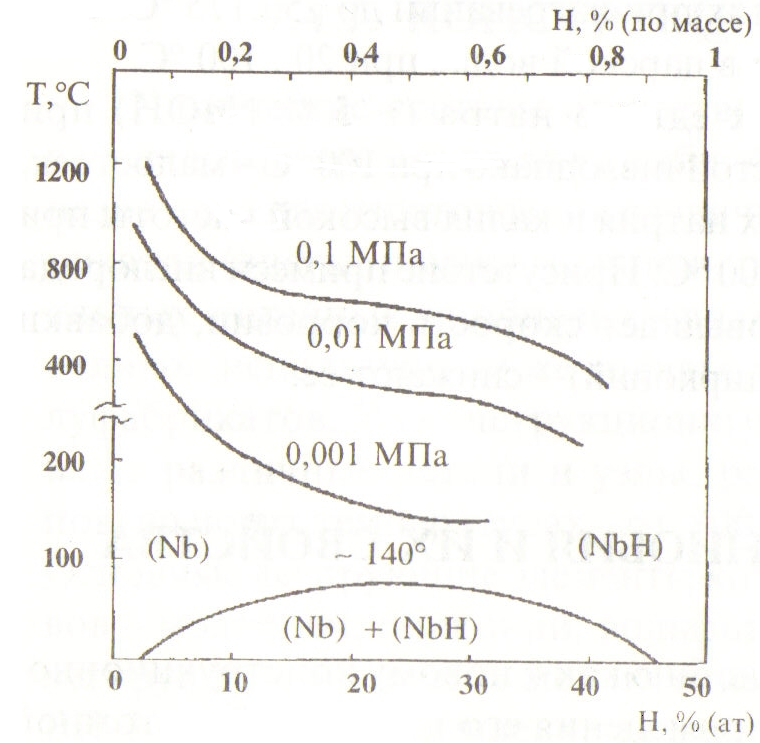 Рис. 88. Растворимость водорода в ниобии В системе ниобий - кислород установлено существование трех стабильных оксидов: Nb0, NbO2 и Nb2O5. Максимальная растворимость кислорода в ниобии при температуре эвтектики (1915 °С) находится в пределах 4...9 % атомарных 0,72... 1,67 % (по массе). Для защиты ниобия и его жаропрочных сплавов от окисления используют различные способы, выбор которых зависит от условий эксплуатации деталей и их конфигураций. Компактный ниобий активно растворяет водород при температурах выше 300 °С. Растворимость водорода понижается с возрастанием температуры и уменьшением давления водорода (рис. 88). Насыщению водородом соответствуют соединения, близкие по составу моногидриду NbН, однако отклоняющиеся от стехиометрического состава и отвечающие составу NbН0,94 или несколько меньшему содержанию водорода. Водород растворяется в ниобии обратимо. Нагревание гидрированных металлов в вакууме при 800...900 °С приводит к полному удалению водорода. Поскольку гидрированные металлы хрупки и легко измельчаются, способ гидрирования используют для получения порошков ниобия из компактного металла. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
