Целая. Учебник для студентов высших учебных заведений, обучающихся по специальностям Летательные аппараты
 Скачать 32.33 Mb. Скачать 32.33 Mb.
|
9.6.6. ОБЛАСТИ ПРИМЕНЕНИЯ ТАНТАЛА И ЕГО СПЛАВОВ Основное количество производимого тантала (55.. .65 %) используют в производстве электролитических конденсаторов и в вакуумной технике. Остальное расходуют в производстве твердых (карбид тантала) и жаропрочных сплавов, химическом машиностроении, атомной технике. Способность тантала поглощать газы обеспечивает поддержание глубокого вакуума в радиолампах и других электровакуумных приборах. Из тантала изготавливают «горячую аппаратуру» (т. е. нагреваемые детали), аноды, сетки, катоды косвенного накала и другие детали электронных ламп, особенно мощных генераторных ламп. Тантал входит в состав различных жаропрочных сплавов для газовых турбин и реактивных двигателей. Используют тантал в виде проволоки и листов в медицине - в костной и пластической хирургии (скрепление костей, «заплаты» при повреждениях черепа, наложение швов и др.) [60]. 9.7. ВАНАДИЙ И ЕГО СПЛАВЫ 9.7.1. ИСТОРИЯ ОТКРЫТИЯ ВАНАДИЯ В начале XIX века в Швеции были найдены новые богатые месторождения железной руды. Одна за другой сооружались доменные печи Но,что примечательно: при одинаковых условиях некоторые из них давали железо удивительной ковкости, в то время как другие - более хрупкий металл. После многих попыток наладить процесс выплавки высококачественного металла в «плохих» домнах металлурги обратились за помощью к химикам, а в 1830 г. Нильсу Сефстрему удалось выделить из шлака «лучших» домен неизвестный черный порошок. Сефстрем сделал вывод, что изумительную ковкость металлу придает присутствие в руде какого-то неизвестного элемента, содержащегося в черном порошке. Этот новый элемент ученый назвал ванадием в честь легендарной Ванадис - богини красоты древних скандинавов. Открытие нового элемента всегда было большой честью для ученого. Поэтому можно представить себе огорчение мексиканского минералога Нидреса Маирля дель Рио, который еще в 1801 г. обнаружил в свинцовой руде никогда не встречавшийся прежде элемент и назвал его эриторнием. Но, усомнившись в собственных выводах, дель Рио отказался от своего открытия, решив, что встретился с недавно открытым хромом. Еще большее разочарование постигло блестящего немецкого химика Фридриха Велера. Одновременно с Сефстремом он изучал железные руды, привезенные из Мексики А. Гумбольдтом, - те самые, что исследовал дель Рио. Велер также нашел в них нечто необычное, но его исследования прервала болезнь; когда он возобновил работу, было уже поздно, - Сефстрем обнародовал свое открытие. Свойства нового элемента совпадали с теми, что были занесены в один из лабораторных журналов Велера. И только в 1869 г., спустя 39 лет после открытия Сефстрема, элемент № 23 впервые был выделен в относительно чистом виде. Английский химик Г. Роско, действуя водородом на хлористый ванадий, получил элементарный ванадий чистотой около 96 %. В дальнейшем многие исследователи безуспешно пытались получить более чистый ванадий. Ванадий, в силу трудности его очистки от кислорода, азота, углерода и водорода, получается только в виде хрупких образцов. Лишь в 1927 г. Мордену удалось получить первые образцы ковкого ванадия восстановлением V2O5 кальцием. 9.7.2. ОПРЕДЕЛЕНИЕ ВАНАДИЯ Ванадий широко распространен в природе, содержание его - около 0,02 % от веса земной коры, то есть примерно столько же, сколько цинка и никеля. Однако, будучи более распространенным, он присутствует в виде следов во многих рудах. Собственные руды ванадия очень редки. Небольшое количество его найдено в железных, свинцовых, свин- цово-цинковых, свинцово-медных и алюминиевых рудах. Практически весь ванадий земной коры находится в ее твердой оболочке - литосфере - в изверженных породах, где он, вследствие близости ионных радиусов V3+ и Fe3+, изоморфно замещает катион железа. Получение чистого ванадия сопряжено с большими трудностями ввиду повышенной реакционной способности металла, имеющей место при высокой температуре по отношению к кислороду, азоту и некоторым другим элементам. Большинство методов получения металлического ванадия сводится к восстановлению его окислов или галогени- дов (главным образом хлоридов) различными восстановителями. У атомов ванадия характерное для переходных элементов строение: их валентные электроны расположены в двух внешних слоях, в периферийном слое два электрона. Из оболочки 3d3 в определенных условиях ванадий отдает еще до трех электронов. Валентность ванадия в соединениях - II, III, IV и VI. Валентность его в обычных условиях наиболее стабильна. Электронная формула ванадия: ls22s22p63s23p63d34s2. Ванадий - тугоплавкий металл серого цвета, твердый, но хорошо поддающийся механической обработке. Образует кубическую объемно-центрированную кристаллическую решетку. 9.7.3. СВОЙСТВА ВАНАДИЯ В компактном состоянии ванадий весьма устойчив к действию различных реагентов. Растворяется в плавиковой кислоте HF и тех кислотах, которые являются сильными окислителями: в HN03, царской водке. Растворы щелочей на него не действуют, однако расплавленные щелочи постепенно растворяют его. В виде порошка при нагревании он энергично реагирует с кислородом, хромом и серой. Способен поглощать большое количество водорода. При температуре до 300 °С он может поглотить 157 см3/г водорода с образованием гидрида, который разлагается при 900 °С в вакууме. Азот также поглощается ванадием: нитрид ванадия разлагается при температуре выше 2 000 °С. В табл. 49 приведены некоторые физические свойства ванадия. Ванадий химически относительно активен. Чистый металл, не содержащий нитридов и карбидов, он пластичен. Его можно легко протягивать в проволоку и прокатывать в листы и тонкую фольгу при обычной температуре. Металл, содержащий нитриды и карбиды. тверд и хрупок. Компактный металл при обычной температуре даже во влажном воздухе остается блестящим. При нагревании на воздухе и в кислороде сначала темнеет, изменяя цвет, покрывается окислом различной степени окисления и, наконец, сгорает в V2O5. Таблица 49 Некоторые физические свойства природных изотопов ванадия
Что касается механических свойств ванадия, то они очень зависимы от наличия примесей внедрения. В целях производства ванадия в лабораторных или промышленных количествах применяются следующие методы: 1. Прямое восстановление V2О5 кальцием (основной метод производства в промышленном масштабе). 2. Восстановление VCl3 магнием. 3. Алюмотермическое восстановление V2O5. Четвертым методом - разложением VJ2 на горячей проволоке (процесс Ван Арксия) - получают в небольших количествах ванадий высокой чистоты. В связи с тем что давление пара VJ2 низкое, этот процесс сейчас можно использовать только в лабораторных масштабах. Первым и вторым способами получают более чистый ванадий. Из-за взаимодействия алюминия и кислорода третий способ менее перспективен для получения ванадия высокой чистоты. Однако низкая цена продукта обусловливает перспективность этого способа для производства сплавов, в которых легирующие добавки снижают вредное влияние избытка кислорода. Табл. 50 демонстрирует типичный состав двух сортов металлического ванадия. Таблица 50 Химический состав металлического ванадия
Чистый ванадий очень пластичен: хрупкость, приписываемая ему ранее, была обусловлена наличием примесей внедрения, которые существенно влияют на его механические свойства. Наиболее пластичен йодидный ванадий, содержащий небольшое количество примесей. Восстановленный кальцием ванадий менее чист и поэтому менее пластичен. В табл. 51 приведены механические свойства йодидного и кальциетермического ванадия при комнатной температуре. Таблица 51 Механические свойства ванадия
Обозначения: σв - прочность при растяжении; σ0,2 – предел текучести; ε - относительное удлинение; HRV – твердость по Роквеллу; d – диаметр. 9.7.4. СПЛАВЫ ВАНАДИЯ Разработка и применение сплавов на основе ванадия начались только с середины 60-х годов нашего века. Они отличаются относительно высокой жаропрочностью при температуре 500...600 °С, низкой плотностью, коррозионной стойкостью в жидких щелочных металлах, низким сечением захвата быстрых нейтронов, хорошей обрабатываемостью. Сплавы ванадия подразделяют на конструкционные жаропрочные и сплавы со специальными физическими и химическими свойствами. К особым относятся сверхпроводящие сплавы. Конструкционные жаропрочные сплавы ванадия, в свою очередь, подразделяют на малолегированные технологические сплавы на основе системы ванадий - титан с различными легирующими элементами и высоколегированные и более прочные на основе системы ванадий - ниобий и ванадий - ниобий - тантал. Ванадий является хорошим растворителем многих химических элементов, поскольку радиус его атома отличается от радиуса этих элементов незначительно. На температуру плавления и прочностные свойства сплавов ванадия при высоких температурах влияют добавки молибдена, рения, ниобия, тантала, хрома, алюминия, вольфрама и титана, - они повышают или несколько снижают температуру начала плавления (рис. 89). Обладая меньшей твердостью и прочностью при комнатной и повышенных температурах, сплавы ванадия по удельной прочности превосходят коррозионностойкую сталь, некоторые титановые сплавы, сплавы никеля, кобальта, молибдена и ниобия. 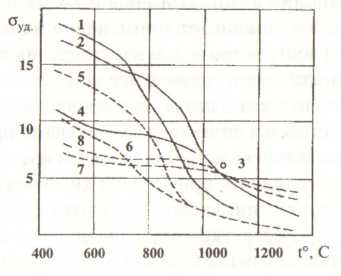 Рис. 89. Зависимость удельной прочности сплавов ванадия и лучших сплавов на основе никеля, кобальта, молибдена и ниобия от температуры: Рис. 89. Зависимость удельной прочности сплавов ванадия и лучших сплавов на основе никеля, кобальта, молибдена и ниобия от температуры:1) V - 5 % Ті - 20 % Nb - 1 % Si; 2) V - 50 % Nb; 3) V - 60 % Nb; 4) V - 5 % Ті - 20 % Nb; 5) сплав никеля; 6) сплав кобальта; 7) сплав молибдена; 8) сплав ниобия Высокой прочностью и твердостью до высоких температур обладают сплавы с хромом (HV = 200 при 1 000 °С). Однако их практическое применение ограничено вследствие низкой технологичности. Сплавы ванадия с ниобием, содержащие кроме титана и кремния другие легирующие элементы (тантал, цирконий, гафний и др.), наряду с жаропрочностью характеризуются высокой ударной вязкостью, особенно при низких температурах, хорошо деформируются и свариваются контактной и дуговой сваркой. При температуре 200...1 250 °С по удельной жаропрочности эти сплавы превосходят жаропрочные сплавы ниобия и молибдена. Сплавы ванадия получают преимущественно вакуумной индукционной и аргонно-дуговой плавкой, реже - электроннолучевым переплавом. Первичную обработку слитков проводят горячим прессованием или ковкой в оболочках при температуре 900...1 450 °С. Последующая обработка заключается в теплой или холодной прокатке на лист или пруток (профиль). 9.7.5. ПРИМЕНЕНИЕ ВАНАДИЯ И ЕГО СПЛАВОВ Сплавы со специальными физическими и химическими свойствами разрабатывают прежде всего применительно к ядерной технике и химическому машиностроению. Сплавы ванадия используют для плакирования ядерных реакторов, охлаждаемых жидким калием или натрием; при этом сплавы практически не взаимодействуют до температуры 800...900 °С с ядерным горючим и охлаждающими смесями, обеспечивая защиту от продуктов расщепления. Высокая коррозионная стойкость сплавов ванадия в морской воде и во многих химических агрессивных средах обусловливает применение их как конструкционных материалов в судостроении и для изготовления химической аппаратуры. Фольгу ванадия и его сплавов используют в качестве прослойки между сталью и титаном в целях плакирования стали или тугоплавких металлов титановым и циркониевым сплавами при диффузионной сварке. Облицовка такими комбинированными материалами удешевляет и расширяет возможность применения химической аппаратуры. Сплавы ванадия с рением применяют для изготовления неокисляющихся электроконтактов. Возрастает значение сплавов ванадия как сверхпроводящих материалов, используемых для получения магнитных полей с высокой напряженностью. Высокая удельная прочность в сочетании с хорошей коррозионной стойкостью обусловливают применение ванадиевых сплавов в самолето- и ракетостроении. Их используют для изготовления камер сгорания двигателей коррекции космических аппаратов. Если в химической и других отраслях промышленности нашли применение сплавы ванадия, то в металлургии необходим сам металл. Ванадий - один из главных легирующих элементов. Ничтожные добавки его повышают упругость и прочность стали примерно на 50 %. Многие современные марки пружинных сталей содержат до 0,25 % ванадия. В настоящее время даже металлургам, которые в познании ванадия опередили ученых других специальностей, предстоит узнать о ванадии еще многое. А химикам, особенно тем, которые изучают механизм каталитического действия различных веществ, еще больше [50]. 9.8. ЦИРКОНИЙ Цирконий - элемент IV группы периодической системы - был открыт в 1789 г. немецким академиком Клапротом в наиболее распространенном минерале циркония - цирконе. Этот минерал был известен в глубокой древности и использовался как драгоценный камень, имея различные названия: гиацинт, яцинт, яргон. В 1824 г. шведский химик Берцеллиус впервые получил металлический цирконий в форме сильно загрязненного примесями порошка восстановлением натрием фтороцирконата калия: К2 (ZrF6) + 4Na → Zr + 2KF + 4NaF Промышленное производство циркония началось в начале 50-х годов нашего столетия в связи с потребностью в чистом цирконии атомной энергетики. Соединения циркония и металлический цирконий, полученные из рудного сырья, всегда содержат примесь химического аналога циркония - гафния, открытого в 1923 г. Содержание гафния в цирконии зависит от природы исходного сырья и колеблется в пределах от десятых долей до нескольких процентов. 9.8.1. СВОЙСТВА ЦИРКОНИЯ Компактный цирконий внешне напоминает сталь, порошкообразный цирконий – темно-серого цвета. Металл имеет две кристаллические модификации: гексагональную α-форму с периодами решетки а = 3,223 Å, с = 5,123 Å, устойчивую до 1 135 К, кубическую гранецентрированную β-форму с периодом а = 3,61 Å, устойчивую выше 1 135 К. Чистый цирконий пластичен, легко поддается ковке, прокатке в листы, протяжке. Примеси кислорода, азота, углерода и водорода сильно влияют на механические свойства, поэтому они зависят от способа получения металла. Цирконий стоек на воздухе, при нагревании компактных металлов до 573...873 К он покрывается пленкой оксида, а выше 1 073 К - быстро окисляется с образованием высшего оксида Zr02 . Порошкообразный цирконий при 453...558 К окисляется на воздухе с воспламенением. Цирконий активно поглощает водород уже при температуре 573...675 К с образованием твердого раствора водорода в металле и гидрида ZrH2. Выше 1 175 К цирконий быстро поглощает азот и активно взаимодействует с окисью углерода. С азотом и углеродом цирконий образует весьма твердые и тугоплавкие соединения - нитриды и карбиды.
Некоторые физические свойства циркония приведены в табл. 52. Таблица 52. Физические свойства циркония
9.8.2. ОБЛАСТИ ПРИМЕНЕНИЯ ЦИРКОНИЯ И ЕГО ОКСИДА Цирконий, его сплавы и химические соединения применяют в различных областях техники. Основными являются: атомная энергетика, электроника, пиротехника и производство боеприпасов, машиностроение, производство сталей и сплавов с цветными металлами, производство огнеупоров (оксид), керамики, эмалей и стекла, литейное производство. В первых четырех областях применяется металлический цирконий или сплавы на его основе. 9.8.2.1. АТОМНАЯ ЭНЕРГЕТИКА В 1950 г. в связи с развитием атомной энергетики цирконий привлек к себе внимание как конструкционный материал для энергетических ядерных реакторов, поскольку у него малое сечение захвата тепловых нейтронов. Величина сечения захвата нейтронов измеряется в барнах. Чем больше эта величина, тем больше нейтронов поглощает материал и тем сильнее препятствует развитию цепной реакции. Естественно, что для реакционной зоны реакторов выбираются материалы с минимальными сечениями захвата. У чистого металлического циркония эта величина равна 0,18 барна. Многие более дешевые металлы имеют сечение захвата того же порядка: у олова, например, оно равно 0,65 барна, у алюминия - 0,22 барна, а у магния - всего 06 барна. Но эти металлы легкоплавки и нежаропрочны. Для использования циркония в атомной технике потребовалось решить сложную задачу очистки последнего от его химического аналога - гафния, сечение захвата нейтронов которого составляет 115 барн. Из циркония и его сплавов изготавливают защитные оболочки для урановых тепловыделяющих элементов: каналы, в которых циркулирует теплоотводящая жидкость, и другие детали конструкций ядерных реакторов. Единственным ограничением широкого применения циркония является его довольно высокая цена, что связано со сложностью отделения его от гафния. Проблема экономного разделения циркония и гафния еще не до конца решена практически. И все-таки цирконий стал «атомным» металлом. Производство его увеличивается из года в год. За десятилетие, с 1949 по 1959 г., мировое производство циркония возросло в 100 раз. По американским данным, в 1975 г. оно составляло около 3 000 т, а в 1985 г. только атомной энергетикой потреблено 5 000 т циркония, 2 000 т использовано военными ведомствами и 1 000 т израсходовано в химическом машиностроении в целях придания различным металлам и сплавам повышенной коррозионной стойкости. 9.8.2.2. ПИРОТЕХНИКА И ПРОИЗВОДСТВО БОЕПРИПАСОВ В этой области используют порошкообразный цирконий, имеющий низкую температуру воспламенения и высокую скорость сгорания. Порошки циркония применяют в качестве воспламенителей капсулей-детонаторов, а также в смесях для фотовспышек. В смесях с окислителями, такими как нитрат бария и бертолетова соль, порошки циркония образуют бездымный порох. 9.8.2.3. МАШИНОСТРОЕНИЕ С увеличением масштабов производства и снижением стоимости циркония, его стали шире применять в химическом машиностроении как кислотостойкий материал для изготовления центрифуг, насосов, конденсаторов, испарителей; в общем машиностроении - поршней, шатунов, тяг и др; в турбостроении - лопастей турбин и других деталей; в ракетном двигателестроении и авиации. 9.8.3. ПРОИЗВОДСТВО СТАЛЕЙ И СПЛАВОВ С ЦВЕТНЫМИ МЕТАЛЛАМИ Присадки циркония широко используют в производстве сталей в целях раскисления, очистки стали от азота, а также для связывания серы. Кроме того, цирконий - ценный легирующий элемент, его вводят в некоторые сорта броневых и орудийных сталей, нержавеющих и жаропрочных сталей. Он входит в состав ряда сплавов на основе цветных металлов (меди, магния, свинца, никеля). В последние годы разработаны сверхпроводящие сплавы, сод ер- жащие цирконий. Они используются для электромагнитов с высокой напряженностью магнитного поля и силой тока. Один из таких сплавов (75 % Nb и 25 % Zr) при 4,2 К выдерживает нагрузку до 100 000 А/см2. 9.8.4. ПРОИЗВОДСТВО ОГНЕУПОРОВ, ФАРФОРА, ЭМАЛЕЙ, ГЛАЗУРИ И СТЕКЛА В этой области, поглощающей в настоящее время более половины общего потребления циркония, используются минералы (циркон и бодделент) и химические соединения циркония (двуокись циркония, цирконаты, диборид циркония). Значительную долю цирконового концентрата потребляет литейное производство для изготовления литейных форм и стержней, а также присыпки литейных форм в целях получения хорошей поверхности отливки. 9.8.5. ПРОЧИЕ ОБЛАСТИ ПРИМЕНЕНИЯ В числе других областей применения циркония следует упомянуть использование сульфатов циркония, двойного сульфата циркония с сульфатом аммония и др. в качестве дубителя в кожевенной промышленности; применение хлорида и оксихлорида циркония для приготовления катализаторов, используемых в синтезе органических соединений. Двуокись циркония, пожалуй, единственный материал, который с повышением температуры не теряет электроизоляционных свойств и поэтому применяется в индукционных печах. 9.8.6. МИНЕРАЛЫ, РУДЫ И РУДНЫЕ КОНЦЕНТРАТЫ Содержание циркония в земной коре - 0,025 % по массе. По распространенности в земной коре он превосходит содержание таких металлов, как медь, цинк, олово, никель и свинец. Несмотря на это, он пользуется меньшей популярностью, чем многие из действительно редких металлов - ввиду крайней рассеянности в земной коре и отсутствия крупных залежей его природных соединений. Известно около 20 минералов циркония. Они концентрируются главным образом в гранитных и щелочных пегматитах. Минералы циркония могут быть разделены на три группы: 1. Двуокись циркония (минерал бадделент и его разновидности). 2. Ортосиликаты циркония (циркон и его разновидности). 3. Цирконосиликаты натрия, кальция, железа и других элементов. Основные промышленные источники циркония в настоящее время –минералы бадделент и циркон. 9.8.7. СПОСОБЫ ПОЛУЧЕНИЯ ЦИРКОНИЯ Способы получения циркония можно подразделить на две группы: 1.МЕТАЛЛОТЕРМИЧЕСКОЕ ВОССТАНОВЛЕНИЕ: а) восстановление четыреххлористого циркония магнием и натрием; б) восстановление фтороцирконата калия K2ZrF6 натрием и фторида циркония кальцием; в) восстановление двуокиси циркония кальцием или гидратом кальция. 2. ЭЛЕКТРОЛИЗ РАСПЛАВЛЕННЫХ СРЕД. Основной промышленный способ производства ковкого циркония - восстановление ZrC14 магнием и электролиз. Для получения циркония, используемого в виде порошка, применяют восстановление K2ZrF6 натрием и восстановление ZrО2 кальцием или его гидридом. Для получения металла высокой чистоты используют метод рафинирования с помощью термической диссоциации йодида циркония. Чистый цирконий недостаточно прочен, его коррозионные свойства сильно зависят даже от весьма незначительных количеств некоторых примесей, например азота; вследствие этого механические и коррозионные свойства металла улучшают добавками легирующих элементов [50]. СПИСОК РЕКОМЕНДОВАННОЙ ЛИТЕРАТУРЫ 1. ПОЛЕЖАЕВ Ю. В., ЮРЕВИЧ Ф. В. Тепловая защита. М.: Энергия, 1976. 2. ПАНКРА ТОВ В. М., ПОЛЕЖАЕВ Ю. В. Взаимодействие материала с газовыми потоками. М.: Машиностроение, 1976. 3. АЛЕМАСОВ В. С. Теория ракетных двигателей. М.: Машиностроение, 1980. 4. ФАХРУТДИНОВ И. X. Ракетные двигатели твердого топлива. М.: Машиностроение, 1981. 5. Композиционные материалы: Справочник. М.: Машиностроение, 1990. 6. ФРИДЛЯНДЕР И. Н. // Вестн. АН СССР. 1991. № 2. 7. БРАЦЫХИНЕ. А., ШУЛЬГИНА Э. С. Технология пластических масс. JL: Химия, 1982. 8. РАДЧЕНКО И. В. Молекулярная физика. М.: Наука, 1965. 9. Композиционные материалы: Справочник / Под ред. Д. М. Карпиноса. К.: Наук, думка, 1985. 10. Справочник по пластическим массам / Под ред. В. М. Катчева, В. А. Попова, В. М. Сажина. М.: Химия, 1975. 11. ПОЛЯКОВ В. Л., СМЫСЛ ОВ В. И. Высокопрочные намоточные композиционные материалы. М.: Машиностроение, 1983. 12. Особенности конструкций и проектирование корпусов РДТТ из композиционных материалов / Под ред. акад. Б. П. Жукова. М., 1981. Ч. 1. 13. ФАХРУТДИНОВ И. X., КОТЕЛЬНИКОВ А. В. Конструкция и проектирование двигателей твердого топлива. М.: Машиностроение, 1987. 14. ДУШИН Ю. А. Работа теплозащитных материалов в горячих газовых потоках. JL: Химия, 1968. 15. Композиционные материалы: Справочник / Под ред. В. В. Васильева, Д. М. Тарнопольского. М.: Машиностроение, 1990. 16. НАЗАРОВ Г. Н., СУШКО В. В. Конструкционные пластмассы. М.: Машиностроение, 1983. 17. Технология намоточных изделий. ОСТ-92-901, ОСТ-92-902. 18. Композиционные материалы / Под ред. JI. Браутмана, Р. Крока. Т. 7, ч. 1; Анализ и проектирование конструкций / Под ред. К. Чамиса; Пер. с англ. М.: Машиностроение, 1978. 19. Популярная библиотека химических элементов / Отв. ред. И. В. Петряков-Соколов. М.: Наука, 1983. 20. ГНЕСИНГ. Г., ОСИПОВА И. И., САРТИКЛЕЯЛ. А. Тугоплавкие соединения. Получение, структура, свойства и применение. К.: АН УССР, ИПМ, 1991. 21. СТРИЖАЛО В. А. ДОБРОВОЛЬСКИЙ Ю. В. и др. Прочность и акустическая эмиссия материалов и элементов конструкций. К.: Наук, думка, 1991. 22. Углеродные волокна: Обзор // Mater. Eng. 1990. Vol. 109, № 8. P. 35 - 36. 23. ГНЕСИН Г. Г., ОСИПОВА И. И., РОКТАЛЬ Г. Д. Бескислородная керамика / Под ред. Г. Г. Гнесина. К.: Техника, 1991. 24. ВЕРЕЩАГИН В. А., ЖУРАВЛЕВ В. В. Алмазосодержащие КМ и покрытия. Минск: Наука и техника, 1991. 25. ВОЛГИН М. Е. Новые структуры углерода // Вест. РАН. 1992. Т. 10. 26. ФИАЛКОВ А. С. Технология углеграфитовых материалов. М.: Энергия, 1959. 27. ЧЕРНЫШ И. Г., КАРПОВ И. И. Физико-химические свойства графита и его соединений. К.: Наука, 1990. 28. САНИН Ф. П. Исследование графита, силицированного в глубоком вакууме: Дис. ... канд. техн. наук. Харьков, 1962. 29. ФИЧИНИЖ. Основы физической химии. М.: Мир, 1972. 30. КЭМБЕЛ Д. Техника высоких температур. М.: ИЛ, 1960. 31. БЕЛЯКОВ И. П., ЗЕРНОВ У. А. Технология сборки и испытаний космических аппаратов. М.: Машиностроение, 1990. 32. ДЖУР Е. А., ВДОВИН С. И., КУЧМА Л. Д. и др. Технология производства космических ракет. Днепропетровск: Изд-во Днепропетр. ун-та, 1992. 33. Герметичність у ракетно-космічній техниці // Ф. П. САНІН, С. О. ДЖУР, Л. Д. КУЧМА, В. А. НАЙДЬОНОВ Дніпропетровськ: Вид-во Дніпропетр. ун-ту, 1995. 34. Методы неразрушающих испытаний / Под ред. Р. Шарпа; Пер. с англ. М.: Мир, 1972. 35. ПОТАПОВ А. И., ИГНАТОВ В. М., АЛЕКСАНДРОВ К) Б. Технологический неразрушающий контроль пластмасс. JL: Химия, 1979. 36. БЕЛОКУР И. П., КОВАЛЕНКО В А. Дефектоскопия материалов и изделий. К.: Техника, 1989. 37. Science News // 1990. Vol. 138, № 13. P. 194. 38. САВЕЛЬЕВ И В. Курс физики. М.: Наука, 1989. Т. 3. 39. ЧУКОВА Ю. П. Тайны алмаза. М.: Знание, 1988. 40. ЖЕЛТОВ П. Н., САБЕЛЬНИКОВ А Э. А. Получение углерод-угле- родных композиционных материалов повышенной плотности: Обзор // 1981. Библиотека ГКБЮ. 41. ГОРДЕН Д., БРАУН Д. А. Тугоплавкие металлы в новой технике. М.: ИЛ, 1972. 42. БАЛИЦКИЙ А. В. Технология изготовления вакуумной аппаратуры. М.: Энергия, 1974. 43. ТУЧИНСКИЙЛ. И. Композиционные материалы, получаемые методом пропитки. М.: Металлургия, 1986. 44. Порошковая металлургия в СССР / Отв. ред. И. Н. Францевич, В. И. Трефилов. М.: Наука, 1986. 45. СЛАВИНСКИЙ М. П. Свойства химических элементов. М.: Наука, 1963. 46. Технология металлов и сплавов / Под ред. Б. А. Кузьмина. М.: Машиностроение, 1989. 47. КОТЕЛЬНИКОВ Р. Б., БОЛЬШАКОВ С. Н. и др. Особо тугоплавкие элементы и соединения: Справочник. М.: Металлургия, 1969. 48. КИСЛЫЙ П. С., ПЕРНЕЦЕВ М. А. и др. Карбид бора. К.: Наук, думка., 1988. 49. Основы материаловедения / И. И. СИДОРИН, Г. Ф. КОСОЛАПОВ, В. И. МАКАРОВА, Г. Г. МУХИН, Н. М РЫЖОВ, В. И. СИЛАЕВА, Н. В. УЛЬЯНОВА. М.: Машиностроение, 1976. 50. ВУЛЬФ Б. К., РОМАДИН К. П. Авиационное металловедение. М.: Оборонгиз, 1962. 51. КОРОВСКИЙШ. Я. Летающие металлы. М.: Машиностроение, 1967. 52. ФРИДЛЯНДЛЕРИ. Н. Алюминиевые сплавы. Конструкционные сплавы. М.: Машиностроение. Вып. 5. 53. БЕЛОВА. Ф..ДОБА ТКИНВ. И., ФРИДЛЯНДЛЕР И. Н. Производство полуфабрикатов из алюминиевых сплавов. М.: Металлургия, 1971. 54. Композиционные материалы: Справочник I М. А. АЛФУТОВ, В. В. БОЛОТИН, В. В. ВАСИЛЬЕВ, В. А. ПРОТАСОВ, Ю.М. ТАРНОПОЛЬСКИЙ. М.: Машиностроение, 1990. 55. ЛАХТИН Ю. М., ЛЕОНТЬЕВА В. П. Материаловедение. М.: Машиностроение, 1980. 56. ЗЕЛИКМАН А. Н., КРЕЙН О. Е., САМСОНОВ Г. В. Металлургия редких металлов. М.: Металлургия, 1978. 57. БОБЫЛЕВ А. В. Механические и технологические свойства металлов. М.: Металлургия, 1980. 58. ГЛАЗУНОВ С. Г., МОИСЕЕВ В Н. Конструкционные титановые сплавы. М.: Металлургия, 1974. 59. КОЛАЧЕВ Б. А., ЛИВАНОВ В. А., ЕЛАГИН В. И. Металловедение и термическая обработка цветных металлов и сплавов. М.: Металлургия, 1981. 60. Конструкционные материалы: Справочник / Под ред. Б. Н. Арзамасова. М.: Машиностроение, 1990. 61. ХИМУШИН Ф. Ф. Жаропрочные стали и сплавы. М.: Металлургия, 1969. 62. РАДОМЫСЕЛЬСКИЙИ. Д., СЕРДЮКГ. Г., ЩЕРБАНЬ Н. И Конструкционные порошковые материалы. К.: Техника, 1985. 63. Бериллий: наука и технология / Пер. с англ.; Под ред. Г. Ф. Тихинского. М.: Металлургия, 1984. 64. СТАНО В. В., ЧЕРНЕНКО М. Б. Популярная библиотека химических элементов. М.: Наука, 1983. 65. ЗЕЛИКМАН А. Н., КОРШУНОВ Б. Г„ ЕЛЮТИНА. В. Ниобий и тантал. М.: Металлургия, 1990. 66. Ниобий и его сплавы / Г. В ЗАХАРОВА, И. А. ПОПОВ, А. П. ЖОРОВА, Б. В. ФЕДИН. М.: Металлургиздат, 1961. 67. ТИТЦ Т., УИЛСОН Д. Ж. Тугоплавкие металлы и сплавы. М.: Металлургия, 1969. 68. Молибден в ядерной энергетике / Под ред. В. Е. Емельянова, А. И. Светюхина. М.: Атомиздат, 1977. 69. КИНДЯКОВ П. С., КОРШУНОВ Б. Г„ ФЕДОРОВ П. И. Химия и технология редких и рассеянных металлов. М.: Высш. шк., 1978. 70. Энциклопедия неорганических материалов / Отв. ред. И. Н. Федорченко. К.: Главная редакция УСЭ, 1977. СОДЕРЖАНИЕ Введение | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
