Целая. Учебник для студентов высших учебных заведений, обучающихся по специальностям Летательные аппараты
 Скачать 32.33 Mb. Скачать 32.33 Mb.
|
|
9.2. БЕРИЛЛИИ И ЕГО СПЛАВЫ В начале нашего века в справочниках и энциклопедиях о бериллии говорилось: «Практического применения не имеет». Открытый еще в 1798 г. французским физиком Вакленом, бериллий 100 с лишним лет оставался «безработным» элементом, хотя химикам уже были известны его уникальные и очень полезные свойства. Для того чтобы эти свойства перестали быть «вещью в себе», необходимо было достичь определенного уровня в развитии науки и техники. 9.2.1. МИНЕРАЛЫ БЕРИЛЛИЯ Бериллий - типично редкий элемент. На тонну земного вещества в среднем приходится лишь 4,2 г бериллия. Это, конечно, очень немного, но и не так уж мало, если вспомнить, что , например, такого известного элемента, как свинец, на Земле вдвое меньше, чем бериллия. Обычно бериллий встречается как незначительная примесь в различных минералах земной коры. И лишь ничтожная часть земного бериллия сконцентрирована в собственно бериллиевых минералах. Их известно более 30, но только 6 из них считаются более или менее распространенными. Наиболее часто встречающимся минералом является берилл (ЗВеОА1203SiO2), известный человеку с доисторических времен. Кроме него промышленное значение имеют фенакит (Ве2SiO4), хризоберилл (ВеА12O4), бертрандит ВеSi2O7(OН)2), бериллит (Ве2ВаSi2O7), гельвит (Мn, Fе, Zn)8 (Ве6 Si4O24Sа). Бериллы встречаются в гранитных пегматитах, имеющихся почти во всех странах мира. Это красивые зеленоватые кристаллы, достигающие иногда очень больших размеров; известны бериллы-гиганты весом до тонны и длиной до 9 м. К сожалению, пегматитовые месторождения очень бедны, и добывать там берилл в широких промышленных масштабах не удается. Однако есть и другие источники бериллия, где его концентрация гораздо выше. Это так называемые пневмо-гидротермальные месторождения, образовавшиеся в результате взаимодействия высокотемпературных паров и растворов с определенными типами горных пород. 9.2.2. СВОЙСТВА БЕРИЛЛИЯ Природный бериллий состоит из единственного устойчивого шпата 9Ве. Интересно, что бериллий - единственный элемент периодической системы, имеющий при четном номере один стабильный изотоп. Известно еще несколько нестабильных радиоактивных изотопов бериллия. Многие ученые считают, что изотопы бериллия 10Ве и 7Ве образуются не в недрах Земли, а в атмосфере - в результате воздействия космических лучей на ядра азота и кислорода. Незначительные примеси этих изотопов обнаружены в дожде, снеге, воздухе и морских отложениях. Однако если собрать воедино весь 10Ве, находящийся в атмосфере, водных бассейнах, почве и на дне океана, то получится довольно внушительная цифра - около 800 т. Изотоп 10Ве (период полураспада 2,5∙106 лет) представляет исключительный интерес для геохимии и ядерной метеорологии. Рождаясь в атмосфере, на высоте примерно 25 км, атомы 10Ве вместе с осадками попадают в океан и оседают на дне. Зная концентрацию 10Ве во взятой со дна пробе и период полураспада этого изотопа, можно вычислить возраст любого слоя на дне океана. Бериллий-10 аккумулируется также в морских илах и ископаемых костях. В связи с этим возникло предположение о возможности определения возраста органических остатков по 10Ве. Жизнь другого изотопа (7Ве) значительно короче: период его полураспада равен всего 53 дням. Поэтому неудивительно, что количество его на Земле измеряется граммами. Данный изотоп можно получить и в циклотроне, но этот способ - дорогостоящий. Поэтому широкого применения этот изотоп не получил. Его используют иногда для прогнозирования погоды. Физические свойства 9Be
Свойства бериллия чаще всего именуются «удивительными», «чудесными» и т. п. Отчасти это справедливо: по крайнем мере главная «удивительность» заключается в сочетании противоположных, иногда, казалось бы, взаимоисключающих свойств. Одновременно бериллий обладает и легкостью, и прочностью, и теплостойкостью. Этот металл серебристо-серого цвета в полтора раза легче алюминия и в то же время прочнее специальных сталей. Особенно важно, что бериллий и многие его сплавы не утрачивают полезных свойств при температурах 700...800 °С и могут эксплуатироваться в таких условиях. Чистый бериллий очень тверд, - им можно резать стекло. К сожалению, твердости сопутствует хрупкость. Бериллий очень устойчив против коррозии. Как и алюминий, он покрывается при взаимодействии с воздухом тонкой окисной пленкой, защищающей металл от воздействия кислорода даже при высоких температурах. Лишь за порогом 800 °С идет окисление бериллия в массе, а при температуре 1 200 °С металлический бериллий сгорает, превращаясь в белый порошок ВеО. У бериллия малое сечение захвата нейтронов и большое сечение их рассеяния. Иными словами, бериллий (а также его оксид) рассеивает нейтроны, изменяет направление их движения и замедляет их скорость до таких величин, при которых цепная реакция может протекать более эффективно. Из всех твердых материалов бериллий считается лучшим замедлителем нейтронов. К вышеотмеченному добавим, что бериллий может выполнять роль отражателя нейтронов: менять их направление, возвращать нейтроны в активную зону реактора, противодействовать их утечке. Бериллию свойственна также значительная радиоактивная стойкость, сохраняющаяся и при очень высоких температурах. На всех этих свойствах основано применение бериллия в атомной технике - он один из самых необходимых ей элементов. Замедлители и отражатели из бериллия и его окиси позволяют значительно уменьшить размеры активной зоны реакторов, увеличить рабочую температуру и эффективнее использовать ядерное топливо. Поэтому, несмотря на высокую стоимость бериллия, его использование считают экономически оправданным, особенно в небольших энергетических реакторах для спутников и морских судов. Окись бериллия стала важным материалом для изготовления оболочек тепловыделяющих элементов (твэлов) атомных реакторов. Большая теплопроводность (в 4 раза выше, чем у стали), большая теплоемкость и жаропрочность позволяют использовать бериллий и его соединения в теплозащитных конструкциях космических кораблей. Из бериллия была выполнена внешняя тепловая защита капсулы космического корабля «Френдшип-7», на котором Джон Гленн первым из американских астронавтов совершил (после Юрия Гагарина и Германа Титова) орбитальный полет. Космическую технику еще в большей мере привлекает в бериллии легкость, прочность и, особенно, удельная прочность. Поэтому бериллий и его сплавы все шире используются в космической, ракетной и авиационной технике. В частности, благодаря способности сохранять высокую точность и стабильность размеров бериллиевые детали используют в гироскопах - приборах, входящих в систему ориентации и стабилизации ракет, космических кораблей и искусственных спутников Земли. Бериллий амфотерен, то есть обладает свойствами и металла и неметалла. Однако металлические свойства все же преобладают. С водородом бериллий не реагирует даже при нагревании до 1 000°С, зато легко соединяется с галогенами, серой и углеродом. Из галогенов бериллия наибольшее значение имеют его фторид и хлорид, используемые в процессе переработки бериллиевых руд. Бериллий хорошо растворяется во всех минеральных кислотах, кроме, как это ни странно, азотной. От нее, как и от кислорода, бериллий защищен окисной пленкой. Окись бериллия (ВеО) обладает ценными свойствами и в некоторых случаях конкурирует с самим бериллием. Высокая тугоплавкость (температура плавления 2570 °С), значительная химическая стойкость и большая теплопроводность позволяют применять окись бериллия во многих отраслях техники, в частности для футеровки бессердечниковых индукционных печей и тиглей для плавки различных металлов и сплавов. Интересно, что окись бериллия совершенно инертна по отношению к металлическому бериллию. Это единственный материал, из которого изготовляют тигли для плавки бериллия в вакууме. При горении бериллия выделяется много тепла - 63000 кДж/кг. Поэтому он может быть компонентом высокоэнергетического ракетного горючего. 9.2.3. СПЛАВЫ БЕРИЛЛИЯ Бериллий легко образует сплавы со многими металлами, придавая им высокую твердость, прочность, жаростойкость и коррозионную стойкость. Лишь несколько легирующих элементов - медь, никель, кобальт, и в меньшей мере железо, - образуют твердые растворы в бериллии. Большинство сплавов типа твердых растворов существенно прочнее по сравнению с рафинированным металлом (из которого удалены примеси). Однако легированием не удалось улучшить пластичность, - и был сделан вывод о невозможности этого. Бериллий образует множество интерметаллических соединений, которые часто играют важную роль как при разработке сплавов, так и при получении бериллиевых композитов. Например, возможность получения композитов Ве-Ti ограничена вследствие образования значительного количества ТiВе11 при температуре выше 705 °С. А 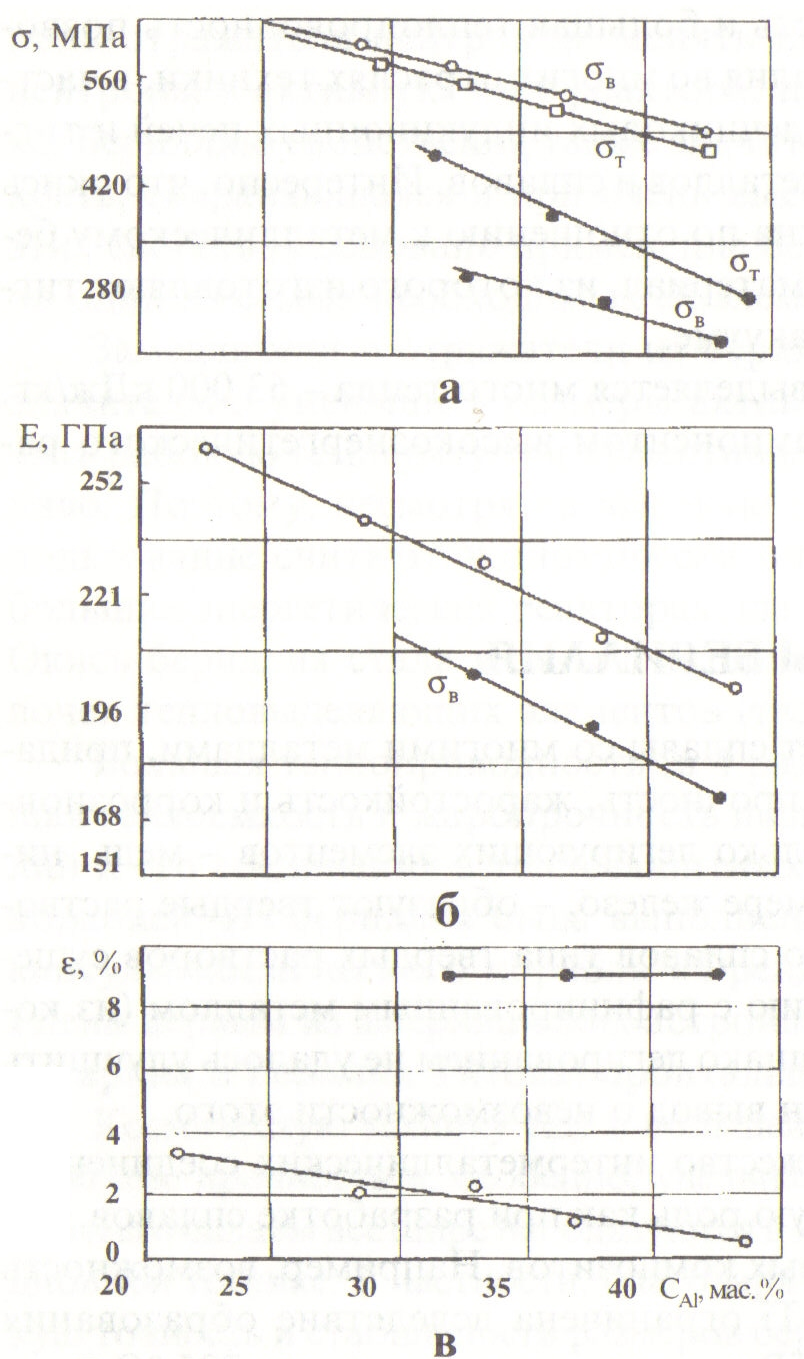 люминий является главной легирующей добавкой, не образующей интерметаллического соединения с бериллием. Он почти не растворяется в твердом бериллии, так же как бериллий в алюминии, - таким образом сплавы Ве - А1 являются, по существу, смесью чистых металлов. люминий является главной легирующей добавкой, не образующей интерметаллического соединения с бериллием. Он почти не растворяется в твердом бериллии, так же как бериллий в алюминии, - таким образом сплавы Ве - А1 являются, по существу, смесью чистых металлов.С Рис. 86. Свойства сплава Be – Al в зависимости от содержания алюминия: а, б – в состоянии после деформации; в- после термической обработки плавы Ве - А1 обычно получают методом быстрой кристаллизации, в результате которой образуется дисперсная смесь достаточно чистых бериллия и алюминия. В закристаллизованном материале алюминий, как правило, образует непрерывную сетку, но последующая термообработка приводит к возникновению двух смешанных фаз. Механические свойства сплавов определяются содержанием алюминия, как это показано на рис. 86 для деформированного и отожженного материала. Из графика видно, что свойства при растяжении, включая модуль упругости, уменьшаются с увеличением содержания алюминия. Наиболее часто используемый сплав Ве - А1, именуемый локаллоем, содержит 38 % (по массе) А1; его получают в виде прессованных заготовок и горячекатаных листов. Эти сплавы были использованы в некоторых космических кораблях, главным образом благодаря хорошей экструдируемости, легкости механической обработки, лучшей формуемости по сравнению с нелегированным бериллием. Одним из широко применяемых сплавов бериллия является бериллиевая бронза - материал, позволяющий решить многие сложные технические задачи. Бериллиевыми бронзами называют сплавы меди с 1…3% бериллия. В отличие от чистого бериллия они хорошо поддаются механической обработке, из них можно, например, изготовить ленты толщиной всего 0,1 мм. Разрывная прочность этих бронз больше, чем у многих легированных сталей. Еще одна примечательная деталь: с течением времени большинство материалов, в том числе и металлы, «устают» и теряют прочность. Бериллиевые бронзы - наоборот. При старении их прочность возрастает. Из них делают пружины, рессоры, амортизаторы, подшипники и многие другие изделия, от которых требуется большая прочность, хорошая сопротивляемость усталости в широком интервале температур, высокие электро- и теплопроводные характеристики. Одним из потребителей этого сплава стала авиационная промышленность: утверждают, что в современном тяжелом самолете насчитывается больше тысячи деталей из бериллиевой бронзы. Но, к сожалению, есть факторы, ограничивающие применение бериллия, они вполне реальны и не учитывать их нельзя. Это, прежде всего, хрупкость металла. Она намного усложняет процесс его механической обработки, затрудняет получение больших листов бериллия и сложных профилей, необходимых в тех или иных конструкциях. Предпринимаются упорные попытки устранить этот недостаток. Но, несмотря на некоторые успехи ( изготовление металла высокой чистоты, различные технологические усовершенствования), получение пластичного бериллия продолжает оставаться трудной проблемой. Второе - токсичность бериллия. Допустимые пределы содержания бериллия в воздухе очень малы - всего 0,001 мг/м3. Это значительно меньше допустимых норм для большинства металлов, даже таких токсичных, как свинец. Тщательный контроль за чистотой воздуха, особые системы вентиляции, возможно большая автоматизация производства - все это позволяет успешно бороться с токсичностью бериллия и его соединений. И наконец, третье, и очень важное - высокая стоимость бериллия. Цена 1 кг его в США на сегодня составляют более 300 долларов, то есть бериллий в несколько раз дороже титана. Между тем рост потребления всегда приводит к технологическим усовершенствованиям, которые, в свою очередь, способствуют уменьшению издержек производства и цены. В будущем спрос на бериллий возрастет еще больше: ведь этот металл человечество начало применять всего несколько десятилетий тому назад. И, конечно, достоинства бериллия возьмут верх над его недостатками. Теперь несколько (их может быть гораздо больше!) ответов на вопрос: «Что может нам дать бериллий?». Самолет, вес которого вдвое меньше обычного; ракетное топливо с наивысшим удельным импульсом; боевые блоки ракет, которые в 2...2,5 раза легче алюминиевых; пружины, способные выдержать до 20 миллиардов (!) циклов нагрузки, - пружины, не знающие усталости, практически вечные. В 30-х годах академик А. Е. Ферсман назвал бериллий металлом будущего. Сейчас о бериллии можно и должно говорить как о металле настоящего [67 - 70]. 9.3. ТИТАН И ЕГО СПЛАВЫ 9.3.1. КРАТКИЕ ИСТОРИЧЕСКИЕ СВЕДЕНИЯ Элемент титан открыт в 1791 г. английским любителем-минералогом Грегером в черных магнитных железистых песках в Корнуэле. Новый элемент был назван менакенитом. В 1795 г. немецкий химик Клапрот, исследовавший минерал рутил, установил, что он представляет собой окисел нового элемента. Несколько лет спустя была доказана идентичность менакенита и титана. В 1849 г. за металлический титан принимали металлоидный карбонитрид титана, найденный в шлаках доменных печей. Относительно чистый титан был получен Хартером лишь в 1910 г. - спустя 120 лет после открытия элемента. Применение титана в виде химических соединений и присадок в сплавы относится к первым десятилетиям нашего века. В годы второй мировой войны возник интерес к титану как к конструкционному материалу. Это привело к разработке промышленных способов получения ковкого титана и организации в начале 50-х годов в ряде стран (США, СССР, Англии) крупного производства титана и сплавов на его основе. 9.3.2. ПОЛУЧЕНИЕ ТИТАНА. ЕГО СВОЙСТВА Организация промышленного производства титана была вызвана потребностью получения материалов для конструкций минимальной массы при высокой их прочности. В таких материалах прежде всего заинтересованы авиация и ракетная техника. По своей распространенности в земной коре титан занимает среди металлов четвертое место после алюминия, железа и магния. Содержание его в земной коре 0,61 %. Известно около 70 минералов титана. Из них наибольшее промышленное значение имеют рутил, ильменит, перовскит и сфен, являющиеся собственно титановыми минералами. Руды, из которых получают титан: рутил - ТiO2, ильменит - FeО ТiO2 и титаномагнезиты. Рутил обладает алмазно-металлическим блеском, прозрачен, красно-коричневого цвета, иногда желтоватый, синеватый, фиолетовый, черный. Плотность 4180...4280 кг/м3. Крупные месторождения рутила крайне редки. Ильменит - метатитанат железа FеТiO3 - наиболее распространенный минерал титана. Впервые найден на Урале в Ильменских горах. Минерал бурого или буро-черного цвета, его плотность 4560...5210 кг/м3. Часто ильменит находится в тесной связи с магнетитом Fе3O4. Такие руды называют титаномагнетитами. Кроме того, известны гематитаноиль- мениты, в которых ильменит находится в смеси с гепатитом Fе2O3. Ильменит добывают преимущественно из речных и прибрежно-морских россыпей, образовавшихся в результате выветривания различных горных пород. Месторождения титаномагнетитовых песков найдены на Украине. Из концентратов непосредственно получают три вида продуктов: двуокись титана, ферротитан и четыреххлористый титан. Последний - основное исходное соединение в производстве металлического титана. В промышленности металлический титан обычно получают восстановлением четыреххлористого титана металлическим магнием или натрием в атмосфере инертного газа. Полученная при этом титановая губка маркируется по твердости выплавленных из нее образцов - ТГ100, ТГ105, ТГ110 и т.д. Для получения монолитного титана губку размалывают в порошок, прессуют и спекают или переплавляют в дуговых печах в вакууме или атмосфере инертных газов. Для уменьшения количества примесей и более равномерного распределения их по сечению слитка рекомендуется 2-3-разовая переплавка. Характерная для титановых слитков крупнозернистая структура измельчается путем модификации цирконием или бором. Полученный в результате переплава технический титан маркируется в зависимости от содержания примесей (табл. 41). Чистейший йодидный титан получают методом термической диссоциации из четыреххлористого титана, а также методом зонной плавки. Титан имеет две аллотропические модификации. Низкотемпературная модификация Тіα, существующая до 882 °С (1155 К), имеет гексагональную плотноупакованную решетку с периодом а = 2,96 Å и с = 4,72 Å. Высокотемпературная модификация Тіβ имеет решетку объемно-центрированного куба с периодом а = 3,32 Å при 900 °С (1173 К). Таблица 41 |
