ист_тех. Учебник СанктПетербург 2003 Утверждено редакционноиздательским советом спбгиэу рецензенты
 Скачать 29.41 Mb. Скачать 29.41 Mb.
|
7.2. Создание гальванического элемента и аккумулятораВ 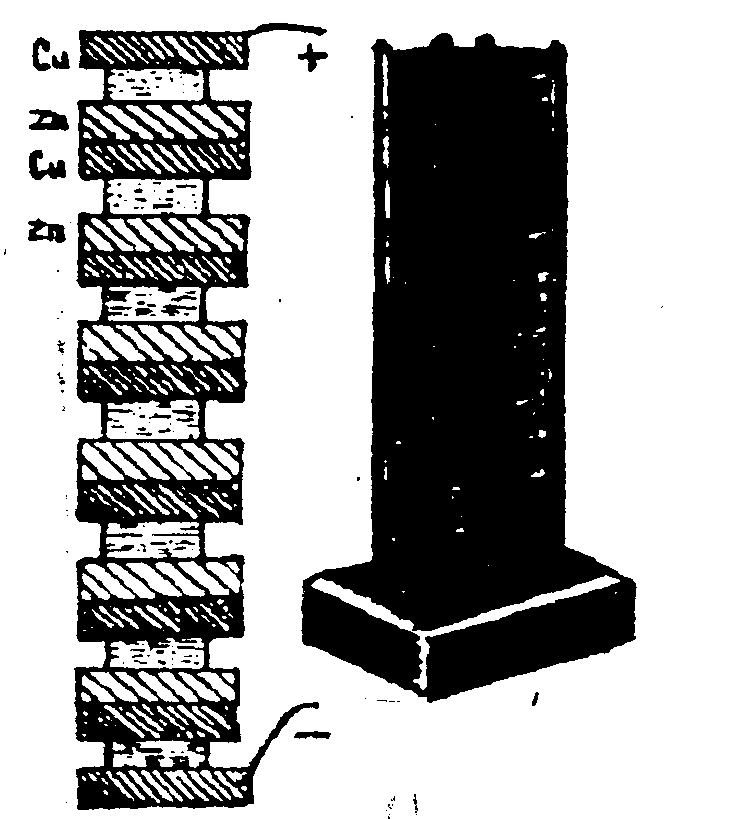 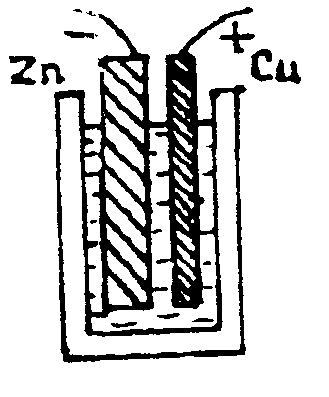 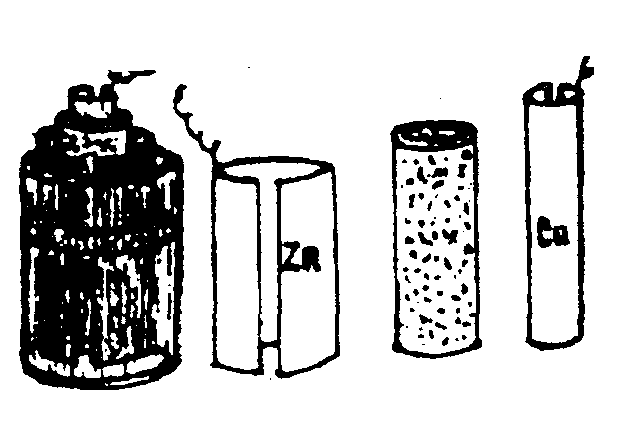 конце 1799 года А. Вольта изготовил гальванический элемент, который состоял из 20 пар медных и цинковых кружков, разделенных суконными кружочками, смоченными соленой водой (рис.7.2а). 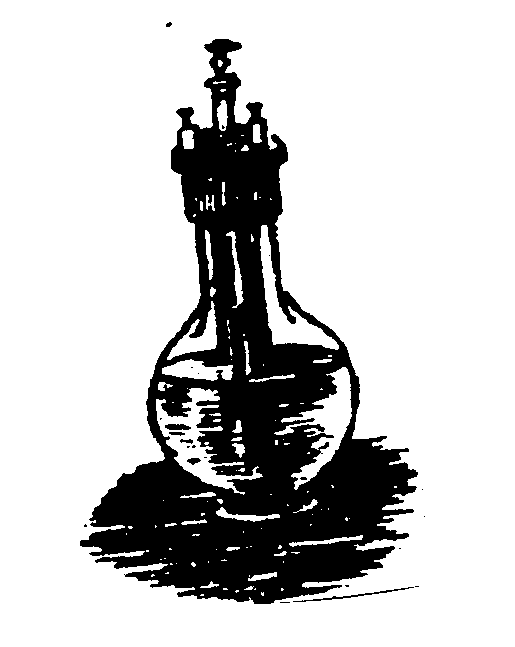 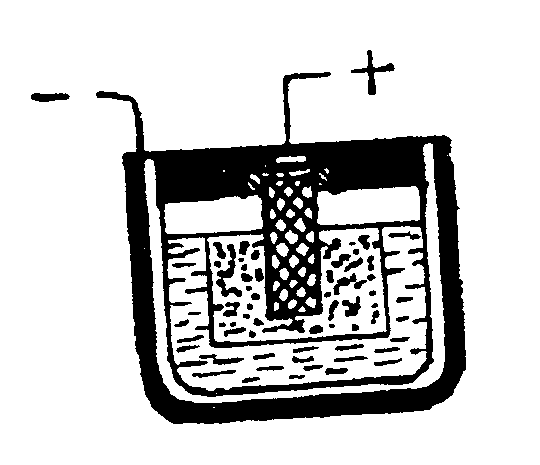  а) б) в)   г) д) е) ж) з) Рис. 7.2. Схемы гальванических элементов и аккумуляторов Открытие гальванического элемента позволило создать источник постоянного тока и приступить к изучению действий электрического тока. В 1802 году русский физик Василий Владимирович Петров (1761-1834) сконструировал большую гальваническую батарею с электродвижущей силой около 1700В. С помощью этого мощного источника тока были получена электрическая дуга, исследованы различные воздействия тока на проводник, явления электролиза, электропроводность различных веществ, произведен электрический разряд в вакууме. При проведении опытов Петров В.В. обратил внимание на необходимость изоляции проводов. Им были разработаны оригинальные конструкции электростатических машин и приборов. Простейший элемент Вольта (рис.7.2б) состоит из медного и цинкового электродов, погруженных в 10-20 процентный раствор серной кислоты, налитой в сосуд. Но с течением времени элемент поляризуется т.е. э.д.с. уменьшается за счет выделения газообразного кислорода на медной пластинке. Более совершенным является элемент Грене (рис.7.2б), имеющий форму бутылки с крышкой, в которой закрепляются две пластинки из угля, между ними укрепляется цинковая пластинка, которую можно было поднимать или опускать во время опытов в раствор жидкости, состоящей из 12 равных частей двухромного калия К2Сr2O7, 25 частей серной кислоты H2SO4 и 100 частей воды Н2О. Вещество К2Cr2О7 – деполяризатор, разрушающий водородную оболочку вокруг электрода, э.д.с. элемента – 1,5В. В 1836 году академик Б.С.Якоби (1801-18740) в России и одновременно английский химик Джон Даниэль (1790-1845) создали медно-цинковый элемент, создающий постоянную э.д.с. (рис.7.2г). Ток возникает за счет разности потенциалов между цинковой и магнитной пластинами. э.д.с. элемента равны 1,45В. В 1839 году немецкий физик Роберт Бунзен (1811-1899) заменил медную пластину угольным цилиндриком, погруженным в азотную кислоту, и позднее французский химик Ж. Лекланше в 1865 году создал угольный гальванический элемент (рис.7.2д), получивший широкое применение. В этом элементе цилиндрическая цинковая пластинка и угольный стержень погружаются в раствор нашатыря NH4Cl и двуокиси марганца MnO2 в качестве катализатора э.д.с. элемента равно 1,45В. В 1844 г. русский ученый П.Р. Багратион (1818-1876), племянник генерала П.И. Багратиона предложил “сухой” элемент (рис.7.2е), который был разработан на базе элемента Лекланше. В состав этого элемента входят растворы солей и кислот, но они впитаны пористыми веществами, например, древесными опилками, глиной и т.д. Так, батарейка карманного фонарика состоит из трех соединенных друг с другом сухих элементов Лекланше, каждый из которых состоит из цилиндрической цинковой баночки и угольного стержня, погруженного в раствор нашатырного спирта, приготовленного на крахмальной основе. Чтобы нашатырь не испарялся, цилиндр сверху закрывают прокладкой, и заливается мастикой. Элемент работает до тех пор, пока не израсходуется весь раствор или весь цинк. Гальванические элементы предназначены для разового применения. Наиболее перспективны электрические аккумуляторы, которые основаны на обратимых электрических процессах. Они являются главными энергетическими источниками на кораблях, автомобилях, мотоциклах, экскаваторах, тракторах, самолетах, автобусах, видеоустановках, телефонных установках, применяются для освещения поездов и др. Аккумуляторы надежны в работе, просты в эксплуатации, постоянно готовы к действию. Явление поляризации, которое несет вред гальваническим элементам, нашло свое применение в аккумуляторах. Идея применения поляризации для вторичных процессов принадлежит Б.С. Якоби. Практически пригодные кислотные аккумуляторы были созданы французским физиком Гастоном Планте (1834-1889) в 1860 году (рис.7.2ж), а щелочные аккумуляторы – американским изобретателем Томасом Алва Эдисоном (1855-1930) в 1900 году (рис.7.2з). В последнее время широкое применение получили серебряно- цинковые аккумуляторы, в которых электроды из цинка (-) и окиси серебра (+) разделены слоем целофана и плотно упакованы в сосуде из пластмассы со щелочным электролитом. Плотные упаковки электродов и малый объем свободного электролита позволяют использовать эти аккумуляторы для электропитания искусственных спутников Земли, переносных телевизионных камер, портативных аппаратов для точечной сварки и др. |
