УМК КСЕ СПО. Учебнометодический комплекс по дисциплине концепции современного естествознания для студентов всех специальностей
 Скачать 3.72 Mb. Скачать 3.72 Mb.
|
|
Практическая часть В настоящей работе используются для исследования распределения потенциала метод аналогий для сеточных моделей. Сущность его состоит в следующем. Пусть на плоскости XY заданы положение электродов и их потенциалы (сетка на макете). Выберем пять рядом лежащих точек: расстояние между ними в простейшем случае должны быть равны стороне ячейки клетки. Нетрудно заметить, что если расстояние между узлами сетки мало, то по формулам конечных приращений, электрическая сетка, пригодна для моделирования распределения параметров порядка (потенциала поля от электродов). Распределение потенциала непрерывная функции координат (X,Y) – исследуемого поля, а дискретное измерение дает приближенное представление только о тех точках исходного поля, которые соответствуют узловым точкам модели. Изучить измерительную схему макета (представленную на макете), в которой форма электродов задается преподавателем. 1. Подготовить рисунок с масштабной сеткой, эквивалентной аналоговой модели поля макета (число клеток на бумаге должно соответствовать числу ячеек модели, электроды на бумаге должны располагаться так же, как и на модели). 2. Включить источник питания, подав тем самым напряжение на электроды. Один электрод соединяется с отрицательным полюсом батареи общий (заземлен), другой подключен к положительному полюсу. Свободный электрод (зонд) (положительный электрод тестера) предназначен для последовательного измерения потенциала в узлах модели-матрицы, нанося его значения в узлы подготовленной на бумаге сетки в бланке-отчете. 3. После нанесения всех цифровых значений потенциалов соответствующих узловых точек, соединить точки с одинаковыми значениями потенциала. 4. На семейство эквипотенциальных линий построить нормальное к ним семейство силовых линий электрического поля, указав их направление. 5. Отметить стрелками направление электрического поля (на полученной модели электрического поля). Найти зависимость Е(x), используя связь между напряженностью поля Е и потенциалом . Контрольные задания 1. Что такое напряженность электрического поля? 2. Почему электростатическое поле потенциально? 3. Сформулируйте закон сохранения заряда. 4. Что такое электрический диполь? 5. Как происходит моделирование полей? Лабораторная работа № 4. ИССЛЕДОВАНИЕ ОБМЕННЫХ ПРОЦЕССОВ Цель работы: изучение зависимости полезной мощности, коэффициента полезного действия, силы тока в цепи и напряжения от величины внешнего сопротивления (нагрузки). Материалы и оборудование: источник тока, переменное сопротивление, амперметр, вольтметр; программное обеспечение: Gnuplot; kse.exe. Теоретическая часть Электрический ток представляет собой направленное, упорядоченное движение заряженных частиц (носителей тока) под действием поля. При отсутствии электрического поля носители тока совершают хаотическое движение, и через любую воображаемую поверхность проходит в обе стороны в среднем одинаковое число носителей любого знака, так что ток через поверхность равен 0. Количественной характеристикой электрического тока служит сила тока, которая определяется как заряд, переносимый через рассматриваемую поверхность в единицу времени. Для поддержания постоянной величины силы тока необходимы сторонние силы, действующие либо на отдельных участках цепи, либо во всей цепи. Эти силы могут быть обусловлены химическими процессами (гальванические элементы, аккумуляторы), диффузией носителей тока в неоднородной среде, электрическими полями, порождаемыми меняющимися во времени магнитными полями (генераторы) и т.д. Всякое устройство, в котором возникают сторонние силы, называется источником тока. Характеристикой источника тока является электродвижущая сила, которая определяется как работа сторонних сил источника тока по перемещению единичного положительного заряда с отрицательного полюса источника на положительный. На участке электрической цепи, содержащей источник тока, кроме сторонних сил, на заряд действуют силы электростатического поля, результирующая сила, действующая в каждой точке цепи на заряд, равна разности этих сил. Закон Ома для замкнутой цепи: где Мощность источника может расходоваться на совершение работы в нагрузке и зависит от внутреннего сопротивления и сопротивления нагрузки. Мощность, развиваемая источником, выделяется на внутреннем сопротивлении источника Отношение полезной мощности, развиваемой источником, называется коэффициентом полезного действия: Из формул видно, что при заданных  где При этом условии коэффициент полезного действия равен: Зависимости 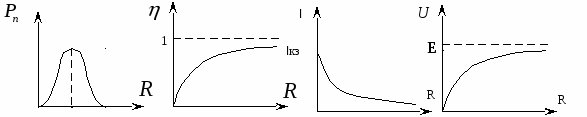 Рис.3. Зависимости мощности, коэффициента полезного действия, тока и напряжения источника тока от сопротивления нагрузки. Интерпретация проделанной работы применительно к социально-экономической сфере достаточно проста с использованием метода аналогий. Например, динамика (зависимость передаваемой мощности) (продаваемой продукции) от сопротивления нагрузки (эластичности спроса-предложения) похожи (аналогичны), поскольку в условиях равновесия работают потенциальные модели, основанные на принципе наименьшего действия и принципе непрерывности (закон полного тока). При равенстве сопротивления нагрузки внутреннему сопротивлению генератора (издержек производителя) имеет место максимальная передача мощности (максимальная прибыль) при этом эластичность единичная. Рассмотрим второй случай: сопротивление нагрузки равно бесконечности, т.е. разрыв цепи постоянный ток не течет и в нагрузке не выделяется мощность – это соответствует абсолютно неэластичному спросу. Напряжение на выходе равно приблизительно электродвижущей силе генератора (источника тока). Произведенная продукция не находит спроса. Мы рассматриваем только тот случай, когда производитель только продает, а покупатель покупает. Рассмотрим третий случай: сопротивление нагрузки равно нулю, в цепи течет ток короткого замыкания. Это соответствует тому состоянию, когда продукция предлагается по цене ниже рыночной или вообще бесплатно, в результате спрос (ток) значительно возрастает и достигает в предельном случае (сопротивление нагрузки равно нулю) величины тока короткого замыкания. Продавец не получает прибыли и работает себе в убыток. Практическая часть Исследование зависимости силы тока, напряжения, полезной мощности и коэффициента полезной мощности в замкнутой цепи от величины внешнего сопротивления (нагрузки) по схеме лабораторного макета. 1. Измерить напряжение на клеммах источника без нагрузки, показания вольтметра будут близки к величине э.д.с. источника. Записать показания вольтметра. 2. Подключить нагрузку к источнику. Изменяя сопротивление нагрузки измерить силу тока и напряжения на нагрузке, результаты измерения произвести не меньше, чем для десяти значений силы тока в цепи, перекрывающих весь диапазон. 3. Вычислить значения 4. Построить графики зависимости 5. По графику определить ток короткого замыкания и внутреннее сопротивление источника.
1. Что такое электрический ток? 2. Назовите условия возникновения электрического тока. 3. Что такое сторонние силы? Дайте определение электродвижущей силы. 4. При каком сопротивлении нагрузки полезная мощность максимальна? 5. Каково значение к.п.д. источника тока при максимальной полезной мощности Лабораторная работа № 5. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ ПРОЦЕССОВ Цель работы: изучение влияния различных факторов на протекание химических реакций. Оборудование и реактивы: водяная баня, пробирки, лучинка, спички, стаканы (100 мл), секундомер, цилиндры (50 мл), термометры, химические стаканы; мел или мрамор (кусочки и порошок), MnO2, KCl; растворы: H2SO4 (1 М), HCl (2 М), KOH (2 М), H2O2 (30%-ный), FeCl3 (0,001 М и 0,1 М), KNCS (0,001 М и 0,1 М), K2CrO4 (0,1 М), Na2S2O3 (0,1 М); дистиллированная вода. Теоретическая часть Химическая реакция заключается в разрыве одних и образовании других связей, поэтому она сопровождается выделением или поглощением энергии в виде теплоты, света, работы расширения образовавшихся газов. Скорость химической реакции определяется количеством вещества, прореагировавшего в единицу времени в единице объема. v = ∆С / ∆τ моль/(л·с) Скорость реакции зависит от природы реагирующих веществ и от условий, в которых реакция протекает. Важнейшими из них являются: концентрация, температура и присутствие катализатора. Природа реагирующих веществ оказывает решающее влияние на скорость реакции. В большинстве случаев при повышении температуры на 10° скорость гомогенной реакции увеличивается в 2–4 раза – правило Вант-Гоффа. Зная величину γ, можно рассчитать изменение скорости реакции при изменении температуры от Т1 до Т2 по формуле ∆v = v (Т2) / v (Т1) = γ(T2–T1)/10 Из этого следует, что при повышении температуры в арифметической прогрессии скорость возрастает в геометрической. Катализ – изменение скорости химической реакции в присутствии катализаторов. Вещества, ускоряющие скорость химической реакции, но остающееся неизменным после того, как химическая реакция заканчивается, называются катализаторами, а замедляющие скорость химической реакции – ингибиторами. Катализ играет большую роль не только в химии, но и в биологии, так как практически все биохимические превращения, происходящие в живых организмах, являются каталитическими. В роли катализаторов в этом случае выступают ферменты – вещества биологического происхождения. Химические реакции, которые при одних и тех же условиях могут идти в противоположных направлениях, называются обратимыми. Изменения, происходящие в системе в результате внешних воздействий, определяются принципом подвижного равновесия – принципом Ле Шателье: внешнее воздействие на систему, находящуюся в состоянии равновесия, приводит к смещению этого равновесия в направлении, при котором эффект произведенного воздействия ослабляется. Принцип Ле Шателье универсален, так как применим не только к химическим процессам, но и к физическим, таким, как плавление, кипение и т.д. Практическая часть Опыт 1. Зависимость скорости реакции от концентрации реагирующих веществ В три большие пробирки налейте 0,1 М раствор Na2S2O3 и H2O, в другие три пробирки – 1 М раствора H2SO4 по приведенной ниже схеме (см. таблицу). Попарно слейте приготовленные растворы Na2S2O3 и H2SO4, начните отсчет времени по секундомеру до начала помутнения. Na2S2O3 + H2SO4 = Na2SO4 + S + SO2 + H2O Постройте график зависимость скорости реакции от концентрации Na2S2O3, откладывая на оси абсцисс концентрацию Na2S2O3, а на оси ординат – величину, пропорциональную скорости.
Опыт 2. Зависимость скорости реакции от температуры Налейте в две пробирки по 5 мл 0,1 М раствора Na2S2O3, в другие две по 5 мл 1 М раствора H2SO4. Разделить их на две пары, по пробирке с Na2S2O3 и H2SO4 в каждой паре. Отметьте температуру воздуха в лаборатории. Слейте вместе растворы первой пары и запишите время протекания реакции (до появления мути). Вторую пару пробирок поместите на водяную баню и нагрейте до температуры, превышающей комнатную на 10 °С и запишите время протекания реакции. Запишите результаты в виде таблицы:
Постройте график зависимость между скоростью реакции и температурой. Опыт 3. Зависимость скорость реакции от площади поверхности реагирующих веществ Поместите в одну пробирку кусочки, а в другую порошок мрамора (или мела), предварительно взвесив их на технических весах по 0,5 г. Прилейте в обе пробирки по 5 мл разбавленной HCl. Запишите время полного протекания реакций. Объясните влияние поверхности реагирующих веществ на скорость реакции в гетерогенной системе. Опыт 4. Зависимость скорость реакции от катализатора Налейте в химический стакан 10 мл 3% раствора Н2О2 и поднесите к поверхности тлеющую лучинку. Затем внесите в этот стакан небольшое количество MnO2 и поднесите вторично тлеющую лучину. Запишите наблюдения. Составьте уравнения реакций. Опыт 5. Влияние концентрации реагирующих веществ на химическое равновесие В химическом стакане смешайте по 10 мл очень разбавленных (0,001 М) растворов FeCl3 и KNCS. FeCl3 + 3KNCS = Fe(NCS)3 + 3KCl Полученный раствор разлейте поровну в четыре пробирки, затем добавьте в них следующие вещества по схеме: 1 пробирка: контроль 2 пробирка: + 2–3 капли 0,1 М раствор KNCS 3 пробирка: + 2–3 капли 0,1 М раствор FeCl3 4 пробирка: + несколько кристаллов KCl Сравните цвета жидкости в пробирках 2–4 с контролем. Наблюдения запишите в виде таблицы:
Контрольные задания 1. Назовите факторы, влияющие на скорость реакции в гомогенных системах. Правило Вант-Гоффа. 2. Как изменится скорость образования NO2 в соответствии с реакцией: 2NО + О2 = 2NO2, если давление в системе увеличить в 3 раза, а температуру оставить неизменной? 3. Скорость некоторой реакции увеличивается в 2 раза при повышении температуры на каждые 10° С в интервале от 0 до 60° С. Во сколько раз увеличится скорость при повышении температуры от 20 до 45° С? 4. Как повлияет на равновесие в реакциях: 1) 2NO2 2) 2H2S а) повышение температуры; б) понижение давления? 5. Как повлияет на равновесие в реакциях: 1) 2H2 + O2 2) N2 + O2 а) понижение температуры; б) повышение давления? | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
