Методичка+д\з по химии. Учебнометодическое пособие для практических занятий и самостоятельной работы студентов инженернотехнических направлений подготовки бакалавров всех форм обучения
 Скачать 3.51 Mb. Скачать 3.51 Mb.
|
1. Вопросы, которые необходимо изучить и уметь дать на них ответ:1.1. Что собой представляют углеводороды по химическому составу, на какие ряды по форме углеродной цепи они подразделяются. 1.2. Какие существуют гомологические ряды углеводородов; каковы названия, основоположники и общие формулы этих рядов (для углеводородов гомологические ряды совпадают с классами). 1.3. В чем заключаются принципиальные отличия в строении и свойствах - и -связей; как это согласуется с положениями теории химического строения Бутлерова о взаимосвязи строения и свойств веществ. Что представляет собой явление сопряжения в молекулах органических соединений, и в каких случаях оно возможно. 1.4. Какие типы реакций и почему характерны для алканов и циклоалканов (от С5 и выше), каковы их главные разновидности (определяемые по типу второго реагента). Почему алканы и высшие циклоалканы обладают сходными химическими свойствами. 1.5. Какие типы реакций и почему характерны для непредельных углеводородов, каковы их главные разновидности (определяемые по типу второго реагента). 1.6. Почему алкины проявляют свойства С-Н кислот, а алкены такими свойствами не обладают. 1.7. Какие типы реакций и почему характерны для ароматических колец бензола и его гомологов, каковы их главные разновидности (определяемые по типу второго реагента). Какие специальные условия необходимы для реакций присоединения по бензольному кольцу или его расщепления и почему. 1.8. Что собой представляет автоокисление углеводородов, по какому механизму проходит этот процесс, каков состав его промежуточных и конечных продуктов. 1.9. Какие конкретные химические реакции являются отличительными для углеводородов разных классов и могут быть использованы для их химической идентификации. 1.10. Уметь подтвердить ответы на п.п. 1.4-1.8 уравнениями соответствующих реакций. 2. Письменное задание для контроля усвоения темы:В таблице 3.54 приведены два исходных углеводорода различных классов, которые для углеводородов совпадают с их гомологическими рядами. Также приведен реагент, который может вступить в реакцию только с одним из данных углеводородов, и поэтому является реактивом именно на это соединение. Для данных в Вашем варианте углеводородов и реактива выполните следующие задания: 2.1. Приведите структурные формулы и названия исходных углеводородов и реактива, укажите класс реактива. Определите, к какому гомологическому ряду принадлежит каждый из данных Вам углеводородов. Дайте названия этих гомологических рядов и общие гомологические формулы; для каждого данного углеводорода приведите структурную формулу одного из его ближайших гомологов. 2.2. Во всех несимметричных молекулах данных веществ укажите направления смещения электронной плотности, символы и знаки электронных эффектов, возникающие частичные заряды на атомах. 2.3. Определите, какой из углеводородов вступит в реакцию с данным реактивом в указанных условиях, и объясните почему. 2.4. Укажите, какая связь в молекуле углеводорода будет разрываться в ходе его реакции с данным реактивом в указанных условиях, и как на ее разрыв влияют прочность связи и условия проведения процесса. 2.5. Напишите уравнение возможной химической реакции одного из данных углеводородов с данным реактивом (см. примечание). Укажите классы и названия образующихся продуктов. Укажите, имеется ли в этой реакции аналитический сигнал (изменение окраски, рН, степени дисперсности реакционной среды; образование нерастворимых или газообразных продуктов). Может ли эта реакция являться качественной для рассматриваемого класса углеводородов. 2.6. Если в реакцию по п. 2.5 вступает бензол или его гомолог, то объясните, каковы особенности строения и химических свойств его цикла и какова сущность понятий "сопряжение" и "ароматичность". 2.7. Определите, по какому механизму (радикальному или ионному) произойдет разрыв связи в молекулах реагирующих веществ и объясните почему. 2.8. Определите, к какой разновидности относится рассматриваемая реакция (замещение, обмен, присоединение, расщепление) и укажите, какими признаками это подтверждается. Рядом с уравнением реакции (справа) символически обозначьте ее механизм (SR, SE, SN, AR, AE, AN). 2.9. Изложите современную трактовку правила Марковникова для реакций присоединения и укажите, реализуется ли это правило в Вашей реакции и каким образом. Примечание: примите во внимание следующее: а) при ответе на п. 2.5 в реакции с алкинами используйте мольное соотношение углеводород : реактив = 1 : 1; б) молекулы большинства реактивов, данных в таблице 3.54, условно могут быть изображены формулами H-Y и A-X: 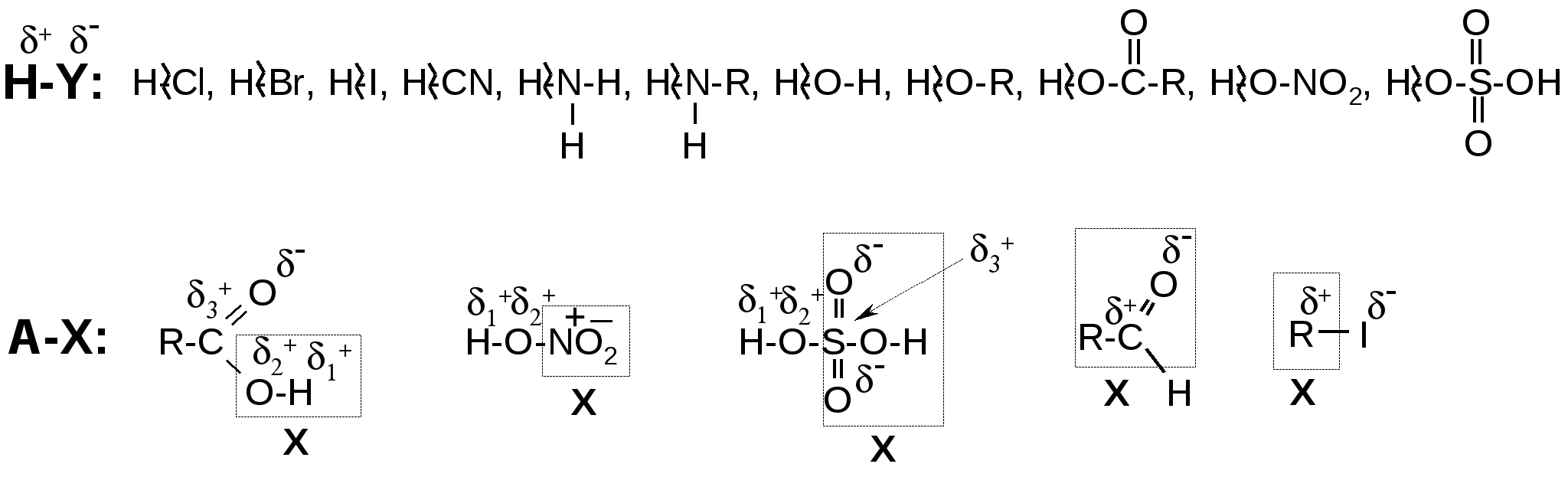 В формулах обозначены частичные заряды (, возникающие на атомах в результате их взаимного влияния в молекуле; в) в ходе реакций присоединения в молекуле реактива происходит разрыв связей H–Y, и в случаях ионного механизма образуются электрофил (Н+) и нуклеофил (Y-); г) в реакциях замещения происходит разрыв связи А–Х, и водород в молекуле исходного углеводорода замещается на фрагмент Х. Таблица 3.54
Продолжение таблицы 3.54
Задание 20. Химические свойства и идентификация производных углеводородов (по разделам стандартов: реакционная способность и химическая идентификация веществ (органических); связь химических свойств со структурой молекул; мономеры) Рекомендуемая литература: [1], гл. 29, § 29.9-29.17; [2], гл. 13, § 13.3; [4], гл. 13, § 3; лекции. |
