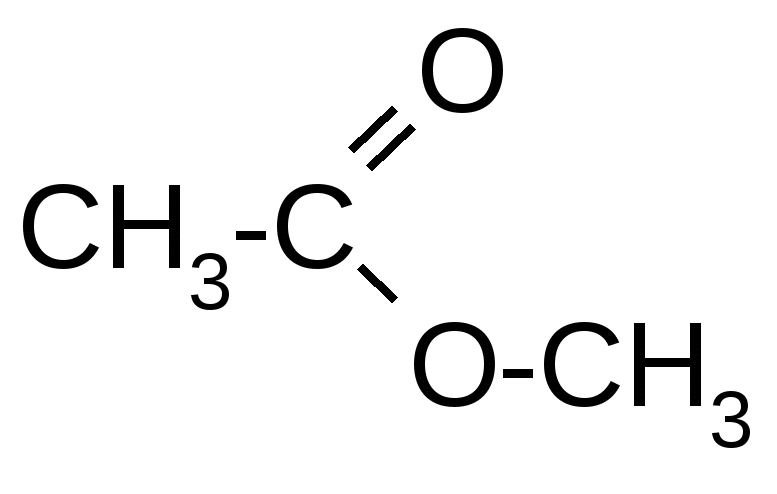Методичка+д\з по химии. Учебнометодическое пособие для практических занятий и самостоятельной работы студентов инженернотехнических направлений подготовки бакалавров всех форм обучения
 Скачать 3.51 Mb. Скачать 3.51 Mb.
|
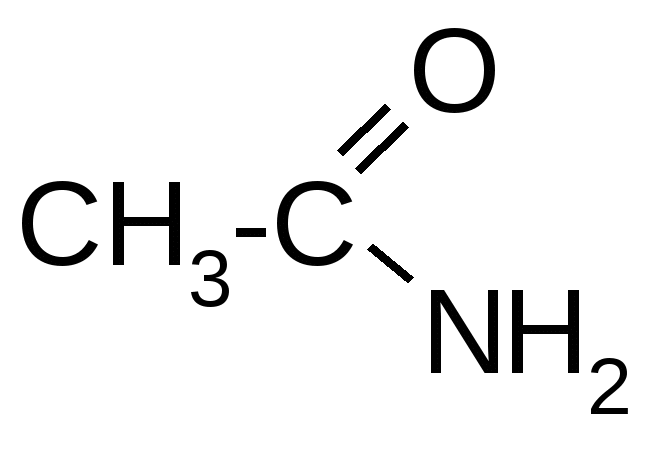
1. Вопросы, которые необходимо изучить и уметь дать на них ответ:1.1. Чем отличаются производные углеводородов от углеводородов. 1.2. Какие структурные факторы определяют химические свойства производных углеводородов. 1.3. Что собой представляют по строению галогенпроизводные, сульфо- и нитропроизводные, амины, спирты, фенолы, карбонильные соединения, карбоновые кислоты, амиды, галогенангидриды, простые и сложные эфиры. 1.4. Какие химические реакции характерны для каждого класса производных углеводородов, указанных в п. 1.3. 1.5. В чем заключаются особенности строения и химических свойств соединений со смешанными функциями (гидроксикислот, аминокислот, оксокислот, углеводов). 1.6. Какова формулировка положения теории Бутлерова о взаимном влиянии атомов в молекуле. 1.7. Что отражают электронные эффекты атомов в химическом строении молекулы, и когда возможно их возникновение. 1.8. Когда возникает и по каким химическим связям передается индуктивный эффект; как определяется и обозначается его направленность. 1.9. Что представляет собой явление -- и p--сопряжения в молекулах органических веществ (ответ уметь подтвердить схемой перекрывания соответствующих электронных орбиталей в сопряженных структурных фрагментах). 1.10. Когда возникает и по каким химическим связям передается взаимное влияние атомов в виде эффекта сопряжения (иначе – мезомерный эффект); как определяется и обозначается его направленность. 1.11. Какие механизмы разрыва химических связей возможны в молекулах органических соединений; как называются частицы, образующиеся при гомолитическом и гетеролитическом разрыве химической связи; что собой представляют реакции типов SE, SN, AE, AN. 1.12. Какие признаки химического строения и условия проведения реакции обусловливают тип механизма разрыва химической связи. 2. Письменное задание для контроля усвоения темы:В таблице 3.55 приведены молекулы производного углеводорода и двух других реагентов, один из которых может вступать в реакцию с данным производным углеводорода. Выполните следующие задания для своего варианта: 2.1. Определите классы и названия данного производного углеводорода и реагентов. 2.2. Во всех данных молекулах выявите и обозначьте, при их наличии, индуктивные и мезомерные эффекты заместителей стрелками и символами (соответственно +I или –I, +М или –М). Укажите частичные заряды, возникающие на атомах вследствие индуктивных эффектов (+ или -), или результирующие заряды при наличии и мезомерных эффектов (см. примечание). 2.3. Выберите один из двух реагентов, который может вступить в реакцию с данным производным углеводорода, и объясните, почему эта реакция возможна (см. примечание). 2.4. Напишите уравнение возможной реакции, укажите ее условия, классы и названия образующихся продуктов (см. примечание). 2.8. Определите, к какой разновидности относится рассматриваемая реакция (замещение, обмен, присоединение, расщепление) и укажите, какими признаками это подтверждается. Рядом с уравнением реакции (справа) символически обозначьте ее механизм (SR, SE, SN, AR, AE, AN) (см. примечание). Примечание: для ответов на п.п. 2.2-2.5 воспользуйтесь примечаниями "б", "в", "г" на с. 107. Таблица 3.55
Продолжение таблицы 3.55
Комплексное тестовое задание 14 по темам "Химические свойства и химическая идентификация углеводородов и производных углеводородов" Правильные ответы по п. А приведены в конце пособия в таблице 4.2. А. Для Вашего варианта из таблицы 3.56 выберите соединение (1, 2 или 3), с которым может реагировать данное в задании исходное вещество или которое может вступать в реакцию указанного типа. Б. Обоснуйте свой ответ, сопроводив его необходимыми объяснениями. Напишите уравнение реакции между заданным веществом и выбранным реагентом или схему полимеризации (где это требуется). Укажите условия и тип этой реакции, является ли она качественной и как проявляется аналитический сигнал. Определите в ней классы и названия реагентов (исходных веществ) и продуктов (образующихся веществ). Таблица 3.56 – Тестовое задание 27 (Т-27)
Продолжение таблицы 3.56
Задание 21. Полимеры (по разделам стандартов: полимеры и олигомеры) Рекомендуемая литература: [2], гл. 14; [4], гл. 13, §4; лекции. 1. Вопросы, которые необходимо изучить и уметь дать на них ответ: 1.1. Что представляют собой мономер, олигомер, высокомолекулярное соединение, полимер, элементарное звено в полимере. 1.2. Каков основной признак строения молекул полимеров, отличающий их от других химических соединений. 1.3. Что представляют собой понятие "степень полимеризации" и математическое выражение для ее расчета. 1.4. В чем состоит основное различие между природными, синтетическими и искусственными полимерами. 1.5. Как могут различаться полимеры по составу элементарных звеньев и по пространственному строению их макромолекул. 1.6. Какие существуют различия в физических свойствах полимеров, и как они связаны с их строением. 1.7. Что представляют собой два типа реакций, лежащих в основе образования полимерных соединений, и как они называются. 1.8. Каковы отличительные признаки строения мономеров, способных вступать в реакции полимеризации и реакции поликонденсации, и какие структурные фрагменты их молекул участвуют в этих реакциях. 1.9. В чем заключается принципиальное различие в составе продуктов реакций полимеризации и поликонденсации. 1.10. Каковы основные классы полимеров в зависимости от химического строения полимерной цепи и их важнейшие представители. 1.11. Каковы области применения полимеров различныхклассов и различного пространственного строения. 1.12. Какие материалы называют пластическими массами, каков их возможный состав. Что представляет собой процесс "старения" полимеров и пластмасс и к чему он приводит. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||