РАХИТ. НАРУШЕНИЯ ФОСФОРНО-КАЛЬЦИЕВОГО ОБМЕНА У ДЕТЕЙ. УЧЕБНО-МЕТОДИЧЕС. РАХИТ. НАРУШЕНИЯ ФОСФОРНО-КАЛЬЦИЕВОГО ОБМЕНА У ДЕТЕЙ. УЧЕБНО-МЕТ. Учебнометодическое пособие для студентов педиатрических факультетов, интернов, ординаторов и врачей педиатров
 Скачать 216.79 Kb. Скачать 216.79 Kb.
|
|
МиНИСТЕРСВО ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ РФ Кафедра педиатрии Учебно-методическое пособие для студентов педиатрических факультетов, интернов, ординаторов и врачей педиатров. Нарушения фосфорно-кальциевого обмена у детей раннего возраста В раннем детском возрасте (особенно на первом году жизни) заболевания (или состояния), связанные с нарушением фосфорно-кальциевого обмена, занимают ведущее место. Это обусловлено чрезвычайно высокими темпами развития ребенка: за первые 12 месяцев жизни масса тела увеличивается в среднем в 3 раза, длина – в 1,5. Такое интенсивное увеличение размеров тела очень часто сопровождается абсолютным или относительным дефицитом кальция и фосфора в организме. К развитию кальций- и фосфопенических состояний приводят разнообразные факторы: дефицит витаминов (главным образом витамина D), нарушения метаболизма витамина D в связи с незрелостью ряда ферментных систем, снижение абсорбции фосфора и кальция в кишечнике, а также реабсорбции их в почках, нарушения эндокринной системы, регулирующей фосфорно-кальциевый обмен, отклонения в микроэлементном статусе и многое другое. Существенно реже встречаются гиперкальциемические состояния. Они носят, как правило, ятрогенный характер, но представляют не меньшую угрозу организму, чем гипокальциемии. Три узловых момента определяют фосфорно-кальциевый метаболизм в организме:
Основным показателем, характеризующим метаболизм Ca, является его уровень в крови, который в норме составляет 2,3–2,8 ммоль/л (содержание P в крови – 1,3–2,3 ммоль/л). Все факторы, ухудшающие всасывание кальция в кишечнике и снижающие реабсорбцию его в почках, вызывают гипокальциемию, которая может частично компенсироваться вымыванием Ca из костей в кровь, что приводит к развитию остеомаляции или остеопорозов. Избыточное всасывание Ca в кишечнике приводит к гиперкальциемии, которая компенсируется за счет усиленного отложения его в кости (зоны роста) и выведения с мочой. Неспособность организма удержать нормальный уровень Ca крови вызывает либо тяжелые гипокальциемические состояния с проявлениями тетании, либо приводит к гиперкальциемии с картиной токсикоза, отложением Ca в различных тканях и органах. Суточная потребность в кальции детей грудного возраста равна 50 мг на 1 кг массы, т.е. ребенок во втором полугодии жизни должен получать около 500 мг. Важнейшим источником его являются молочные продукты: в 100 мл женского молока содержится 30 мг Ca, в таком же количестве коровьего – 120 мг. Всасывание кальция в кишечнике зависит не только от количества в пище, но и от его растворимости, соотношения с фосфором (оптимальное 2:1), присутствия желчных солей, уровня pH (чем более выражена щелочная реакция, тем хуже всасывание). Большое содержание в пище фитина (манная каша) и щавелевой кислоты снижает всасывание, за счет образования плохо растворимых соединений, цитраты улучшают всасывание. Важное значение имеет состояние слизистой оболочки тонкой кишки: синдромы мальабсорбции, энтериты сопровождаются ухудшением всасывания. Главным регулятором всасывания Ca является витамин D. Основная масса (более 90%) кальция и 70% фосфора находится в костях в виде неорганических солей. В течение всей жизни костная ткань находится в постоянном процессе созидания и разрушения, обусловленном взаимодействием трех типов клеток: остеобластов, остеоцитов и остеокластов. Кости активно участвуют в регуляции метаболизма Ca и P, поддерживая их стабильный уровень в крови. При снижении уровня кальция и фосфора крови (произведение Ca x P является постоянной величиной и равно 4,5-5,0) развивается резорбция кости за счет активации действия остеокластов, что увеличивает поступление в кровь этих ионов; при повышении данного коэффициента происходит избыточное отложение солей в кости. Половина содержащегося в крови Ca связана с белками плазмы (главным образом с альбумином), из оставшейся части более 80% это ионизированный кальций, способный проходить через стенку капилляра в интерстициальную жидкость. Именно он является регулятором разнообразных внутриклеточных процессов, в том числе проведение специфического трансмембранного сигнала в клетку, поддержание определенного уровня нервно-мышечной возбудимости. Связанный с белками плазмы Ca является резервом для сохранения необходимого уровня ионизированного кальция. Выделение Ca и P почками идет параллельно содержанию их в крови. При нормальном содержании кальция его выделение с мочой незначительное и составляет около 2 мг/кг в сутки, при гипокальциемии это количество резко уменьшается, гиперкальциемия увеличивает содержание Ca в моче до 12 мг/кг в сутки. При различных наследственных (фосфат-диабет, болезнь де Тони-Дебре-Фанкони, почечный тубулярный ацидоз, гипофосфатазия) и приобретенных нефропатиях, хронической почечной недостаточности нередко отмечаются нарушения фосфорно-кальциевого обмена, чаще всего с гипофосфатемией и гипокальциемией. Основными регуляторами фосфорно-кальциевого обмена наряду с витамином D являются паратиреоидный гормон (ПГ) и кальцитонин (КТ) – гормон щитовидной железы. Под названием “витамин D” понимают группу веществ (около 10), содержащихся в продуктах растительного и животного происхождения, обладающих влиянием на фосфорно-кальциевый обмен. Наиболее активными из них являются эргокальциферол (витамин D2) и холекальциферол (витамин D3). Эргокальциферол в небольших количествах содержится в растительном масле, ростках пшеницы; холекальциферол – в рыбьем жире, молоке, сливочном масле, яйцах. Физиологическая суточная потребность в витамине D величина достаточно стабильная и составляет 400-500 МЕ. В период беременности и кормления грудным молоком она возрастает в 1,5, максимум в 2 раза. Нормальное обеспечение организма витамином D связано не только с поступлением его с пищей, но и с образованием в коже под влиянием УФ-лучей с длиной волны 280-310 ммк. При этом из эргостерола (предшественник витамина D2) образуется эргокальциферол, а из 7-дегидрохолестерола (предшественник витамина D3) – холекальциферол. При достаточной инсоляции (по некоторым данным достаточно 10-минутного облучения кистей рук) в коже синтезируется необходимое организму количество витамина D. При недостаточной естественной инсоляции: климатогеографические особенности, условия проживания (сельская местность или промышленный город), бытовые факторы, время года и др. недостающее количество витамина D должно поступать с пищей или в виде лекарственных препаратов. У беременных женщин витамин D откладывается в виде депо в плаценте, что обеспечивает новорожденного некоторое время после рождения антирахитическими веществами. Витамины D2 и D3 обладают очень малой биологической активностью. Физиологическое действие на органы-мишени (кишечник, кости, почки) осуществляется их метаболитами, образующимися в печени и почках в результате ферментативного гидроксилирования. В печени под влиянием гидроксилазы образуется 25- гидроксихолекальциферол 25(OH)D3-кальцидиерол. В почках в результате еще одного гидроксилирования синтезируется дигидроксихолекальциферол – 1,25-(OH)2D3-кальцитриерол, являющийся наиболее активным метаболитом витамина D. Содержание 25(OH)D3 в крови в норме колеблется от 10 до 30 нг/мл (по данным некоторых авторов до 100 нг/мл). Избыток его накапливается в мышечной и жировой тканях. Содержание витамина D в женском молоке составляет 2,0-4,0 мг/100 мл. Данных по содержанию 25(OH)D3 в молоке в доступной нам литературе не имеется. Кроме этих двух основных метаболитов в организме синтезируются другие соединения витамина D3 – 24,25(OH)2D3, 25,26(OH)2D3, 21,25(OH)2D3, действие которых изучено недостаточно. Основная физиологическая функция витамина D (т.е. его активных метаболитов) в организме – регуляция и поддержание на необходимом уровне фосфорно-кальциевого гомеостаза организма. Это обеспечивается путем влияния на всасывание кальция в кишечнике, отложение его солей в костях (минерализация костей) и реабсорбцию кальция и фосфора в почечных канальцах. Механизм всасывания кальция в кишечнике связан с синтезом энтероцитами кальций-связывающего белка (СаСБ), одна молекула которого транспортирует 4 атома кальция. Синтез СаСБ индуцируется кальцитриолом через генетический аппарат клеток, т.е. по механизму действия 1,25(OH)2D3 аналогичен гормонам. В условиях гипокальциемии витамин D временно увеличивает резорбцию костной ткани, усиливает всасывание Ca в кишечнике и реабсорбцию его в почках, повышая тем самым уровень кальция в крови. При нормокальциемии он активирует деятельность остеобластов, снижает резорбцию кости и ее кортикальную порозность. В последние годы показано, что клетки многих органов имеют рецепторы к кальцитриолу, который тем самым участвует в универсальной регуляции ферментных внутриклеточных систем. Активация соответствующих рецепторов через аденилатциклазу и цАМФ мобилизует Ca и его связь с белком-кальмодулином, что способствует передаче сигнала и усиливает функцию клетки, и соответственно, всего органа. Витамин D стимулирует реакцию пируват-цитрат в цикле Кребса, обладает иммуномодулирующим действием, регулирует уровень секреции тиреотропного гормона гипофиза, прямо или опосредованно (через кальциемию) влияет на выработку инсулина поджелудочной железой. Вторым важнейшим регулятором фосфорно-кальциевого обмена является паратгормон. Продукция данного гормона паращитовидными железами усиливается при наличии гипокальциемии, и, особенно, при снижении в плазме и внеклеточной жидкости концентрации ионизированного кальция. Основными органами-мишенями для паратгормона являются почки, кости и в меньшей степени желудочно-кишечный тракт. Действие паратгормона на почки проявляется увеличением реабсорбции кальция и магния. Одновременно снижается реабсорбция фосфора, что приводит к гиперфосфатурии и гипофосфатемии. Считается также, что паратгормон повышает способность образования в почках кальцитриола, усиливая тем самым абсорбцию кальция в кишечнике. В костной ткани под влиянием паратгормона кальций костных апатитов переходит в растворимую форму, благодаря чему происходит его мобилизация и выход в кровь, сопровождающаяся развитием остеомаляции и даже остеопороза. Таким образом, паратгормон является основным кальцийсберегающим гормоном. Он осуществляет быструю регуляцию гомеостаза кальция, постоянная регуляция – функция витамина D и его метаболитов. Образование ПГ стимулируется гипокальциемией, при высоком уровне Ca в крови его продукция уменьшается. Третьим регулятором кальциевого обмена является кальцитонин – гормон, вырабатываемый С-клетками парафолликулярного аппарата щитовидной железы. По действию на гомеостаз кальция он является антагонистом паратгормона. Его секреция усиливается при повышении уровня кальция в крови и уменьшается при понижении. Диета с большим количеством кальция в пище также стимулирует секрецию кальцитонина. Этот эффект опосредуется глюкагоном, который таким образом является биохимическим активатором выработки КТ. Кальцитонин защищает организм от гиперкальциемических состояний, снижает количество и активность остеокластов, уменьшая рассасывание костей, усиливает отложение Ca в кости, предотвращая развитие остеомаляции и остеопороза, активирует выведение его с мочой. Предполагается возможность ингибирующего влияния КТ на образование в почках кальцитриола. На фосфорно-кальциевый гомеостаз, кроме трех выше описанных (витамин D, паратгормон, кальцитонин), оказывает влияние множество других факторов. Микроэлементы Mg, Al являются конкурентами Ca в процессе всасывания; Ba, Pb, Sr и Si могут замещать его в солях, находящихся в костной ткани; гормоны щитовидной железы, соматотропный гормон, андрогены активируют отложение кальция в кости, снижают его содержание в крови, глюкокортикоиды способствуют развитию остеопороза и вымыванию Ca в кровь; витамин А является антагонистом витамина D в процессе всасывания в кишечнике. Однако патогенное влияние этих и многих других факторов на фосфорно-кальциевый гомеостаз проявляется, как правило, при значительных отклонениях содержания этих веществ в организме. Регуляции фосфорно-кальциевого обмена в организме представлена на рис 1. 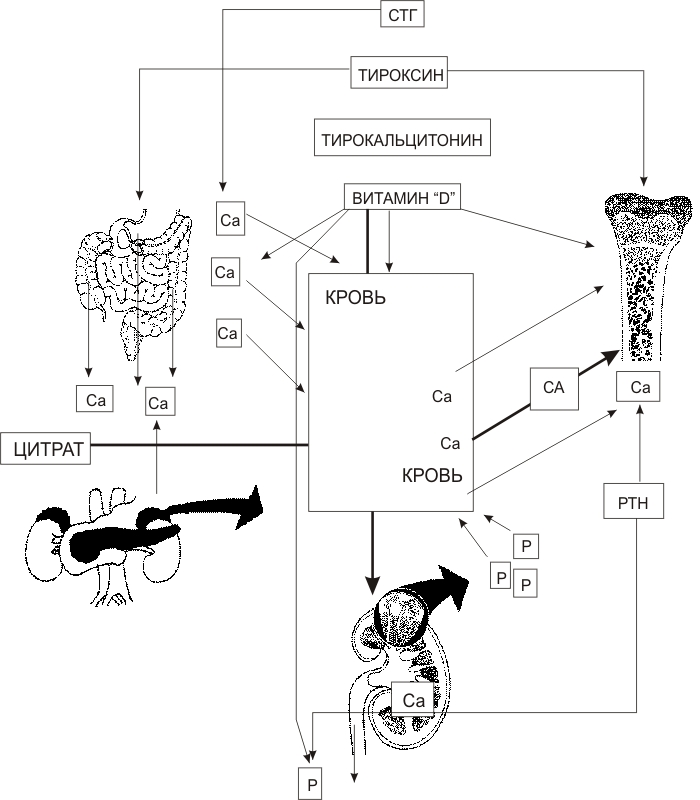 Рис. 1. Схема регуляции фосфорно-кальциевого обмена в организме Нарушения фосфорно-кальциевого обмена у детей раннего возраста чаще всего проявляются гипокальциемиями различного происхождения с клиническими проявлениями со стороны костно-мышечной системы. Наиболее частыми заболеваниями являются рахит и спазмофилия (гипокальциемическая тетания). Гиперкальциемии встречаются реже и носят чаще всего ятрогенный (гипервитаминоз D) характер. Причиной гипокальциемии может быть дефицит витамина D и нарушения его метаболизма, обусловленные временной незрелостью ферментных систем органов (почки, печень), регулирующих этот процесс. Реже встречаются первичные генетически детерминированные заболевания почек, желудочно-кишечного тракта, паращитовидных желез, костной системы, сопровождающиеся нарушениями фосфорно-кальциевого гомеостаза со сходной клинической картиной. Самым частым заболеванием, связанным с нарушением фосфорно-кальциевого гомеостаза, у детей 1-го года жизни является рахит. В Международной классификации болезней 10-го пересмотра (МКБ-10) это заболевание включено в раздел болезней эндокринной системы и обмена веществ (шифр Е55.0). При этом не отрицается значение гиповитаминоза D в его развитии. Некоторые дискуссионные вопросы в проблеме рахита. 1. Распространенность рахита. Большинство литературных данных указывает на частоту от 20 до 65% у детей 1-го года в зависимости от климатогеографических условий. В развитых странах (США, Япония), в которых широко осуществляется витаминизация продуктов питания, считают, что проблема рахита решена. Однако эта точка зрения ошибочна. Улучшение условий жизни, выполнение врачебных рекомендаций по воспитанию ребенка, а также обогащение продуктов питания витамином D привели к значительному уменьшению частоты тяжелых и средне тяжелых форм рахита. Частота же легких его форм остается очень высокой. Опытный врач-педиатр практически у каждого 3-4х месячного младенца найдет 2-3 не резко выраженных симптома рахита. В связи с этим следует признать, что, либо рахит встречается практически у 100% детей, либо - рахит легкой (I-ой) степени следует рассматривать не как заболевание, а как парафизиологическое состояние (по типу конъюгационной желтухи новорожденных), самостоятельно ликвидирующееся по мере созревания организма. Признание такой точки зрения позволяет согласиться с цифрами 25-55% распространенности рахита. Частота рахита в последние годы в России колеблется от 54 до 66% (Н.А. Коровина с соавт., 1998). Положение о том, что первая степень рахита соответствует начальному периоду болезни, не противоречит выше приведенной точке зрения. 2. Врожденный рахит. Вряд ли можно согласиться с существованием врожденного рахита. Действительно у небольшой части новорожденных (недоношенных, незрелых), развивавшихся в условиях патологического течения беременности, нарушений питания беременной, приеме некоторых лекарств во время беременности (антиконвульсанты, гормоны), алкоголя, курения табака и др. могут быть симптомы поражения костной системы, главным образом в виде остеомаляции. Их, однако, следует рассматривать как проявление незрелости всех систем (в том числе костной) организма. У таких детей гипофосфатемия бывает редко, а гипокальциемия при правильном ведении после родов быстро ликвидируется, но симптомы остеомаляции сохраняются долго и исчезают соответственно темпам созревания организма. Вряд ли целесообразно относить к врожденному рахиту такие заболевания как фосфат-диабет, почечный канальцевый ацидоз, болезнь де Тони-Дебре-Фанкони, которые проявляются в более старшем возрасте и имеют в своей основе генетический дефект, характеризующийся нарушением регуляции почками многих видов обмена (а не только фосфорно-кальциевого) веществ. Это тубулопатии – рахитоподобные заболевания. К ним же следует отнести и описывавшийся ранее поздний рахит. 3. Рецидивирующее течение. В настоящее время встречается крайне редко. Трудно себе представить, чтобы ребенок с диагностированным рахитом средней тяжести, получающий адекватную неспецифическую и специфическую терапию вновь попадает в неблагоприятные условия жизни. Ребенок в возрасте после 8-9 месяцев жизни рационально вскармливаемый, активно двигающийся, много гуляющий на свежем воздухе никогда не даст рецидива рахита. При этом достаточно профилактической (400 МЕ в сутки) дозы витамина D, синтезирующегося кожей или поступающего с пищей. 4. Классификация рахита у детей (В.И. Струков, 1999). Практически в 100% случаях рахит развивается вследствие сочетания эндогенных и экзогенных факторов. Вряд ли целесообразно выделение в качестве самостоятельного алиментарно-зависимого рахита, который по сути является дефицитным (в том числе дефицит витамина D), и гипоксического рахита, так как внутриутробная гипоксия является причиной незрелости организма (в том числе костно-мышечной системы) с соответствующими проявлениями (см. врожденный рахит). 5. Клинические варианты рахита. Вряд ли целесообразно выделение кальцийпенического, фосфопенического вариантов и рахита без изменения концентрации кальция и фосфора в крови (Е.М. Лукьянова, 1990). Следует говорить либо о стадийности биохимических изменений, либо о преобладании снижения того или иного элемента. Довольно распространенной врачебной ошибкой при диагностике рахита является абсолютизация одного из симптомов. Несвоевременное и неправильное прорезывание зубов, закрытие большого родничка при отсутствии других симптомов часто трактуется как рахит. К остаточным явлениям рахита, как правило, относят «О»-образное искривление голеней у детей 2-3 летнего возраста. При этом упускаются из виду наследственные, генетические особенности развития костной системы. Роль наследственного фактора хорошо показана в диссертации З.А. Станкевич (1972), изучавшей фосфорно-кальциевый обмен у детей и выявившей существенную разницу его у моно- и дизиготных близнецов. Остеопороз – снижение костной массы и нарушение структуры костной ткани – может быть связан не только с рахитом, но и с другими факторами. Причинами остеопороза являются: эндокринно-метаболические нарушения; нарушения питания и пищеварения; применение ряда лекарственных препаратов (гормоны, противосудорожные, антациды, гепарин); генетические факторы (несовершенный остеогенез, синдром Марфана, гомоцистинурия); длительная иммобилизация; злокачественные опухоли; хроническая почечная недостаточность. В этих случаях диагноз рахита неправомерен, несмотря на клиническую схожесть. Довольно частым заболеванием у детей раннего возраста, связанным с нарушением фосфорно-кальциевого гомеостаза, является спазмофилия – гипокальциемическая тетания. Она проявляется приступами локальных или генерализованных тонических судорог (явная форма) либо повышенной нервно-мышечной возбудимостью (скрытая, латентная форма). Причины гипокальциемий разнообразны. Наиболее частыми являются: дефицит витамина D, гипопаратиреоз, повреждения паращитовидных желез, избыточная секреция кальцитонина, синдром мальабсорбции, хроническая почечная недостаточность, эндокринопатии, избыточное поступление в организм фосфора, применение некоторых лекарственных препаратов (фенобарбитал, глюкагон, дифенин, слабительные, антациды). Важнейшим биохимическим фактором развития гипокальциемической тетании является снижение фракции ионизированного кальция (уровень общего Ca ниже 2,2 ммоль/л, ионизированного – 1,0 ммоль/л). При этом уровне ионизированного кальция снижается порог возбудимости в нейромышечных и межнейрональных синапсах. Развитию гипокальциемической тетании способствует алкалоз; сходную клинику вызывает гипомагниемия (по некоторым данным может быть сочетание низких уровней кальция и магния крови). Клинические проявления спазмофилии описаны в учебниках: судороги (карпопедальный спазм), ларингоспазм, эклампсия. Диагностика скрытой формы основывается на выявлении симптомов повышения нервно-мышечной возбудимости (симптомы Хвостека, Труссо, Люста, Маслова, Эрба). Тяжелыми состояниями, нередко оставляющими необратимые последствия или заканчивающимися даже смертельным исходом, являются гиперкальциемии. Причиной их развития практически в 100% случаев является передозировка витамина D. В настоящее время благодаря пересмотру подходов к профилактике и лечению рахита подобные заболевания у детей встречаются редко. Однако до сих пор не только в медицинской литературе, но и в немедицинских средствах массовой информации появляются сообщения об отравлениях населения витамином D при использовании спиртового или масляного его растворов в качестве обычного алкоголя либо пищевого масла. В 50-х- 70-х годах ХХ века гипервитаминоз D представлял важную педиатрическую проблему. Дебре и Бриссо в 1949 году сообщили о 85 случаях тяжелого течения данного заболевания. В.А. Власов и В.К. Столярова в 1957 году наблюдали 10 детей с данной патологией. Через грудное отделение больницы им. Н.Ф. Филатова в период с 1957 по 1970 гг. прошло 98 таких детей, а только за 8 месяцев (сентябрь 1971 – апрель 1972 г.) – 30 больных гипервитаминозом D. Несколько случаев закончились летальным исходом. В 1972 году сотрудником кафедры госпитальной педиатрии В.В. Шицковой изданы методические рекомендации по гипервитаминозу D, защищена кандидатская диссертация, посвященная состоянию почек при этом заболевании. Передозировка витамина D оказывает на организм ребенка, как прямое токсическое действие, так и опосредованное - через нарушение фосфорно-кальциевого гомеостаза и развитие гиперкальциемии. Прямое токсическое действие витамина D проявляется в нарушении цикла Кребса с повышением в крови лимонной кислоты, в активации процессов перекисного окисления с нарушением клеточных мембран. Избыток витамина D депонируется в печени, оказывая токсическое действие на ее паренхиму и приводя к жировой дегенерации. Гиперкальциемия при его передозировке проявляется нарушением функции клеток различных органов с картиной токсикоза, а также метастатической кальцификацией тканей и органов. Кальций откладывается в стенках сосудов; особенно сильно страдают печень и почки (нефрокальциноз, нефролитиаз). Выраженная клиническая картина гипервитаминоза D отмечается при приеме суммарной его дозы более 1 млн. МЕ, при сочетании приема витамина D с УФО или рыбьим жиром, а также с большими дозами кальция в летнее время, у детей на искусственном вскармливании. Большое значение имеет длительность приема выше названной дозы (существовавший ранее ударный метод лечения рахита). Повышенная чувствительность к витамину D отмечается у детей, матери которых получали его во время беременности. Описаны случаи повышенной индивидуальной чувствительности. Клинически гипервитаминоз D проявляется картиной острого токсикоза или хронической интоксикации. Это зависит от возраста ребенка, длительности введения витамина D. Острый токсикоз чаще развивается у детей первого полугодия жизни, приеме больших доз витамина D за короткий промежуток времени. Во втором полугодии, при длительном приеме небольших доз витамина D развивается хроническая интоксикация. Основные симптомы: анорексия, гипотрофия, астения, тошнота, рвота, задержка развития, запоры, полиурия, полидипсия, обезвоживание; могут быть судороги. Поражение нервной системы – от легкой заторможенности до тяжелых коматозных состояний. Выделяется три степени гиперкальциемии: Первая степень – уровень Ca в крови стабильно на верхней границе, интенсивное выделение его с мочой (реакция Сулковича ++), в клинической картине умеренные проявления токсикоза, полиурия, полидипсия, снижение веса. Вторая степень – уровень Ca в крови выше нормы, но не превышает 12 мг%, с мочой выделяется много (реакция Сулковича +++ или ++++), в клинической картине выраженные явления токсикоза, полиурия, дистрофия. Третья степень – уровень Ca в крови более 12 мг%, тяжелый токсикоз и обязательное поражение почек. Поражение сердечно-сосудистой системы: от небольших функциональных нарушений до тяжелого миокардита с развитием недостаточности кровообращения. На ЭКГ расширение комплекса QRS, удлинение интервала PQ, сглаженность зубцов P и T в V1 и V2; описаны случаи нарушения атриовентрикулярной проводимости; может быть ЭКГ картина инфаркта миокарда. Как правило, при гипервитаминозе D отмечается повышенное артериальное давление. Поражение печени: может быть повышена активность сывороточных трансаминаз, диспротеинемия, повышение в крови холестерола, снижение альфа- и повышение бета- липопротеидов; могут быть патологические типы гликемических кривых. Поражение почек: от небольших дизурических явлений до острой почечной недостаточности; лейкоцитурия, незначительная гематурия и протеинурия; часто вторичное присоединение инфекции и развитие пиелонефрита; нефрокальциноз; оксалатно-кальциевый уролитиаз. В далеко зашедших случаях - хроническая почечная недостаточность. Поражение органов дыхания, желудочно-кишечного тракта встречаются редко. Диагностика гипервитаминоза D: гиперкальциурия, гиперкальциемия; могут быть гипофосфатемия и гиперфосфатурия; ацидоз. На рентгенограммах костей расширение и уплотнение зон препараторного обызвестления. Последствиями гипервитаминоза D часто являются нефропатии: хронический пиелонефрит, интерстициальный нефрит, тубулопатии. В последние годы гипервитаминоз D встречается редко, так как кардинально изменены подходы к профилактике и лечению рахита. В настоящее время акценты перенесены на неспецифические методы борьбы с этим заболеванием. Неуверенно, с большой осторожностью врачебное общество соглашается с той истиной, что на протяжении тысячелетий (до 1922 года, когда был открыт и получен витамин D) человечество не имело возможности использовать этот препарат в чистом виде. Большая частота и тяжесть рахита в далеком прошлом обуславливалась не отсутствием препарата – витамина D, а социально-бытовыми условиями, национальными обычаями, особенностями питания наших предков. Именно изменение этих факторов в лучшую сторону, а не только применение витамина D повлияло на частоту распространения и тяжесть этого заболевания. В настоящее время неспецифическая антенатальная профилактика рахита заключается в создании беременной женщине оптимальных условий для роста и развития плода: рациональное питание с достаточным поступлением не только белков, жиров, углеводов, но и микро- и макроэлементов (в том числе кальция и фосфора), витаминов (в том числе витамина D); запрещение беременной принимать токсические (особенно для плода) вещества – табак, алкоголь, наркотики; исключение возможностей контактов беременной с другими токсическими веществами – химические, лекарства, пестициды и пр. Беременная женщина должна вести физически активный образ жизни, максимально возможно (не менее 4-5 часов в сутки) быть на свежем воздухе, соблюдать режим дня с достаточным отдыхом днем и ночью. В этом случае нет необходимости дополнительного назначения беременной витамина D. Антенатальная специфическая профилактика рахита путем назначения 1000 МЕ витамина D в сутки в течение последних 2-х месяцев беременности показана только беременным из неудовлетворительных социальных условий, из групп риска (больные нефропатиями, сахарным диабетом, ревматизмом, гипертонической болезнью), с проявлениями остеопений, остеопороза. В северных районах вместо препаратов витамина D рекомендуется проведение одного-двух курсов УФО. Постнатальная неспецифическая профилактика рахита включает в себя: естественное вскармливание; своевременное введение прикорма (лучше начинать с овощного пюре), соков; ежедневное пребывание на свежем воздухе, свободное пеленание, массаж, гимнастика, световоздушные и гигиенические ванны. Постнатальная специфическая профилактика рахита проводится детям только в период поздняя осень – ранняя весна в дозе 400-500 МЕ в сутки, начиная с 4-х недельного возраста. Дополнительное введение витамина D на 2-м году жизни нецелесообразно. Смеси, используемые при искусственном вскармливании, содержат все необходимые витамины и микроэлементы в физиологических дозах, в связи с чем нет необходимости в дополнительном введении витамина D. Увеличение профилактической дозы витамина D до 1000 МЕ в сутки возможно только детям из группы риска по развитию рахита (недоношенные, незрелые, маловесные, со сниженной двигательной активностью, из двоен, часто болеющие, с синдромами нарушения кишечного всасывания). В этих случаях целесообразно осуществлять контроль за уровнем кальция в организме по его выделению с мочой (реакция Сулковича). Нарастающая кальциурия является категорическим показанием к уменьшению дозы или даже отмене дополнительного введения витамина D. В настоящее время практически все педиатры согласились, что специфическое лечение рахита целесообразно проводить малыми лечебными дозами витамина D. Суточная доза при I-II степени при этом составляет 1500-2000 МЕ, курс – 100000–150000 МЕ; при II-III степени – 3000-4000 МЕ, курс 200000-400000 МЕ. Это лечение проводится в период разгара, подтвержденного биохимическими данными (снижение в крови кальция и фосфора, повышение щелочной фосфатазы). По окончании курса при необходимости целесообразно перейти на профилактическую (физиологическую) дозу. Рекомендованные в прошлом ударный, полуударный методы, повторные лечебные курсы в настоящее время не используются. При проведении специфической терапии мы рекомендуем осуществлять контроль за уровнем Ca в крови путем регулярной (1 раз в 10-14 дней) постановки реакции Сулковича (степень кальциурии). Вызывает сомнение целесообразность проведения профилактики или лечения рахита разовым введением ударной дозы (200000-400000 МЕ) холекальциферола (BON D3) в виду возможности токсического действия препарата и возникновения гиперкальциемии. Наиболее удобным для лечения и профилактики рахита в настоящее время является водо-растворимый витамин D3 (TERPOL, Польша), содержащий в одной капле 500 МЕ витамина D. Необходимость неспецифической терапии методами, описанными в учебниках и методических пособиях, не вызывает сомнения. Лечение гипокальциемических состояний (спазмофилия) требует введения препаратов кальция (в том числе внутривенно); для увеличения уровня ионизированного кальция вводят изотонический раствор NaCl внутривенно; хлористый аммоний, цитратная смесь внутрь. На высоте судорожного синдрома показано назначение противосудорожных и седативных препаратов (седуксен, ГОМК, дроперидол). Лечение гиперкальциемических состояний заключается в отмене витамина D и препаратов кальция, ограничение в питании высококальциевых продуктов, назначение фитина для уменьшения всасывания Ca в кишечнике. Показано обильное введение жидкости (внутрь, внутривенно). При выраженной гиперкальциемии назначают препараты кальцитонина, наиболее популярным из которых считается синтетический кальцитонин лосося – миакальцик. По показаниям могут быть назначены стероидные гормоны, гипотензивные средства. Спектр лекарственных препаратов, влияющих на фосфорно-кальциевый обмен, в последние годы значительно расширился. В приводимых ниже таблицах представлены как препараты, содержащие Ca, так и другие вещества, влияющие на обмен данного элемента и костную ткань. Таблица 1. Содержание Ca в некоторых лекарственных препаратах.
Широко используется карбонат, содержащий 40% чистого Ca. Наилучшее всасывание (биодоступность) Ca в цитратных и фосфатных солях. Таблица 2. Современные кальций-содержащие препараты.
В данной таблице представлены импортные препараты, содержащие карбонат Ca, и комплексные препараты Ca с другими веществами (витамины, микроэлементы) Таблица 3. Препараты, влияющие на фосфорно-кальциевый обмен. Препараты витамина Д.
Гормоны
Бисфосфанаты
Флавоноиды
Фториды.
Фосфаты
Из представленных в таблице витаминов Д в настоящее время предпочтение отдается водным растворам, практически не используются спиртовые. Альфа-кальцидиол, кальцитриол, рокальтрол, альфа Д3 – эти препараты, являющиеся активными метаболитами витамина Д3. Кальцитонины: кальцитар (свиной), елкатонин (из угря), цитакальцик (синтетический, человеческий) – снижают резорбцию кости, стимулируют остеогенез. Анаболические стероиды, факторы роста – активируют метаболизм, стимулируют остеогенез. Бисфосфанаты – снижают резорбцию кости, ингибируют апоптоз. Флавониоды – снижают резорбцию, активируют остеогенез. В настоящее время детям не рекомендуется в связи с возможным токсическим действием. Фториды – стимулируют остеогенез. Фосфаты – применяются при гипофосфатемии, выраженной фосфатурии. Таблица 4. Влияние на ремодуляцию кости.
В настоящее время большой практический интерес представляют биологические добавки к пище (БАД), которые успешно используются для профилактики различных заболеваний и реабилитации. Однако необходимы специальные научные исследования, соответствующие клинические испытания, которые позволят более широко и обоснованно использовать БАД. В таблице 5 представлены некоторые отечественные и зарубежные БАДы, предназначенные для коррекции нарушений кальциевого обмена. Таблица 5. Биологические активные добавки, содержащие кальций.
Наряду с БАД в последние годы все чаще используются гомеопатические препараты, которые имеют хорошую эффективность, не обладают токсическим действием и другими побочными эффектами. Таблица 6. Гомеопатические препараты. (основная цель – регуляция фосфорно-кальциевого обмена).
При выборе лекарственного или профилактического средства необходимо учитывать индивидуальные особенности, выраженность клинических признаков и лабораторно-функциональных показателей у конкретного ребенка. Наряду с этим, безусловно, должны быть продолженные научные исследования по изучению возможности медикаментозной коррекции метаболических нарушений у детей, в том числе фосфорно-кальциевого обмена. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
