ПОРАЖЕНИЕ ПОЧЕК У ДЕТЕЙ. УЧЕБНО-МЕТОДИЧЕСКОЕ ПОСОБИЕ.. Учебнометодическое пособие для студентов педиатрических факультетов, интернов, ординаторов и врачей педиатров
 Скачать 1.83 Mb. Скачать 1.83 Mb.
|
|
*собственные данные, совпадающие с данными литературы Выявлена зависимость ферментурии от возраста. При комплексной оценке активности в моче ферментов, имеющих различную внутрипочечную локализацию, обнаружено, что эти показатели у новорожденных в 1,5-2 раза выше, чем у детей старше года. Вероятно, это объясняется морфофункциональной незрелостью почек, преимущественно тубулярного отдела, у новорожденных. Со второго полугодия жизни активность ферментов в моче соответствует таковой у детей старше года. Активность ХЭ у здоровых детей практически не претерпевала изменений в возрастном аспекте, что свидетельствует о более быстром созревании гломерулярного отдела нефрона по сравнению с тубулярным. В последние годы возросло внимание исследователей к бета-2-микроглобулину (Б-2-МГ) и его значению в патологии детского возраста. Б-2-МГ - низкомолекулярный белок, представляет собой легкую цепь HLA - комплекса и является его постоянной субъединицей. Основной путь выведения и метаболизма Б-2-МГ осуществляется через почки. Он полностью фильтруется через базальную мембрану гломерул и на 99,9 % реабсорбируется клетками проксимальных канальцев посредством пиноцитоза. Повышение уровня Б-2-МГ в крови отражает либо увеличение его синтеза, либо снижение скорости гломерулярной фильтрации (СКФ). Для определения СКФ лучше использовать сывороточный уровень Б-2-МГ, чем креатинина, так как первый показатель стабилен в течение дня и не зависит от характера принимаемой пищи. Повышение уровня Б-2-МГ в моче наблюдается только при тубулярных дисфункциях - нарушении реабсорбции и катаболизма проксимальными канальцами почек. Оценка уровня Б-2-МГ в сыворотке крови и моче у новорожденных детей может быть использована в целях дифференциальной диагностики почек (особенно пиелонефрита и инфекции мочевыводящих путей), уточнения преимущественного места поражения нефрона, в качестве объективного критерия степени функциональных нарушений, частично - для характеристики иммунологического статуса. Данные о содержании Б-2-МГ в крови и моче у детей малочисленны и противоречивы. Это послужило основанием для изучения уровня Б-2-МГ у новорожденных и детей раннего возраста с почечной патологией. Нами обследованы 152 здоровых ребенка в возрасте 1 суток жизни до 3 лет (контральная группа). Содержание Б-2-МГ в сыворотке крови и моче исследовали методом радиоиммунологического анализа in vitro с использованием Б-2-МГ, меченного 125I. Применяли наборы реактивов ИБОХ АН Республики Беларусь. Результаты представлены в табл. 2. Таблица 2. Уровень Б-2-МГ в сыворотке крови и моче у практически здоровых новорожденных и детей раннего возраста
Половых различий в концентрации Б-2-МГ не выявлено, но установлена четкая зависимость от возраста детей. Более высокий уровень Б-2-МГ в сыворотке крови обнаружен у новорожденных и детей первого месяца жизни (6,0 - 8,0 мг/л), далее он заметно снижается и после 1 года приближается к показателям у детей старшего возраста (по данным литературы - от 0,8 до 3,0 мг/л). Наиболее высокий уровень Б-2-МГ в моче наблюдается у новорожденных, особенно в первые 7-10 дней жизни. У грудных детей он постепенно снижается, на 2-м и 3-м годах жизни достигаем минимальной отметки (0,1 мг/л), хотя остается в 2-3 раза выше, чем у детей старшего возраста и у взрослых (по данным литературы - до 0,05 мг/л), что объясняется незрелостью канальцевого аппарата почек. В связи с ухудшением экологических условий, а также улучшением реанимационных мероприятий в неонатальном периоде, приводящим к выхаживанием детей с очень низкой и экстремально низкой массой тела, отмечается нарастание дисметаболических нефропатий, нередко приводящих к развитию мочекаменной болезни даже у детей раннего возраста. Своевременная диагностика обменных нарушений у детей, предупреждение разития камнеобразования, а также профилактика осложнений является одной из важнейших задач детской нефрологии. С этой целью рекомендуется использование не только биохимического анализа мочи и определение антикристаллообразующей способности мочи, но и исследование мочи с помощью Литос-системы. Литос-система разработана на основе метода клиновидной дегидратации, предложенного С.Н. Шатохиной и В.Н. Шабалиным. Литос-система позволяет: 1) выявлять процесс камнеобразования в органах мочевой системы; 2) определять степень активности и устойчивости процесс камнеобразования; 3) устанавливать состав камнеобразующих солей мочи. Литос-система разрешена Минздравом РФ для применения в клинической практике (Приказ №17 МЗ РФ от 21 января 1997 г.). Специальное обучение и обследование проводится на базе лаборатории кристаллографических методов исследования при Российском НИИ геронтологии Минздрава России. Диагностика основана на принципах теории самоорганизации сложных систем и состоит в выявлении структурных особенностей капли мочи при переходе ее из жидкого состояния в твердое с помощью метода клиновидной дегидратации биологической жидкости. В норме, при добавлении белка к моче, образуется краевая белковая зона, хорошо наблюдаемая визуально в виде прозрачного периферического кольца дегидратированной капли. Отсутствие краевой аморфной зоны указывает на наличие процесса камнеобразования в органах мочевой системы обследуемого (рис. 1). 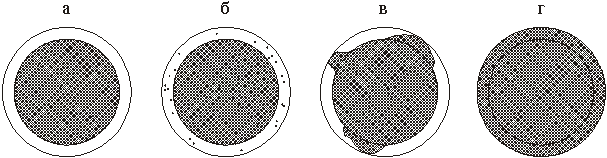 Рис. 1. Вид дегидратированных капель мочи в смеси с белковым Литос-реагентом при отсутствии (а) и различной степени активности камнеобразования в органах мочевой системы: б - слабой; в - умеренной; г - высокой (схема). Таким образом, необходимо активное выявление нефропатий у новорожденных детей с применением современных неинвазивных информативных диагностических тестов для осуществления ранней диагностики и своевременного проведения реабилитационных мероприятий. Структура нефропатий у новорожденных детей Наиболее часто в неонатальном периоде встречаются инфекционно-воспалительные заболевания ОМС, несколько реже – гипоксические нефропатии, острая почечная недостаточность (ОПН), токсико-аллергические состояния и интерстициальный нефрит, а также у них возможно развитие врожденных и наследственных заболеваний почек (гидронефроз, пузырно-мочеточниковый рефлюкс, поликистоз почек, мультикистоз, микрокистоз почек и др.), инфарктов почек, дисметаболических нефропатий и мочекаменной болезни (МКБ). При анализе историй болезни и осмотре более 2 тысяч новорожденных детей, перенесших реанимационные мероприятия, находившихся в неонатальном центре и отделении патологии новорожденных ДГКБ №13 им. Н.Ф. Филатова, нефропатии были выявлены у 1/3 детей (34,2%). Установлена структура и частота встречаемости различных нозологических форм заболеваний ОМС у детей неонатального периода. Результаты представлены в табл. 3. Таблица 3. Структура и частота встречаемости заболеваний органов мочевой системы у новорожденных детей
Инфекция мочевой системы Группа инфекционно-воспалительных заболеваний мочевой системы является наиболее изученной среди нефропатий, проявляющихся в неонатальном периоде. Инфекция органов мочевой системы (ИОМС), объединяющая пиелонефрит (ПН), инфекцию мочевыводящих путей (ИМВП), цистит, уретрит и асимптоматическую бактериурию, обнаруживается у новорожденных наиболее часто из всех нефропатий (в 37 % случаев). Пиелонефрит – инфекционно-воспалительное заболевание почек с преимущественным поражением чашечно-лоханочной системы, канальцев и интерстиция, проявляющаяся картиной инфекционного заболевания, особенно у детей раннего возраста, характеризующаяся лейкоцитурией и бактериурией и обязательным нарушением функционального состояния почек. Под диагнозом ИМВП понимается инфицирование органов мочевой системы при отсутствии указаний на её уровень и определения топики воспалительного процесса. Если при углубленном обследовании в условиях стационара не подтверждается диагноз ПН, цистит, уретрит и др., то в этом случае возможна постановка диагноза ИМВП. Однако, данный диагноз должен ставиться достаточно редко, при тщательном дальнейшем наблюдении за грудными детьми, с учетом лабораторных анализов мочи и крови. Цистит - воспалительное заболевание мочевого пузыря. Асимптоматическая бактериурия характеризует течение инфекционно-воспалительного процесса в нижних отделах мочевой системы преимущественно у новорожденных детей, проявляющаяся бактериурией без лейкоцитурии и протекающая без выраженной клиники. Асимптоматическая бактериурия (АБ) нередко диагностируется у относительно здоровых новорожденных, при отсутствии клинических и лабораторных (лейкоцитурии) признаков инфекционно-воспалительного заболевания. При АБ придается большая значимость состоянию иммунного статуса. Патогенез АБ достаточно сложен, в последнее время высказывается мнение о её эндогенном происхождении. Источником бактериурии может становиться кишечник. АБ является фактором риска формирования пиелонефрита и др. ИОМС в неонатальном периоде редко течет изолированно и клиническая картина у новорожденных обычно обусловлена сопутствующей патологией. У больных данной возрастной группы нередко отсутствуют симптомы, характерные для инфекционно-воспалительных заболеваний ОМС у детей старшего возраста. В клинике большинства новорожденных доминируют неспецифические признаки: симптомы интоксикации, субфебрилитет, слабое сосание, недостаточная прибавка массы, дисфункция кишечника. Клиническая картина пиелонефрита у новорожденных детей может быть разнообразной: преобладает малосимптомное или бессимптомное течение ПН (у 59 % детей), что можно объяснить особенностями иммунологического ответа новорожденных. У остальных детей (41 %), в основном, с врожденными пороками ОМС, отмечается более яркая клиническая картина ПН: субфебрильная температура, нарастание симптомов интоксикации, усиление неврологической симптоматики, появление пастозности тканей и дисфункции кишечника с увеличением патологических примесей в стуле. Основными лабораторными анализами, подтверждающими течение ПН, являются: 1) общий анализ мочи – в котором выявляются умеренная протеинурия от следовой до 0,06 г/л (однако при пороках развития почек, наличии пузырно-мочеточникового рефлюкса, протеинурия может быть более выраженной), лейкоцитурия от 15-20 в поле зрения (что более характерно для патологии дистальных отделов мочевой системы) до сплошь все поля зрения (наиболее часто встречается при пиелонефрите), бактериурия, а также отмечается нейтральная или щелочная реакция мочи, мутность мочи, наличие солей; 2) посев мочи, где наиболее часто высеваемым возбудителем является кишечная палочка, реже встречаются клебсиелла, синегнойная палочка, протей; 3) общий анализ крови – в котором подтверждается воспалительный характер патологического процесса: лейкоцитоз и ускорение СОЭ. Дополнительными исследованиями, позволяющими определить пиелонефритический процесс, являются: - биохимическое исследование мочи, выявляющие нарушения канальцевых функций почек (снижение ацидоаммониогенеза, оксалурия, уратурию, фосфатурию и кальциурию); - биохимический анализ крови, позволяющий определять степень активности воспалительного процесса и функцию почек; - ультразвуковое исследование почек, выявляющее аномалии развития почек. По данным УЗИ отмечается также увеличение почек, снижение (в острую фазу) или повышение эхогенности паренхимы почек; - цистография - устанавливается наличие пузырно-мочеточникового рефлюкса и клапана задней уретры; - по данным урографии и радиоизотопного исследования почек определяется нарушение функции почек. Наибольшие трудности у новорожденных детей представляет дифференциальная диагностика ПН с ИМВП. В данном вопросе важную роль играет определение энзимурии и уровня Б-2-МГ в крови и моче, поскольку без вовлечения в процесс почечной ткани активность ферментов и нарастание значений Б-2-МГ у пациентов с ИМВП выражены незначительно. При ПН повышается активность всех ферментов мочи, за исключением ХЭ. Наиболее выражен уровень ЛДГ (в 6 раз превышает норму), а также Y-ГТ (в 3 раза). Обращает на себя внимание значительное увеличение содержания Б-2-МГ в моче (в 20-25 раз) при повышении его в сыворотке крови только в 1,3 раза. ИМВП - инфекционно-воспалительное заболевание нижних отделов мочевой системы, не затрагивающее почки, можно предположить у детей неонатального периода при выявлении только мочевого синдрома в виде лейкоцитурии, протеинурии и бактериурии, у которых не было изменений по данным рентгенологических и ультразвуковых методов исследования, метаболических нарушений, не отмечались изменения воспалительного характера в анализе крови, а также не было нарастания энзимурии и увеличения уровня Б-2-МГ в крови и моче. В случае обнаружения нарушения уродинамики, наличия аномалий развития почек, воспалительных изменений в крови, мочевого синдрома, бактериурии, метаболических изменений, снижения концентрационной функции почек, выявления значительной ферментурии и повышения Б-2-МГ в моче можно предположить развитие вторичного пиелонефрита. Эмпирическая терапия при отсутствии данных посевов или при отрицательных результатах посева мочи при наличии яркой клинической картины атаки пиелонефрита: Антибактериальная терапия: Цефалоспорины второго поколения: цефуроксим (зинацеф) в/м по 60 мг/кг при 2-3 степени активности процесса; зиннат per os по 40-70 мг/кг при 1 степени активности процесса; амоксициллин 30-60 мг/ кг в сутки на 7-10 дней. Уросептики: Фурагин по 6-8 мг/кг сут на 2-4 недели. При наличии положительных посевов мочи используются антибактериальные препараты, к которым чувствительна высеваемая флора (ампициллин, защищенные пенициллины, цефалоспорины 2-3-го поколения). Необходимо учитывать, что в раннем возрасте пиелонефрит протекает на фоне выраженной нестабильности цитомембран и дисметаболических нарушений, поэтому уже через 3-4 дня после начала проведения антибактериальной терапии целесообразно совместное назначение мембранстабилизаторов и антиоксидантов курсом не менее месяца. При длительном течении пиелонефрита в раннем возрасте необходимо проведение полного нефро-урологического обследования с целью выявления признаков функциональной или органической обструкции. Если результаты проведенного обследования оказались отрицательными, необходимо исследование мочи на микоплазмы, уреаплазмы, хламидии с введением в терапию при положительных результатах макролидов (суммамед); на грибы, при обнаружении которых необходимо решать вопрос о назначении дифлюкана. В последние годы в неонатологии актуальной проблемой является микотическая инфекция. Первая встреча с грибами может произойти еще внутриутробно, при прохождении через родовые пути, при кормлении новорожденного и др. Для кандидозной патологии мало одного присутствия грибов, главным в патогенезе является состояние макроорганизма, Микотические поражения развиваются чаще у новорожденных, перенесших реанимационные мероприятия, сопровождающиеся длительным лечением различными антибиотиками. В настоящее время отмечается нарастание кандидозной патологии мочевой системы (ПН, ИМВП, ОПН), однако на фоне симптомов других заболеваний она нередко просматривается, поздно диагностируется, что ведет к несвоевременному лечению. В большинстве случаев кандидозная инфекция, проявляющаяся поражением кожи, слизистых и наличием в анализах мочи нитей мицелия, в первые 1-2 недели сочетается с бактериальной, атем стабильно превалирует грибковая. В анализах мочи этих новорожденных могут обнаруживаться грибки, несмотря на то, что дети получали противогрибковые препараты (нистатин, леворин). Манифестация кандидоза ОМС способствовует прогрессивному ухудшению состояния новорожденных. В большинстве случаев развитию кандидозной инфекции мочевыводящих путей у новорожденных предшествовует грибковое поражение слизистых и кожи. Обнаружение в анализах мочи мицелия дрожжевых грибков является показанием для назначения противогрибковых средств, хорошо всасывающихся из желудочно-кишечного тракта (дифлюкана, амфоглюкамина, а в случае тяжелого генерализованного поражения или нечувствительности к дифлюкану – применение амфотерицина В) и, иногда, промывания мочевого пузыря амфотерицином В с целью предотвращения обструктивной ОПН. Лечебные дозы дифлюкана у новорожденных соствляют 8-12 мг/кг в сутки перорально или парентерально в течение 4-6 недель, а амфоглюкамина 10 тыс. ЕД 2 раза в сутки перорально, в течение 2-3 недель. |
