Учебное пособие Часть 4 Функциональные производные углеводородов. Карбоновые кислоты и их производные. Амины. Москва 2003
 Скачать 1.26 Mb. Скачать 1.26 Mb.
|
3. Производные карбоновых кислот3.1. Реакции нуклеофильного замещения: механизм и реакционная способностьНаиболее характерными реакциями карбоновых кислот и их производных являются реакции нуклеофильного замещения при карбонильном атоме углерода. Общий механизм этих реакций выглядит следующим образом:  Нуклеофил Y¯ присоединяется к электрофильному атому углерода карбонильной группы с образованием аддукта, от которого затем отщепляется уходящая группа вместе с парой электронов. Таким образом, нуклеофильное замещение реализуется как двухстадийный процесс – присоединение с последующим отщеплением. Реакции могут катализироваться как кислотами (происходит протонирование карбонильной группы и увеличение электрофильности карбонильного атома углерода), так и основаниями (этот катализ позволяет генерировать более сильную нуклеофильную частицу из слабых нейтральных нуклеофилов, например, реакции с водой как нуклеофилом в нейтральной среде протекают медленнее, чем в щелочной, т.к. гидроксид-анион более нуклеофилен, чем вода). Реакционная способность карбоновых кислот и их производных в реакциях нуклеофильного замещения зависит от электрофильности карбонильного атома углерода. Все производные карбоновых кислот по ацилирующей способности можно расположить в следующий ряд ее уменьшения:       Наиболее реакционноспособны галогенангидриды карбоновых кислот, в молекуле которых атом галогена проявляет сильный отрицательный индуктивный эффект, а сопряжение (+М-эффект) невелико. Уходящей группой при этом является галогенид-анион, низкая основность которого позволяет ему легко уйти. Затем по активности следуют ангидриды карбоновых кислот. Их реакционная способность несколько ниже, чем у галогенангидридов, поскольку атом кислорода проявляет бóльший по сравнению с атомом галогена положительный мезомерный эффект (следовательно, частичный положительный заряд на карбонильном атоме углерода меньше). Кроме того, карбоксилат-анион как уходящая группа более основен, поэтому он уходит труднее, чем атом галогена в галогенангидридах. Далее в ряду условно (поэтому в скобках) стоят карбоновые кислоты. Их реакционная способность достаточно высока, но только в кислой среде. Поскольку нуклеофилы являются также и основаниями, то кислотный катализ не всегда можно использовать, и в этом случае карбоновые кислоты реагируют с нуклеофилами как кислоты и депротонируются (например, в реакции с аммиаком или достаточно основными аминами при нормальных условиях), превращаясь в совершенно неактивные соли, стоящие в ряду реакционной способности на последнем месте. Действительно, от отрицательно заряженной частицы трудно ждать активности в реакции с нуклеофилами, т.к. известно, что одноименно заряженные частицы отталкиваются. Сложные эфиры по ацилирующей способности сравнимы с карбоновыми кислотами, но алкоксигруппа уходит труднее, чем гидроксильная, т.к. алкоксид-анион более основен, чем гидроксид-анион. И еще менее реакционноспособны в реакциях нуклеофильного замещения амиды, в которых аминогруппа проявляет более сильный +М-эффект, т.к. электроотрицательность азота меньше, чем кислорода. 3.2. Сложные эфирыСложные эфиры – это производные карбоновых кислот, функциональная группа которых состоит из карбонильной и алкоксильной групп. В молекуле сложного эфира различают кислотную (или ацильную) часть и спиртовую (алкоксильную) часть. Развернутые названия сложных эфиров как раз и показывают это строение, например:  Названия сложных эфиров по номенклатуре ИЮПАК строятся следующим образом: название углеводородного остатка в спиртовой части + название главной цепи кислотной части вместе со всеми имеющимися заместителями (нумерация цепи производится от карбонильного атома углерода) + суффикс оат. Ниже приведены примеры названий некоторых сложных эфиров.   этилметаноат (этилформиат); метилэтаноат (метилацетат)   фенилбензоат бензил-3-метилбутаноат 3.1.1. Способы полученияСложные эфиры получают ацилированием спиртов и фенолов, причем в качестве ацилирующих агентов используются карбоновые кислоты, галогенангидриды карбоновых кислот и ангидриды карбоновых кислот (см. Спирты и Фенолы). В  заимодействие карбоновых кислот со спиртами в кислой среде с образованием сложных эфиров называется реакцией этерификации. Это взаимодействие протекает по механизму нуклеофильного замещения, катализируемого кислотами. Спирты представляют собой слабые нуклеофилы, поэтому для протекания реакции необходим катализ. Основный катализ использовать нельзя, т.к. при этом карбоновая кислота перейдет в неактивную соль. Кислотный катализ обеспечивает увеличение электрофильности карбоновой кислоты, поскольку в присутствии более сильной кислоты-катализатора происходит протонирование с образованием положительно заряженной частицы. заимодействие карбоновых кислот со спиртами в кислой среде с образованием сложных эфиров называется реакцией этерификации. Это взаимодействие протекает по механизму нуклеофильного замещения, катализируемого кислотами. Спирты представляют собой слабые нуклеофилы, поэтому для протекания реакции необходим катализ. Основный катализ использовать нельзя, т.к. при этом карбоновая кислота перейдет в неактивную соль. Кислотный катализ обеспечивает увеличение электрофильности карбоновой кислоты, поскольку в присутствии более сильной кислоты-катализатора происходит протонирование с образованием положительно заряженной частицы.1 2 3 4 5 6 Каждая стадия этого многостадийного процесса является обратимой, поэтому весь процесс этерификации – обратимая реакция. Первая, третья, четвертая и шестая стадии представляют собой обычные кислотно-основные равновесия. Вторая стадия – это нуклеофильное присоединение молекулы спирта к протонированной форме карбоновой кислоты, а пятая стадия – отщепление молекулы воды. Протон как катализатор присоединяется к карбоновой кислоте на первой стадии и отщепляется от протонированной формы сложного эфира на последней стадии. Реакционная способность карбоновых кислот и спиртов в реакции этерификации зависит от их электрофильных и соответственно нуклеофильных свойств. Так, например, хлоруксусная кислота подвергается этерификации легче, чем уксусная кислота. Из-за низкой нуклеофильности фенолы в реакцию этерификации не вступают (см. Фенолы). Кроме того, большое значение имеет стерический фактор: чем менее объемными являются R и R′, тем легче образуется продукт на стадии нуклеофильного присоединения. Поэтому лучше всего этерифицируются неразветвленные карбоновые кислоты и первичные спирты, а третичные спирты в условиях реакции этерификации подвергаются дегидратации. Кроме реакции этерификации, для получения сложных эфиров используют взаимодействие спиртов или фенолов, а также алкоголятов или фенолятов с более сильными ацилирующими реагентами – с галогенангидридами или ангидридами карбоновых кислот. В случае ацилирования спиртов и фенолов галогенангидридами карбоновых кислот используется катализ основаниями, а при ацилировании ангидридами – и основаниями, и кислотами. При ацилировании алкоголятов и фенолятов катализ, естественно, не требуется, поскольку они представляют собой сильные нуклеофилы.  ацетилхлорид этилацетат  бензойный анигдрид фенилбензоат  4-метилпентаноилхлорид бензил-4-метилпентаноат Для получения сложных эфиров применяют и реакцию переэтерификации, в которой спирты ацилируются сложными эфирами. Переэтерификация может катализироваться, как и многие реакции ацилирования, как кислотами, так и основаниями. В кислой среде механизм переэтерификации аналогичен механизму этерификации. 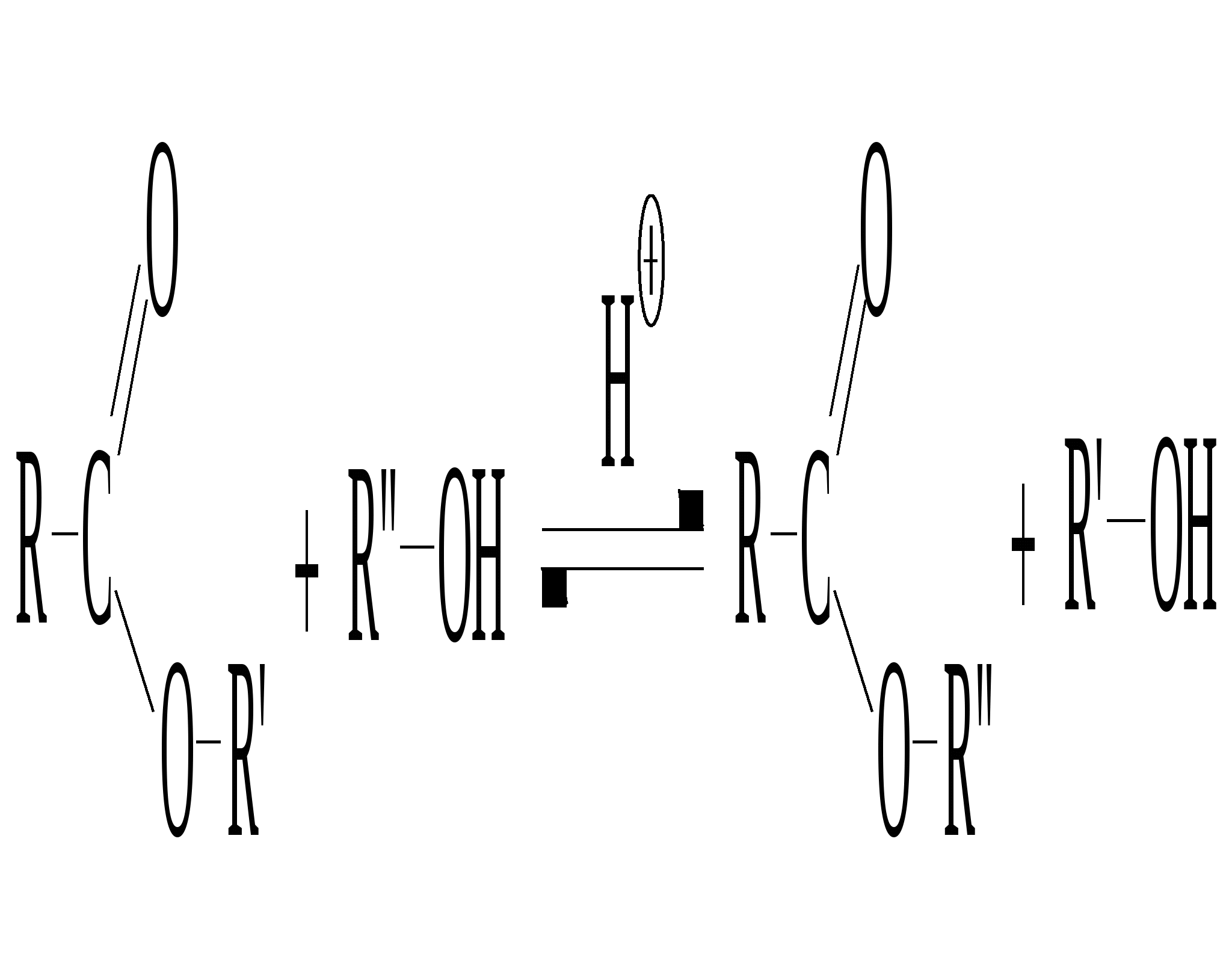 Равновесие этой реакции можно сдвинуть в нужную сторону, используя разницу в температурах кипения спиртов. Так, например, при нагревании метилбутаноата с 1-бутанолом в кислой среде постоянно проводят отгонку более летучего метанола, и равновесие смещается вправо.  Сложные эфиры можно также получать алкилированием солей карбоновых кислот галогенопроизводными. Это взаимодействие является реакцией нуклеофильного замещения.  Так, например, по механизму SN2 происходит алкилирование бензоата натрия метилиодидом до метилбензоата.  3.1.2. Химические свойства
Сложные эфиры гидролизуются до карбоновых кислот и спиртов как в кислой, так и в щелочной среде. Кислотный гидролиз обратим, это обратная реакция этерификации. Механизм кислотного гидролиза можно изобразить, рассмотрев механизм этерификации с конца.  Щелочной гидролиз необратим, поскольку в результате реакции образуется не сама карбоновая кислота, а ее соль, совершенно неактивная в реакции с нуклеофильным спиртом, поэтому обратная реакция не идет.  Необратимый щелочной гидролиз называют омылением, поскольку этой реакцией с давних пор из животных жиров, которые представляют собой сложные эфиры глицерина и так называемых жирных кислот, получали соли этих кислот, обладающие поверхностной активностью и использовавшиеся в качестве мыла.
Сложные эфиры при взаимодействии с аммиаком или аминами выступают как ацилирующие агенты. Продуктами этих реакций являются амиды карбоновых кислот, например:  метилфенилацетат фенилацетамид  этилформиат N,N-диметилформамид 3.3. ГалогенангидридыГалогенангидриды карбоновых кислот, или ацилгалогениды, представляют собой производные карбоновых кислот, в которых вместо гидроксильной группы находится атом галогена. Названия галогенопроизводных производятся заменой суффикса и окончания –овая кислота в названии карбоновой кислоты на суффикс –оилгалогенид. Например, хлоранигидрид уксусной кислоты называется этаноилхлорид (или ацетилхлорид), а хлорангидрид 2-метилпентановой кислоты – 2-метилпентаноилхлорид. Из всех галогенопроизводных карбоновых кислот наибольшее значение имеют хлорангидриды. Их получают из карбоновых кислот действием тионилхлорида или пентахлорида фосфора.   Хлорангидриды карбоновых кислот имеют большое значение в органической химии, поскольку они являются сильнейшими ацилирующими агентами, способными ацилировать практически любые нуклеофилы:


 Эта реакция, как и другие реакции ацилирования О- и N-нуклеофилов, протекает по механизму нуклеофильного замещения.  3.4. АнгидридыАнгидриды карбоновых кислот представляют собой производные карбоновых кислот, в которых два ацильных остатка соединены с атомом кислорода. Различают симметричные и несимметричные (смешанные) ангидриды.  R = R′ ангидрид карбоновой кислоты RСООН R ≠ R′ смешанный ангидрид карбоновых кислот RСООН и R′СООН Ангидриды карбоновых кислот получают межмолекулярной дегидратацией карбоновых кислот под действием водоотнимающего средства, например, оксида фосфора (V).  Ангидриды можно также получать ацилированием солей карбоновых кислот галогенангидридами. Так, например, при взаимодействии ацетата калия и ацетилхлорида образуется уксусный ангидрид, а реакция бензоата натрия и пропаноилхлоорида приводит к смешанному ангидриду бензойной и пропановой кислот.   С точки зрения химического поведения ангидриды карбоновых кислот весьма похожи на галогенангидриды и представляют собой сильные ацилирующие агенты. С ними возможно проведение всех реакций ацилирования, которые были рассмотрены для галогенангидридов карбоновых кислот. 3.5. АмидыФункциональная группа амидов карбоновых кислот состоит из карбонильной группы, сопряженной с аминогруппой. Различают первичные амиды, в которых у атома азота имеются два атома водорода, вторичные амиды, имеющие при атоме азота один углеводородный остаток, и третичные амиды, в молекуле которых атом азота связан с двумя углеводородными остатками. Названия амидов карбоновых кислот образуют из названия соответствующих карбоновых кислот заменой суффикса –овая кислота на суффикс –амид, указывая в начале названия углеводородные остатки при атоме азота, если они имеются, например:  пропанамид (амид пропановой кислоты)  N-этилбензамид (этиламид бензойной кислоты)  N-фенилацетамид (фениламид уксусной кислоты, ацетанилид)  N,N-диметилформамид (диметиламид муравьиной кислоты) 3.5.1. Способы полученияПервичные амиды получают ацилированием аммиака, при ацилировании первичных аминов получают вторичные амиды, а из вторичных аминов получают третичные амиды. В качестве ацилирующих агентов могут использоваться как карбоновые кислоты, так и их производные – ангидриды, галогенангидриды, сложные эфиры. При ацилировании карбоновыми кислотами первоначально в результате кислотно-основного взаимодействия образуются соли, которые при нагревании теряют молекулу воды и превращаются в амиды.  При ацилировании аммиака или аминов галогенангидридами карбоновых кислот необходим избыток аммиака или амина или какое-либо другое основание для нейтрализации выделяющегося в процессе замещения галогеноводорода. Так, например, при взаимодействии анилина с ацетилхлоридом в присутствии едкого натра получается N-фенилацетамид (ацетанилид).  Для получения первичных амидов может быть использована также реакция частичного гидролиза нитрилов, катализируемая кислотами.  3.5.2. Химические свойства1) Гидролиз. Как и все производные карбоновых кислот, амиды подвергаются гидролитическому расщеплению до соответствующих карбоновых кислот и аммиака или аминов. Гидролиз может катализироваться как кислотами, так и основаниями, при этом катализатор берется по крайней мере в эквивалентном соотношении к амиду, поскольку он расходуется на кислотно-основное взаимодействие с продуктами гидролиза. Так, например, гидролиз пара-нитроацетанилида в присутствии избытка серной кислоты приводит к уксусной кислоте и гидросульфату пара-нитрофениламмония. При щелочном же гидролизе этого амида под действием водного едкого натра образуются пара-нитроанилин и ацетат натрия.  2) Дегидратация первичные амидов до нитрилов. При нагревании первичных амидов карбоновых кислот с пентаоксидом фосфора происходит отщепление воды и образование соответствующего нитрила.  3) Восстановление до аминов. При действии на амиды алюмогидрида лития происходит их восстановление до соответствующих аминов.  3.6. НитрилыНитрилы представляют собой производные карбоновых кислот, функциональная группа которых – цианогруппа – не содержит карбонильной группы. Названия нитрилов карбоновых кислот производят от названия соответствующих карбоновых кислот путем замены суффикса –овая кислота на суффикс –нитрил. нитрил уксусной кислоты, или ацетонитрил  нитрил бензойной кислоты, или бензонитрил  нитрил 2-метилбутановой кислоты, или 2-метилбутаннитрил Способы получения: а) алкилирование цианид-аниона галогенопроизводными по механизму SN2  б) дегидратация первичных амидов с помощью пентаоксида фосфора  Химические свойства: а) Гидролиз. При нагревании нитрилов с водными растворами сильных минеральных кислот происходит их гидролиз сначала до первичных амидов, которые далее гидролизуются до карбоновых кислот.  б) Восстановление до первичных аминов. При каталитическом гидрировании нитрилов образуются первичные амины. Например, гидрирование бензонитрила на никелевом катализаторе приводит к бензиламину.  |
