ЛИТЕРАТУРА
Андруз Дж., Бримблекумб П., Джикелз Т., Лисс П. Введение в химию окружающей среды. Пер. с англ. – М.: Мир, 1999. – 271 с.
Исидоров В.А. Экологическая химия: Учебное пособие для вузов. – СПб.: Химиздат, 2001. – 304 с.
Гусакова Н.В. Химия окружающей среды. Серия «Высшее образование». – Ростов-на-Дону: Феникс, . – 192 с.
Исидоров В.А. Введение в химическую экотоксикологию: Учебное пособие для вузов. – СПб.: Химиздат, 1999. – 144 с.
Мур Док., Рамамурти С. Тяжелые металлы в природных водах: контроль и оценка влияния: Пер. с англ. – М.: Мир, 1987. – 287 с.
Экологическая химия. Под ред. Ф. Корте. Пер. с англ. – 2004. – 396 с.
Человек и его среда обитания. Под ред. Г.В. Лисичкина и Н.Н. Чернова. – 2004. – 460 с.
Хенсе М., Харренмойс П., Янсен Е., Арвин Э. Очистка сточных вод. Под ред. Л. Дернера. Пер. с англ. – 2004. – 400 с.
Гидрохимические показатели состояния окружающей среды. Справочные материалы / Под ред. Т. В. Гусевой. – М.: Социально-экологический союз, 2000. – 148 с.
ПРИЛОЖЕНИЕ
Таблица 2. Равновесные парциальные давления паров воды в воздухе
при различных температурах
Температура, 0С
|
Парциальное давление паров воды
|
Мм рт.ст.
|
Атм
|
Па
|
0
|
4,58
|
6,02 . 10–3
|
607,81
|
5
|
6,54
|
8,60 . 10–3
|
871,78
|
10
|
9,21
|
12,12 . 10–3
|
1227,69
|
15
|
12,79
|
16,83 . 10–3
|
1704,91
|
20
|
17,54
|
23 . 10–3
|
2338,08
|
25
|
23,76
|
31,26 . 10–3
|
3167,21
|
30
|
31,82
|
41,87 . 10–3
|
4241,61
|
Таблица 3. Константы Генри (Кг) для некоторых газов при температуре 298 К
Газ
|
КГ, моль/(л . атм)
|
Газ
|
КГ, моль/(л . атм)
|
СО2
|
3,3 . 10–2
|
NH3
|
89,1
|
SO2
|
5,34
|
H2O2
|
1 . 105
|
Таблица 4. Константы Генри (KГ) для кислорода при различных температурах
Т, К
|
KГ
|
моль/л . атм
|
моль/л . Па
|
278
|
0,00191
|
1,88 .10–8
|
298
|
0,00130
|
1,28 .10–8
|
Таблица 5. Изменение стандартной энергии Гиббса (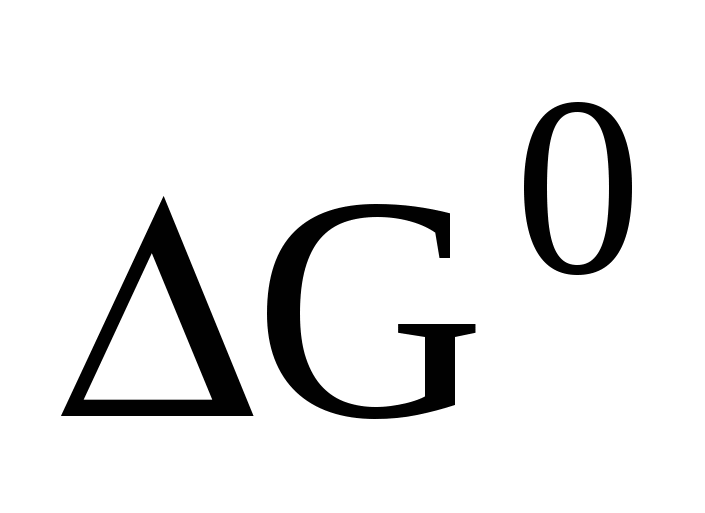 ) )
при образовании некоторых веществ и ионов в водном растворе
при давлении 101,3 кПа и температуре 298 К
Вещество или ион
|
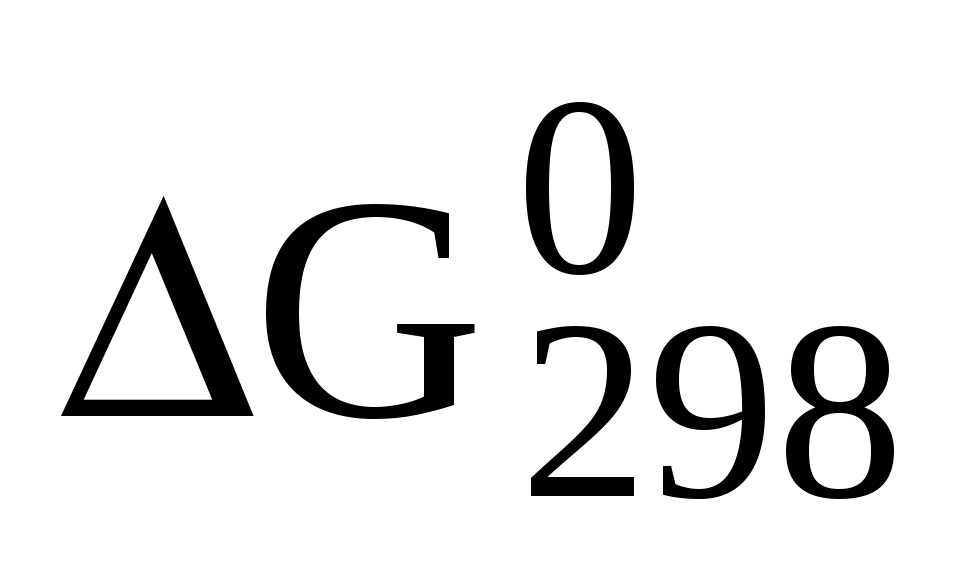 , кДж/моль , кДж/моль
|
Вещество или ион
|
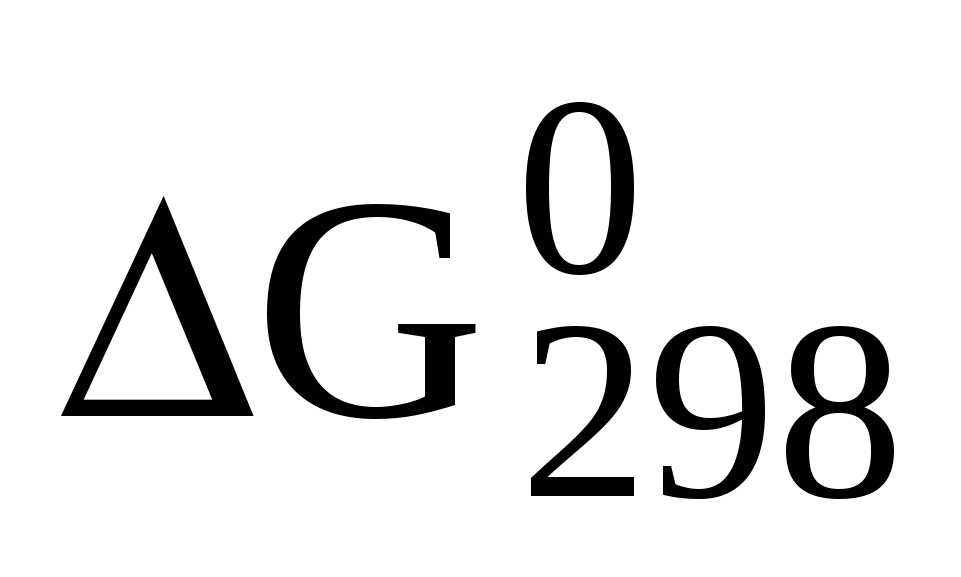 , кДж/моль , кДж/моль
|
Н2О(ж)
|
–237,23
|
CO2(Г)
|
–394,37
|
СаСО3 (кальцит)
|
–1128,35
|
MgCO3 (магнезит)
|
–1012,15
|
CaSO4 (ангидрит)
|
–1323,90
|
CaSO4 . 2Н2О (гипс)
|
–1799,8
|
CaF2 (флюорит)
|
–1168,46
|
Fe2C3 (крист.)
|
–740,34
|
FезО4 (крист.)
|
–1014,17
|
Са3РО4
|
–3884,9
|
Са2+
|
–552,70
|
Mg2+
|
–455,24
|
CO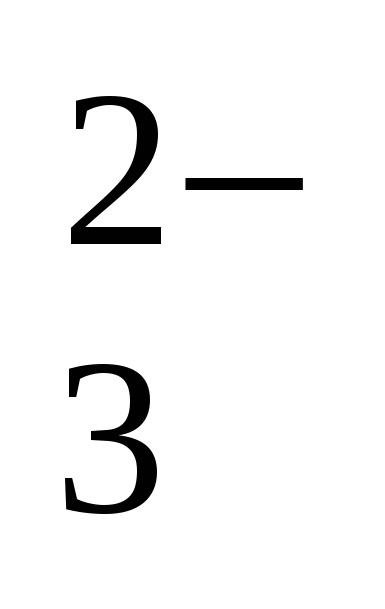
|
–527,60
|
НСО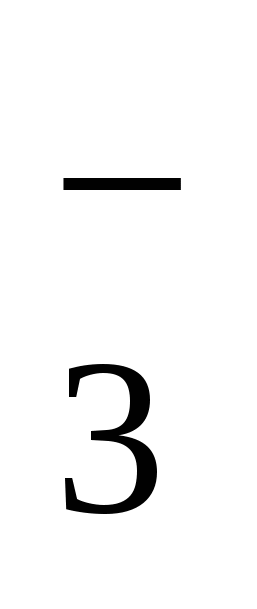
|
–586,56
|
SO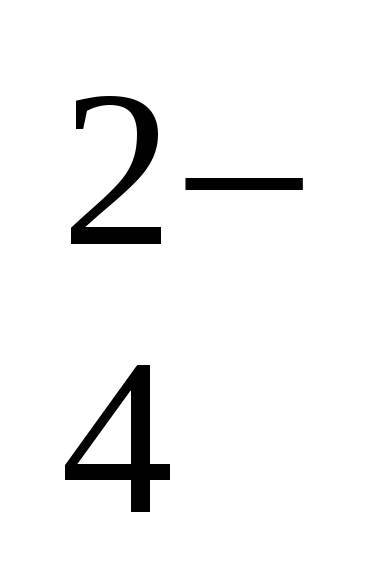
|
–743,99
|
F–
|
–279,99
|
Fe2+
|
–84,88
|
Fe3+
|
–10,53
|
Таблица 6. Изменение стандартной энтальпии (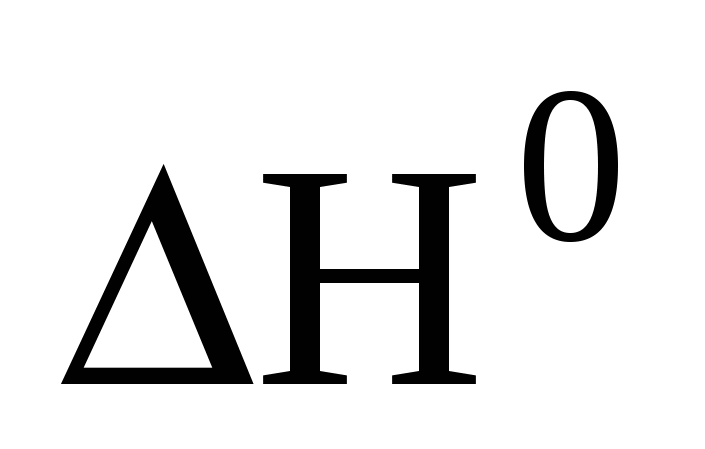 ) )
при образовании некоторых веществ и ионов в водном растворе
при давлении 101,3 кПа и температуре 298 К
Вещество или ион
|
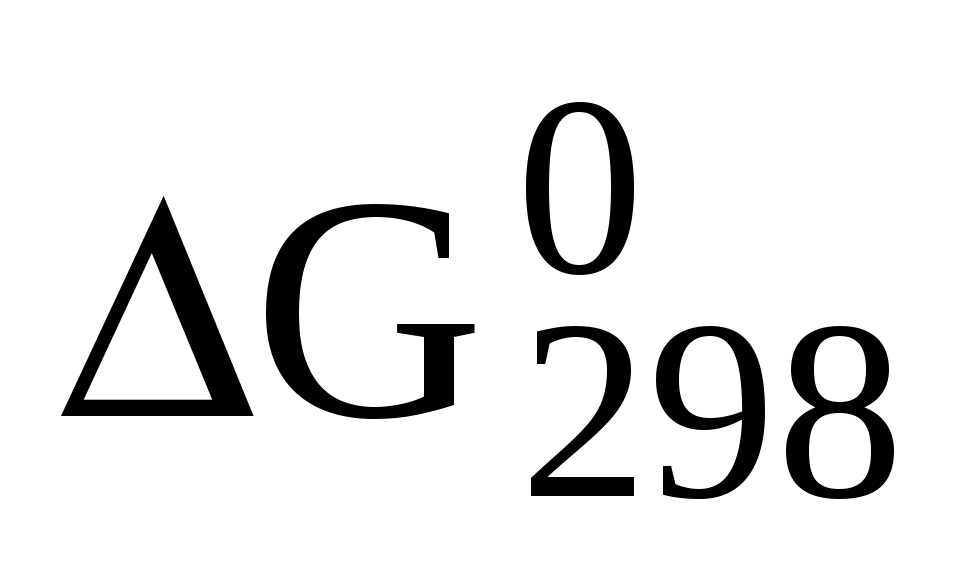 , кДж/моль , кДж/моль
|
Вещество или ион
|
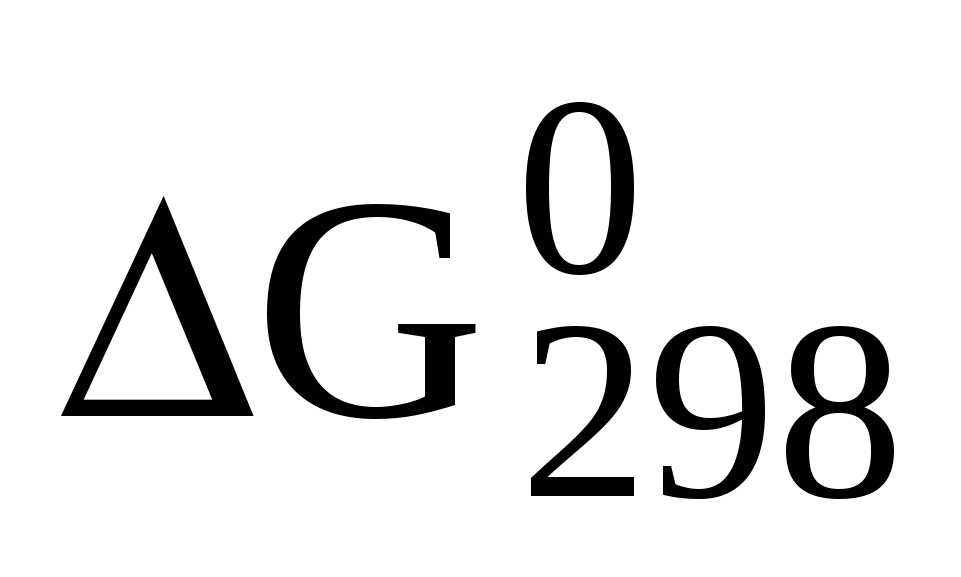 , кДж/моль , кДж/моль
|
Н2О(ж)
|
–285,83
|
СаСО3 (кальцит)
|
–1209,83
|
CaSO4 (ангидрит)
|
–1436,28
|
CaSO4 . 2Н2О (гипс)
|
–2027,70
|
MgCО3 (магнезит)
|
–1095,85
|
CO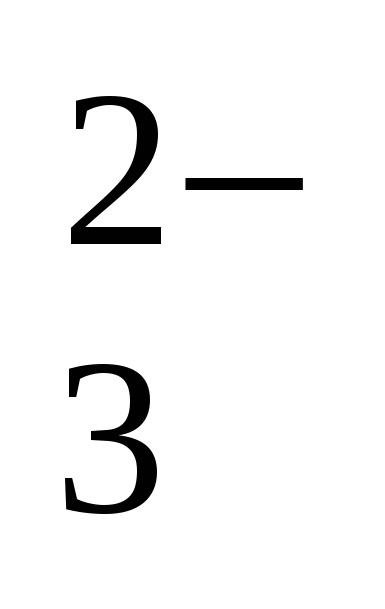
|
–676,64
|
SO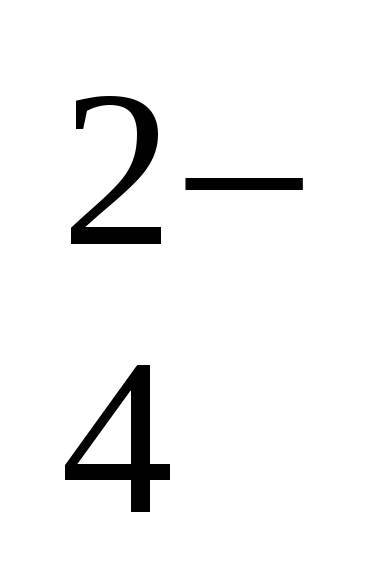
|
–909,26
|
F-
|
–333,84
|
Са2+
|
–542,66
|
Mg2+
|
–461,75
|
Таблица 7. Константы диссоциации угольной и сернистой кислот
по первой (К1)и второй (К2)ступеням диссоциации при различных температурах
Кислота
|
T, К
|
К1
|
К2
|
H2SO3
|
298
|
2,7 . 10–2
|
1 . 10–7
|
Н2СО3
|
298
|
4,45 . 10–7
|
4,69 . 10–11
|
Н2СО3
|
278
|
3,02 . 10–7
|
2,75 . 10–11
|
Таблица 8. Константа а, характеризующая радиус гидратированного иона в модифицированном уравнении Дебая – Хюккеля
при давлении 101,3 кПа и температуре 298 К (А = 0,5058; В = 0,3281 . 108)
Ион
|
а
|
Ион
|
а
|
SO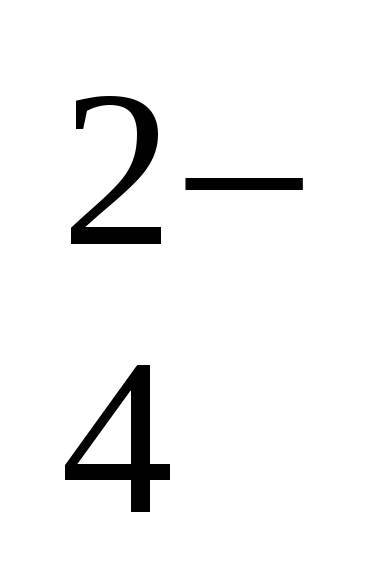
|
4,6 . 10–8
|
Са2+
|
6,0 . 10–8
|
F–
|
3,5 . 10–8
|
Sr2+
|
5,0 . 108
| |
 Скачать 31.55 Mb.
Скачать 31.55 Mb.