ПособФХпроцЧ.2ГидросфХОС05. Учебное пособие Физикохимические процессы в гидросфере
 Скачать 31.55 Mb. Скачать 31.55 Mb.
|
5.4. Особенности окислительно-восстановительных процессовв озерахРедокс-условия в озерах определяются балансом между окислением органического вещества и поступлением кислорода за счет циркуляции или вертикального перемешивания воды. Специфическая зависимость плотности воды от температуры приводит к возникновению ярко выраженной слоистой структуры озер, расположенных в районах с умеренно континентальным климатом (рисунок 7). 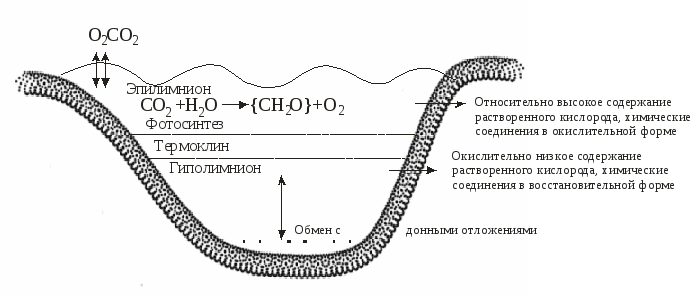 Рис. 7. Стратификация озера Рис. 7. Стратификация озераЛетом поверхностный слой (эпилимнион) нагревается за счет солнечной радиации. Температура в пределах эпилимниона довольно постоянна, так как поверхностная зона подвержена волновому перемешиванию. Непосредственно под эпилимпионом расположен метпалимнион, или зона термоклина, – область, в которой температура быстро уменьшается с глубиной. Ниже металимниона находится гиполимниоп – масса одинаково холодной воды. Когда теплая вода малой плотности лежит над холодной водой высокой плотности, смешение и, как следствие, обмен растворенными веществами между эпилимнионом и гиполимнионом затруднены. Такое явление называется термической стратификацией. Осенью постепенное понижение температуры эпилимниона приведет к тому, что в определенный период, при температуре воздуха около 277 К, вода во всем водоеме будет одинаковой температуры и плотности. При этом в результате волновой деятельности вся вода в водоеме будет перемешана. Такой период называют периодом осеннего водообмена. В дальнейшем при понижении температуры в верхнем слое воды ее плотность снизится, и в водоеме вновь произойдет разделение на слои различной плотности, обмен между которыми будет затруднен. Это явление называют зимней стратификацией. Весеннее повышение температуры в зоне эпилимниона приведет к выравниванию температуры и плотности воды во всем водоеме. Начнется процесс весеннего водообмена. Во время весеннего и осеннего водообмена содержание растворенного кислорода во всем озере в основном соответствует равновесным значениям, характерным для приземного воздуха и воды при температуре 277 К. В период летней стратификации равновесное количество растворенного в эпилимнионе кислорода снизится по сравнению с периодом водообмена, поскольку растворимость газов уменьшается с ростом температуры. Следует отметить, что в эпилимнионе в этот период интенсивно протекает фотосинтез, который помимо процесса растворения кислорода из атмосферного воздуха является еще одним источником растворенного кислорода. В некоторых случаях это приводит к нарушению равновесий из-за разности скоростей процессов поступления и выделения, и концентрация растворенного кислорода в некоторых зонах эпилимниона может быть больше равновесной. В процессе фотосинтеза, как известно, происходит образование органических соединений и кислорода. Помимо углерода для фотосинтеза требуются азот, фосфор и ряд рассеянных элементов. В пресных незагрязненных водах лимитирующим питательным веществом обычно являются фосфаты, в загрязненных водах фотосинтез в некоторых случаях лимитируется нитратами. Лимитирование рассеянными элементами встречается крайне редко. Средний состав органического вещества фитопланктона определяется приближенной формулой С106Н263О110N16Р, поэтому более правильное по сравнению с уравнениями (54) и (55) отображение картины фотосинтеза можно представить следующим брутто-уравнением: h, микроэлементы 1 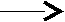 06СО2 + 16NO 06СО2 + 16NOОбразовавшийся в эпилимнионе фитопланктон обычно живет не более нескольких суток. Отмирая, он образует мертвую массу органических соединений, которые имеют тот же состав, что и исходный фитопланктон. Эти органические соединения опускаются в глубь водоема и попадают в гиполимнион. Процесс их окисления, выраженный брутто-уравнением, представляет собой реакцию, обратную фотосинтезу: C106H263O110N16P + 138O2 106СО2 + 16NO т.е. когда органическое вещество, образовавшееся в эпилимнионе при участии одного атома фосфора, распадается, оно становится потенциальным потребителем 138 молекул кислорода, но это происходит уже в гиполимнионе. Поэтому когда в озере возникает стратификация, содержание кислорода в воде гииолимниона устойчиво снижается вследствие разложения органического вещества, выпадающего из эпилимниона. Станет ли гиполимнион анаэробным, зависит от суммарного количества органического вещества, поступающего в него в период стратификации, которое контролируется главным образом наличием питательных неорганических веществ, особенно фосфатов в эпилимнионе. В соответствии с количеством поступающих в водоем питательных веществ водоемы можно разделить на олиготрофные и эвтрофные. Олиготрофное озеро– это озеро, в котором поступление питательных веществ незначительно, поэтому продуктивность фотосинтеза мала и вода содержит кислород на всех глубинах. В эвтрофном озеренаблюдается рост биопродуктивности, связанный с интенсивным поступлением питательных веществ. В период стратификации весь кислород в гиполимнионе может быть израсходован. Величина Когда олиготрофное озеро в результате антропогенного загрязнения становится эвтрофным, этот процесс трудно сделать обратимым, даже если интенсивность поступления питательных веществ будет уменьшена до первоначального значения. Это связано с тем, что в период стратификации в эвтрофном озере значительная часть растворимых фосфатов связывается в эпилимнионе, например, с гидроксидами железа (III). Имея высокоразвитую поверхность, эти соединения активно адсорбируют фосфаты и, опускаясь в глубь водоема, переносят их в гиполимнион. При их восстановлении и образовании сульфидов или карбонатов двухвалентного железа (FeS или FеСО3), которое будет происходить в восстановительной среде гиполимниона, фосфаты будут вновь выделены в раствор. В период водообмена часть этих фосфатов попадет в эпилимнион, и за счет этого внутреннего, дополнительного поступления питательных веществ водоем может сохранить эвтрофное состояние. Существует и химическая стратификация. Она встречается там, где вода с более высокой соленостью, образовавшаяся в засушливый период или за счет растворения солей на дне озера, находится под менее соленой поверхностной водой. Такая химическая стратификация может сохраняться многие годы. Одно из крупномасштабных проявлений химической стратификации демонстрирует, например, Черное море. 5.5. Особенности окислительно-восстановительных процессовв океанеВ отличие от озер водообмен в океане является непрерывным, так как холодная поверхностная вода погружается на глубину у полюсов, проходит через глубинную зону и возвращается на поверхность. Распределение питательных веществ (и, следовательно, фотосинтез) в океане контролируется почти полностью регенерацией этих веществ в массе воды и их перераспределением в ходе циркуляции воды, тогда как в озерах оно контролируется больше поступлением питательных веществ с водным стоком, чем процессами, происходящими в самом озере (хотя имеются и исключения из этого правила). 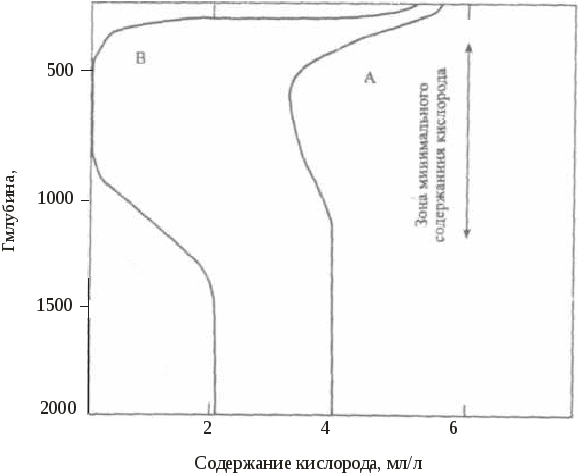  Рис. 2.8. Схема распределения кислорода в океанических водах: А – район средней поверхностной продуктивности; В – район очень высокой поверхностной продуктивности Типичная схема распределения растворенного кислорода в водах океана показана на рисунке 8. Отличительной особенностью распределения является существование зоны минимального содержания кислорода. Это глубинный интервал, где значительная часть органического вещества, опускающегося из поверхностной зоны, подвергается разложению. В целом воды остаются аэробными (рисунок 8, кривая А). Однако в районах исключительно высокой продуктивности, где восходящие течения возвращают питательные вещества на поверхность, зона минимума может стать анаэробной (рисунок 8, кривая В). Глубинная зона ниже зоны минимума обычно хорошо аэрирована, поскольку существует постоянная подпитка за счет воды, опускающейся у полюсов. 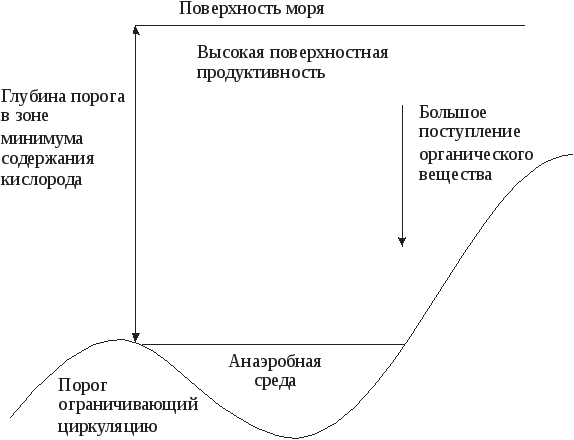 , Рис. 9. Схематическая иллюстрация условий, необходимых для появления анаэробного бассейна в океане Анаэробные бассейны в океане образуются в тех местах, где имеются препятствия для циркуляции глубинной воды, а продуктивность поверхностного слоя высока (например, бассейн Кариако вблизи Венесуэлы). Такие бассейны всегда имеют подводные пороги на уровне зоны минимального содержания кислорода (рисунок 9). В более глубоких слоях снабжение легко разлагающимся органическим веществом настолько замедлено, что даже закрытые бассейны с малой циркуляцией остаются анаэробными. Химическая стратификация (рисунок 10), которая может привести к появлению анаэробных условий, возможна в бассейнах типа Черного моря или во фьордах Северной Европы и Северной Америки, где солесодержание ниже, чем в открытом океане. 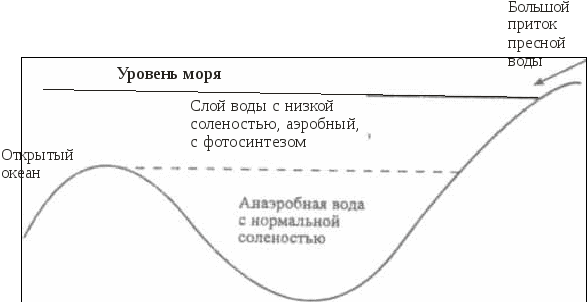 Рис. 10. Схематическая иллюстрация анаэробного бассейна типа фьорда В заключение отметим, что хотя анаэробные условия в собственно морской воде редки, они обычны для поровых вод прибрежных морских осадков. 5.6. Особенности окислительно-восстановительных процессовв подземных водахОсновными параметрами природных систем, обусловливающими редокс-уровни природных вод, являются:
Редокс-характеристики подземных вод существенно зависят от конкретных региональных условий. Зависимости изменения редокс-уровней от рН для наиболее часто встречающихся окислительно-восстанови-тельных систем в подземных водах представлены на рисунке 11. Большинство подземных вод, по-видимому, относится к зоне 2 (рисунок 11). Вода не содержит свободного кислорода, но в ней не наблюдается и заметной сульфат-редукции. Этот редокс-уровень не является препятствием при использовании вод для бытового водоснабжения, хотя высокие (1 млн–1 и более) концентрации растворимых форм железа или марганца иногда создают проблемы. Подземные воды зоны 3 («забуференные» сульфат-редукцией) обычно встречаются там, где время пребывания воды в водоносном горизонте велико или где присутствует много реакционноспособного органического вещества. Высокие концентрации сульфидов делают эти воды не пригодными для целей бытового водоснабжения. Хотя воды зоны 4, располагающейся ниже границы сульфат/сульфид, обычны для современных илов, они относительно редки в водоносных горизонтах, сложенных древними породами. Органическое вещество древних пород (за исключением нефти) используется бактериями настолько медленно, что требуются многие тысячелетия, чтобы были восстановлены все сульфаты и величины 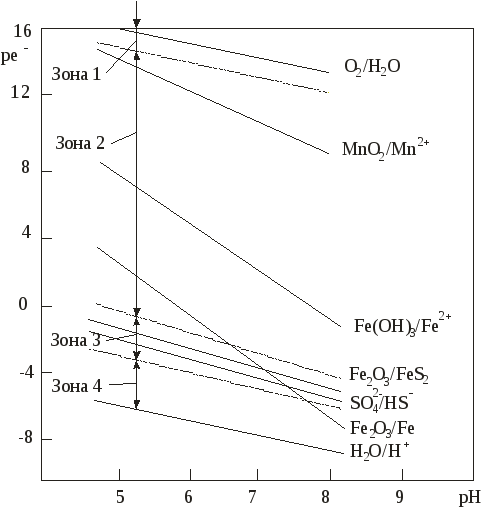  Рис. 11. Типичные редокс-уровни подземных вод (зоны 1-4) 5.7. Окислительно-восстановительные условияи миграция элементовНекоторые рудные месторождения, особенно инфильтрационные месторождения урана с перемещающимся фронтом, являются следствием редокс-реакций в подземных водах. Интенсивность миграции элементов принято характеризовать коэффициентом водной миграции Кх,равным частному от деления количества элемента х в минеральном остатке природной воды на его содержание в горных породах, дренируемых этой водой: Кх = тх где mх – содержание элемента х в воде, мг/л; nх – содержание элемента х в породах, %; а – минерализация воды, мг/л. Чем больше величина Кх, тем больше миграционная способность данных элементов. Очень подвижные активные мигранты имеют значение Кхсвыше 20, подвижные – от 20 до 1. Коэффициент водной миграции таких слабоподвижных мигрантов, как железо, титан и алюминий, не превышает 0,1. Изменение интенсивности миграции в одних и тех же условиях среды в зависимости от формы, в которой элемент содержится в породе, характеризуется коэффициентом контрастности миграции. Например, в различных обстановках миграция ионов Zn в сульфидной форме и в форме оксида имеет коэффициент контрастности миграции около 100. Одними из наиболее важных характеристик, существенным образом влияющих на миграцию элементов в ландшафтах, являются кислотно-основные и окислительно-восстановительные характеристики среды. Однако следует иметь в виду, что живые организмы способны в значительной степени трансформировать процессы миграции. Геохимический барьер – это участок зоны гипергенеза, где на коротком расстоянии происходит резкое уменьшение интенсивности миграции, что приводит к концентрированию химических элементов. Физико-химические барьеры возникают при резких изменениях величины рН или соотношения рН/Еh. Например, если кислородсодержащая вода начинает двигаться по водному горизонту, в котором первоначально существовали восстановительные условия, то между окислительной и восстановительной средами может образоваться редокс-фронт. Этот фронт будет перемещаться в направлении движения воды, но со значительно меньшей скоростью, чем вода. Скорость движения фронта определяется способностью водоносного горизонта (особенно содержащегося в нем органического вещества) потреблять кислород. Если типичный водоносный горизонт в осадочных породах содержал 1% реакционноспособного органического углерода, а подземная вода – 10 мг/л растворенного кислорода, то, согласно расчету, фронт должен мигрировать в 13000 раз медленнее, чем вода. Ряд элементов (особенно уран, селен, мышьяк, молибден) не растворимы в восстановительных условиях и растворимы в окислительных. При продвижении фронта окисления эти элементы, присутствующие в водоносном горизонте, растворяются. Движущиеся подземные воды переносят их через фронт в восстановительную среду, где они сразу же снова осаждаются. Таким образом, элемент, содержащийся во всем водоносном горизонте до прохождения фронта или перенесенный из других областей системы подземных вод, концентрируется в непосредственной близости к фронту, что создает возможность экономически выгодной его добычи. Примеры решения задачПример 20. Постройте диаграмму Решение. Все области устойчивого существования соединений железа в рассматриваемой системе должны находиться между границами, определяющими устойчивое состояние воды. Уравнения, характеризующие верхнюю и нижнюю границы устойчивости воды, были рассмотрены ранее; начнем с границы Fe2O3-Fe3O4. Уравнение, описывающее это превращение, можно представить в следующем виде: 3  Fe2O3 + 2 Fe2O3 + 2В случае, если оксиды железа (II) и железа (III) не содержат примесей, их активность может быть принята равной единице. В этом случае константа равновесия может быть выражена уравнением: K=1/[( Прологарифмируем это уравнение и выразим значение lgK = 2 На диаграмме эта граница является прямой с тангенсом угла наклона к оси абсцисс, равным –1. Точка пересечения с осью ординат задается величиной константы равновесия, которую можно определить, предварительно рассчитав G0реакции, описывающей данную границу: Следовательно, уравнение, определяющее границу, имеет вид: Уравнение, описывающее превращение Fe3+ – Fе2О3, можно представить в виде: F  e2O3 + 6Н+ 2Fe3+ + 3Н2О. e2O3 + 6Н+ 2Fe3+ + 3Н2О.Константа равновесия этого процесса имеет вид: 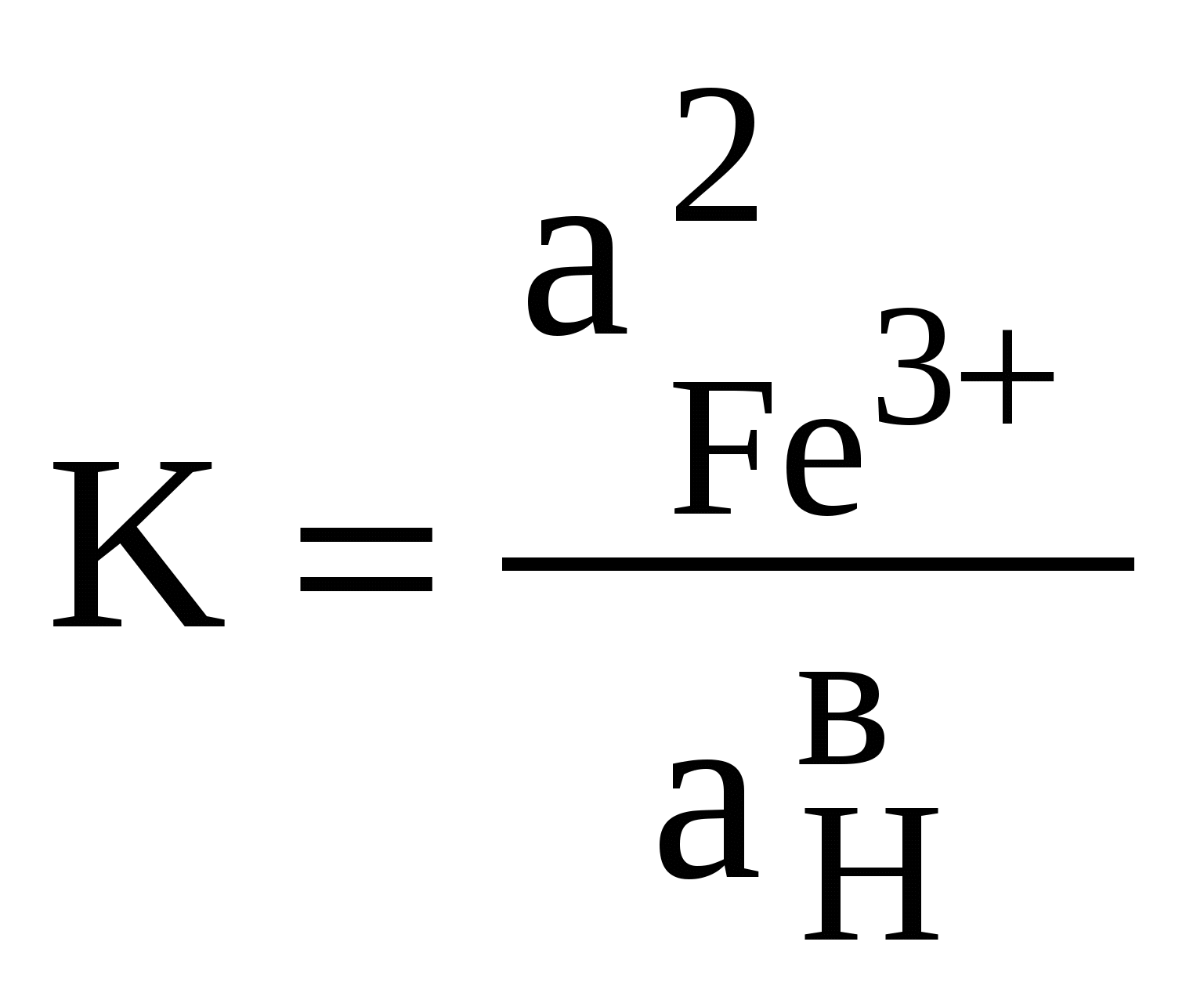 Логарифм константы равновесия равен: Очевидно, что на диаграмме эта граница является прямой, параллельной оси рН = В ходе рассуждений, аналогичных проделанным ранее, легко вычислить, что lg Kравн = –2,23, откуда рН = 1,63. Граница между Fe3+ и Fe2+ задается уравнением F  e3+ + e3+ +Выражения для константы равновесия и Граница является прямой, параллельной оси рН. Соотношение активностей Граница Fe2O3 – Fe2+ определяется реакцией F  e2O3 + 2 e2O3 + 2Выражения для константы равновесия и 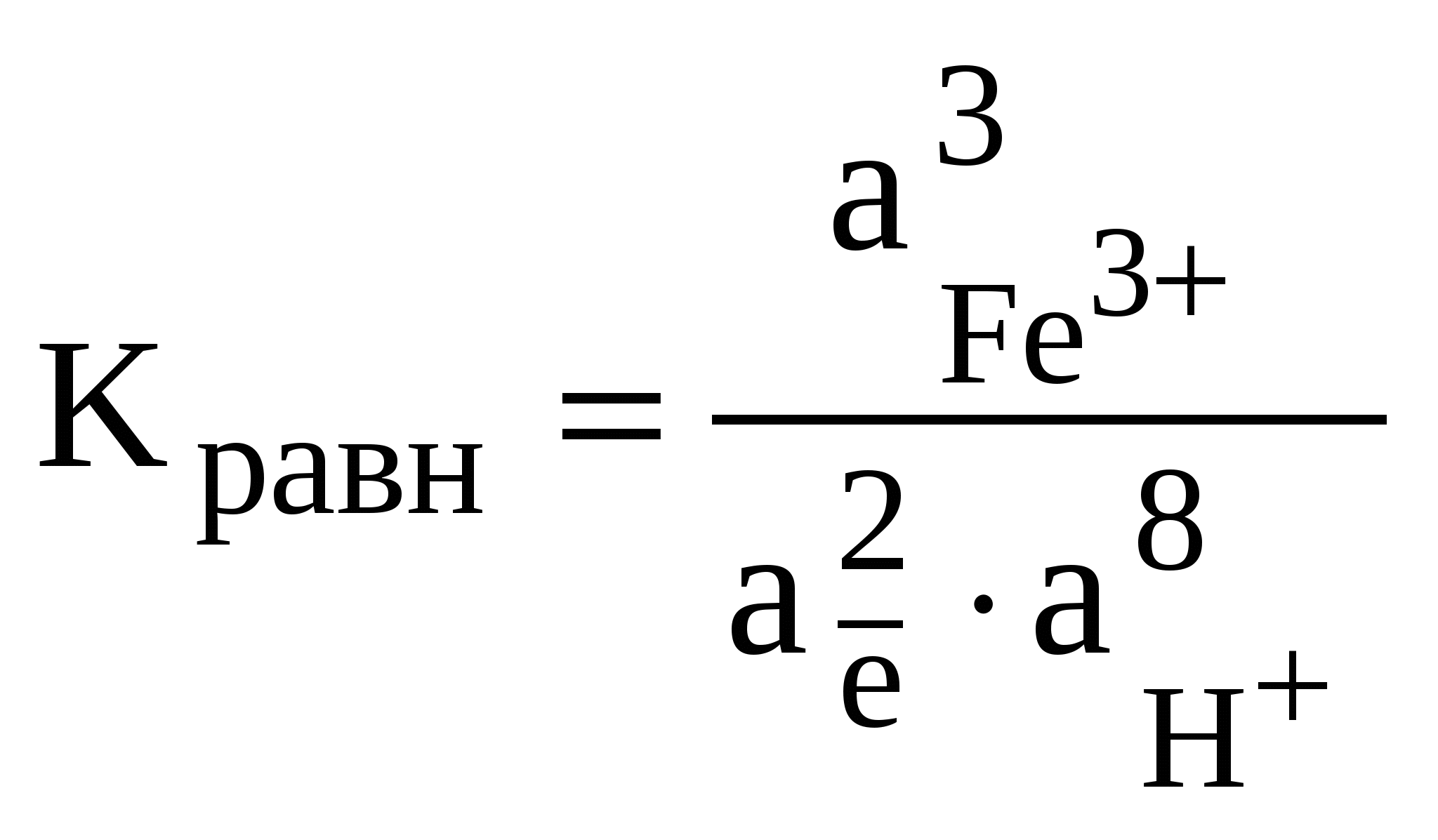 Вновь встает вопрос о выборе значения aFе2+. Если принять, что aFe2+ = aFe3+,то не нужно вычислять значение К, поскольку граница Fe2O3 – Fe3+ является прямой линией с тангенсом угла наклона, равным –3, проходящей через точку пересечения границ Fe2O3—Fe3+ и Fe3+—Fe2+. Однако при построении диаграмм рекомендуется все же вычислить Kравн и проверить, пройдет ли новая граница через точку пересечения двух других. Если три границы не встретятся в одной точке, это будет свидетельствовать об арифметической ошибке. Неточности в величинах энергии Гиббса привели бы к ошибочному положению точки пересечения, но точка в любом случае должна быть одна. Граница FезО4—Fe2+ описывается уравнением F  e3О4 + 2 e3О4 + 2Выражения для константы равновесия и 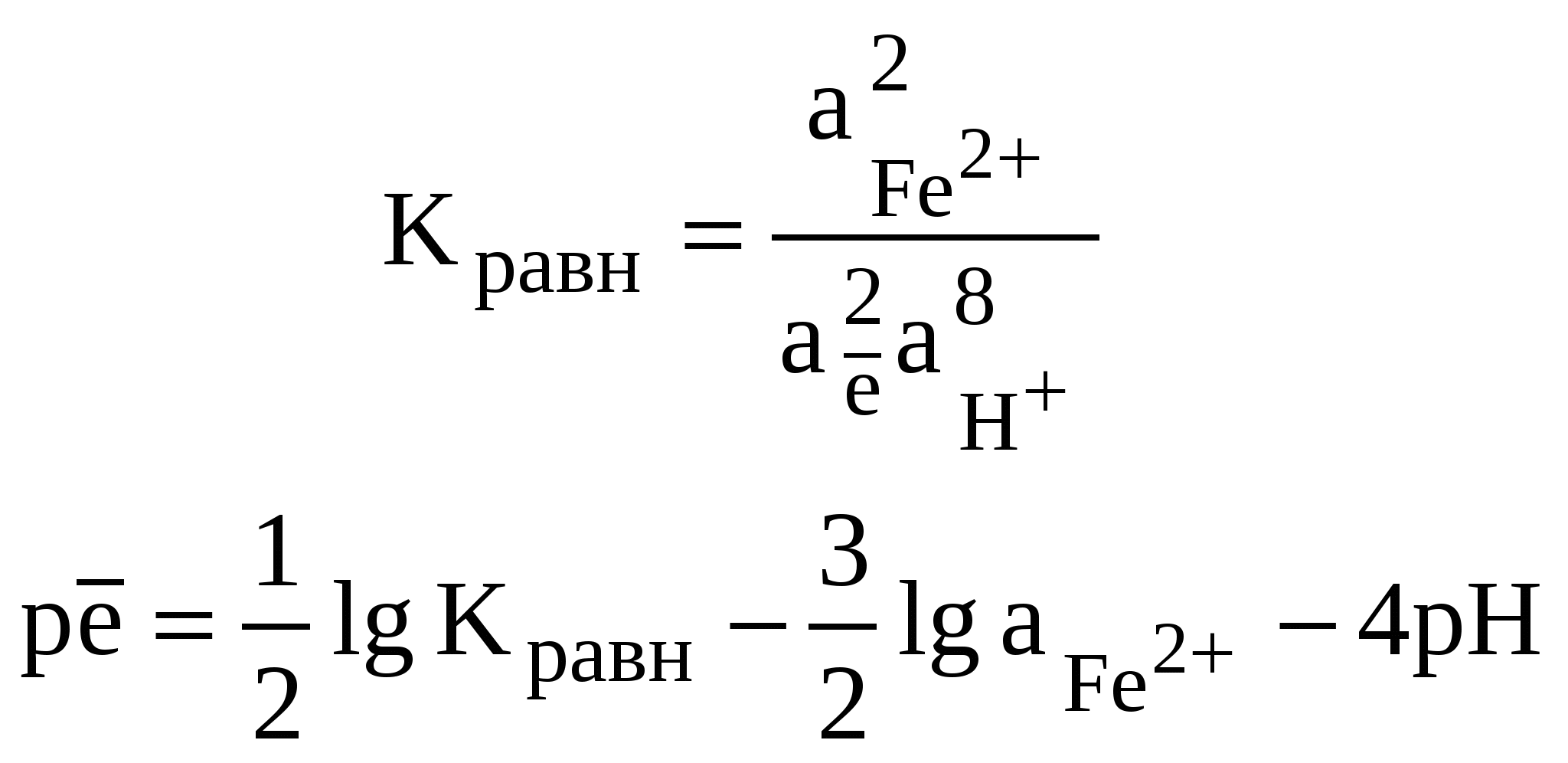 Вычисление Kравн не является необходимым, поскольку известен тангенс угла наклона (–4) и общая точка – пересечение границ Fe2O3—Fe2+ и Fe3O4—Fe2+. На рисунке 12 представлены в виде соответствующих отрезков прямых границы областей существования соединений железа в рассмотренной нами системе. Анализируя полученную диаграмму, можно сделать вывод о том, что Fe3+ является преобладающей формой только в крайне кислых средах, таких, например, которые имеют место в дренажных водах рудников. В щелочной среде железо должно быть нерастворимым при любых значениях Ответ: см. диаграмму на рисунке 12. Пример 21. На сколько единиц снизится редокс-уровень системы, определяемый верхней границей устойчивости воды, если парциальное давление кислорода в находящемся в равновесии с водой воздухе снизится с Р = 1 атм до: а) парциального давления, соответствующего средним значениям в приземном воздухе с относительной влажностью 90%, при температуре 298 К и общем давлении, равном 1 атм? б) в миллион раз? Какое значение будет иметь Решение. Верхняя граница устойчивости воды связана с возможностью протекания процесса ее окисления. Окислительно-восстановительная реакция, протекающая при этом, может быть представлена уравнением (81): 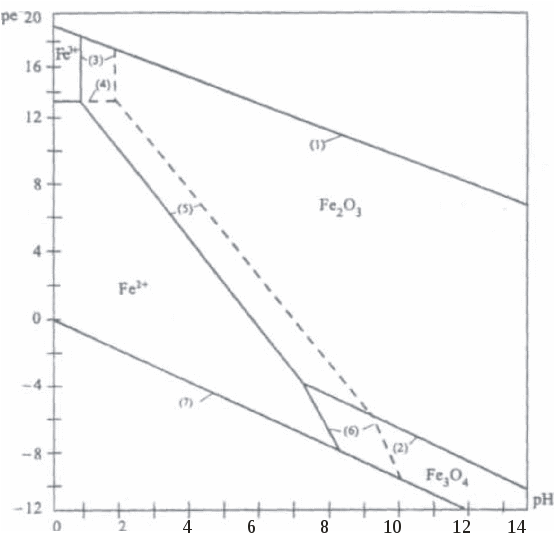 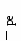  Рис. 12. Диаграмма На диаграмме (рисунок 12) пунктирной линией обозначены границы, соответствующие активности ионов железа в растворе aFe2+ = аFез+ = 10–9 моль/л. Цифры в скобках соответствуют номерам следующих химических реакций:
Зависимость величины редокс-потенциала системы от парциального давления кислорода в равновесном воздухе и от рН раствора описывается уравнением (87): При парциальном давлении кислорода, равном 1 атм, и рН 7 значение При относительной влажности 90% и температуре 298 К парциальное давление кислорода в приземном воздухе можно определить по уравнению: где Робщ и – относительная влажность воздуха; С При условиях а) рассматриваемого Примера Значение Для случая а) изменение В случае б) значение Для случая б) изменение Ответ: в случае а) редокс-уровень системы изменится на 0,2 единицы Пример 22. Какое парциальное давление кислорода должно соответствовать редокс-уровню системы, в которой протекает анаэроб-ный процесс восстановления диоксида углерода до метана ( Решение. При установлении равновесия в системе редокс-потенциалы всех окислительно-восстановительных реакций должны быть равны друг другу. Поэтому окислительно-восстановительный потенциал реакции, определяющей верхнюю границу устойчивости воды (уравнение 87), будет равен окислительно-восстановительному потенциалу реакции восстановления диоксида углерода: Из этого равенства легко найти lg Ответ: парциальное давление кислорода в воздухе Пример 23. Какое максимальное количество мг органических веществ общей формулой {СН2О} может быть окислено за счет растворенного кислорода (при высоких значениях Решение. Процесс окисления органического вещества общей формулой {СН2О} можно представить следующим уравнением реакции: {СН2О}+ O2 СО2 + Н2О. В связи с отсутствием по условию Примера, дополнительного поступления кислорода максимальное количество органического вещества, которое может быть окислено в воде, будет определяться содержанием кислорода в воде, которое, в свою очередь, будет соответствовать условиям равновесия с воздухом, устанавливающимся до начала процесса окисления. При равновесии с приземным воздухом это количество кислорода составит (уравнение 1): Парциальное давление кислорода для условий данного Примера составит (Пример 21): Концентрация растворенного кислорода в воде составит: = 2,63 . 10–4 (моль/л), или Количество органических соединений общей формулой {СН2О} (молярная масса которых равна 30 г/моль) можно определить по реакции окисления: mорг = Морг где Морг и mорг = 30 . 8,4/32 = 7,9 (мг/л). Ответ: в каждом литре воды может быть окислено не более 7,9 мг органических соединений общей формулой {СН2О}. Пример 24. Какой объем природной воды, находившейся в равновесии с атмосферным воздухом, необходимо взять, чтобы после окисления 10 г сахара (среднее количество в стакане чая) содержание кислорода в этой воде составляло более 4 мг/л (количество, при котором рыбы еще не погибают)? Принять, что содержание кислорода в атмосферном воздухе соответствовало средней для приземного воздуха концентрации, температура была равна 298 К, общее давление – 101,3 кПа, парциальное давление паров воды – 3,1 . 103Па. Сахар имеет молекулярную формулу С12Н22O11. Решение. Поскольку в растворе после окисления сахара, по условию Примера, остается растворенный кислород, процесс окисления протекает при высоких значениях окислительно-восстановительного уровня системы и может быть представлен следующим уравнением: С12Н22О11 + 12О2 12СО2 + 11Н2О. Количество кислорода (г), которое в этом случае потребуется для окисления сахара, составит: где 12 – количество молекул кислорода, необходимое для окисления одной молекулы сахара; mсахара – количество сахара, вступившего в реакцию окисления; По условию Примера, содержание кислорода в природной воде соответствует значениям, наблюдаемым при равновесии между водой и приземным воздухом. Эта величина составляет 8,4 мг/л. Поскольку, по условию Примера, остаточное содержание кислорода в воде не должно быть меньше 4 мг/л, на окисление сахара из каждого литра природной воды не должно расходоваться больше, чем где Определим минимальный объем природной воды, кислород из которой будет расходоваться на окисление сахара: Ответ: необходимо взять не менее 2500 л природной воды. Пример 25. Какой минимальный объем природной воды необходим для растворения сероводорода, образовавшегося при окислении 10 г сахара в процессе сульфат-редукции, если весь выделившийся сероводород переходит в раствор, в котором концентрация H2S не превышает значений подпороговой концентрации, определяемой по запаху (ППКорг = 0,05 мг/л)? Сахар имеет молекулярную формулу C12H22O11. Решение. В процессе сульфат-редукции при окислении органического вещества происходит образование сероводорода по реакции: 2Сopг + SO На каждые два моля углерода, связанных в органическое соединение, образуется молекула сероводорода. Количество молей углерода (NC), содержащихся в m г органических соединений, имеющих молярную массу Морг и содержащих n атомов углерода в каждой молекуле органического соединения, можно определить по уравнению: NC = mn/Mорг. (V = m/M) Для условий Примера количество молей углерода, содержащихся в 10 г сахара (молекулярная формула C12H22O11), составит: NС= 10 . 12/342 = 0,35 (молей). В процессе сульфат-редукции этого количества молей углерода может образоваться NH2S молей сероводорода: NH2S = 1/2NC= 0,175 (молей). Масса образующегося сероводорода составит: mH2S =NH2S MH2S mH2S = 0,175 . 34 . 103 = 5950 (мг). Объем природной воды, необходимый для растворения этого количества сероводорода при конечной концентрации ниже ППКорг, составит: V = mH2S/ППKоpr = 5950/0,05 = 120000(л) = 120 (м3). Ответ: необходимый минимальный объем природной воды равен 120 м3. |
