ПособФХпроцЧ.2ГидросфХОС05. Учебное пособие Физикохимические процессы в гидросфере
 Скачать 31.55 Mb. Скачать 31.55 Mb.
|
2. Способы классификации природных водОдин из самых распространенных способов классификации основан на различиях в общем количестве растворенных неорганических и частично растворенных органических веществ, содержащихся в природных водах. Общее количество растворенных веществ – минерализацию воды– принято определять по массе сухого остатка предварительно отфильтрованной и выпаренной пробы после высушивания до постоянной массы при температуре 105°С. В настоящее время по величине минерализации природные воды принято делить на восемь видов, или классов (таблицы 3). Таблица 3. Классификация природных вод по значению минерализации
Хорошая питьевая вода содержит не более 0,5 г/л солей. Но в некоторых районах для питья используют и воды, содержащие 1-3 г/л растворенных солей. Соленые воды с общей минерализацией 3-10 г/л пригодны только для некоторых видов домашних животных (овец, верблюдов). Ультрапресные воды обладают способностью выводить соединения кальция из организма человека, поэтому к их использованию для питья следует подходить с осторожностью. На различии преобладающих анионов и катионов основана классификация природных вод, предложенная О.А. Алекиным и названная его именем. В соответствии с этой классификацией все воды делятся по преобладающему аниону на три больших класса: карбонатные; сульфатные; хлоридные (рисунок 1). Класс гидрокарбонатных вод объединяет пресные и ультрапресные воды рек, озер и включает значительное количество подземных вод. Класс хлоридных вод объединяет воды морей, лиманов и подземные воды солончаковых районов. Сульфатные воды по распространению и минерализации занимают промежуточное положение между хлоридными и карбонатными водами. 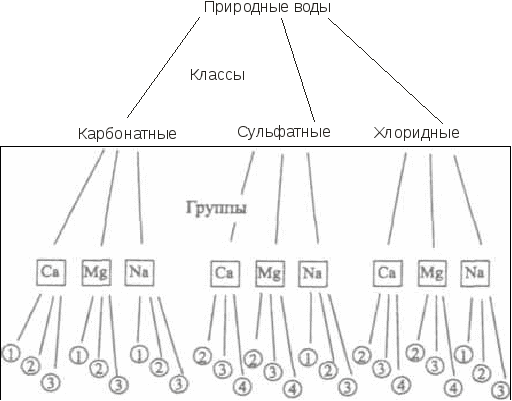 Рис. 1. Классификация природных вод по О.А. Алекину Каждый класс подразделяют на три группы по преобладающему катиону (кальциевая, магниевая и натриевая группы). Группы в свою очередь делятся на типы в соответствии с количественными характеристиками ионов и катионов. Так, к первому типу относятся воды, в которых концентрация анионов НСО [НСО Воды этого типа слабо минерализованы, для них характерен избыток гидрокарбонат-ионов. Воды второго типа характеризуются более высокой суммарной концентрацией гидрокарбонат- и сульфат-ионов, превышающей суммарную концентрацию катионов кальция и магния, которая в то же время является более высокой, чем концентрация одного гидрокарбонат-иона: [НСО К этому типу вод относятся подземные воды, а также воды рек и озер малой и средней минерализации. Для воды третьего типа характерна более высокая концентрация ионов хлора по сравнению с ионами натрия и, следовательно, суммарная концентрация катионов кальция и магния, превышающая суммарную концентрацию гидрокарбонат- и сульфат-ионов: [Сl–] > [Na+] или [Са2+] + [Mg2+] > [НСО Воды этого типа обычно сильно минерализованы. Четвертый тип вод характеризуется отсутствием гидрокарбонат-ионов. Воды этого типа являются кислыми и имеются только в классах хлоридных и сульфатных вод. Классификация О.А. Алекина, хотя и получила распространение, является далеко не единственной системой, учитывающей химический состав природных растворов, и не лишена существенных недостатков. Так, например, в ней не учитывается присутствие в природных водах растворимых органических соединений, общая концентрация которых в воде рек и озер иногда достигает 100 мг/л. В основном это гумусовые кислоты и их соли (продукты микробиологического разложения растительных и животных остатков), углеводороды, фенолы, белки, углеводы. Всего из осадочных пород, почв и вод выделено свыше 500 органических соединений. Во многом именно присутствием органических веществ обусловлен своеобразный цвет природных вод водоемов и рек. Однако основная роль, которую играют растворенные органические соединения в природных водах, связана не с окраской вод, а с процессами комплексообразования, оказывающими влияние на миграцию элементов. Рассмотренная выше классификация не учитывает также присутствия растворенных газов. Количество и природа растворенного газа оказывают существенное влияние на физико-химические процессы, протекающие в природных водоемах. Среди известных классификаций природных вод, отчасти лишенных этих недостатков, следует назвать системы, разработанные В.И. Вернадским и А. И. Перельманом. Так, классификация природных вод, разработанная В. И. Вернадским, является, пожалуй, одной из самых подробных. Все природные воды, по В. И. Вернадскому, следует разделить на три группы: воды в твердом состоянии, воды в газообразном состоянии, жидкая природная вода. В пределах групп он наметил деление на классы, «царства», «подцарства», семейства и виды. В. И. Вернадский выделял 480 видов вод, но писал, что их может быть и значительно больше (до 1500 видов). А.И. Перельман предложил обобщенную систему геохимической классификации природных вод, которая состоит из шести главных таксонов, каждый из которых определяется на основании особого критерия: – группа — температура; – тип — окислительно-восстановительные условия, основные растворенные газы; – класс — щелочно-кислотные условия; – семейство — общая минерализация; – род — растворенное органическое вещество; – вид — основные катионы и анионы (кроме Н+ и ОН–). Примеры решения задачПример 4. К какому классу вод по минерализации следует отнести природные воды, состав которых соответствует среднему составу речной воды. При оценке принять: а) другие примеси в воде отсутствуют; б) плотность речной воды равна 1000 г/л; в) при экспериментальном определении минерализации все гидрокарбонат-ионы перейдут в карбонат-ионы, а все остальные ионы образуют безводные соли, устойчивые при 105°С. Решение. По условию задачи состав природной воды соответствует среднему составу воды в реках. Содержание примесей в этой воде, как видно из таблицы 2, составляет (млн–1): Са2+ – 20; Na+ – 5,8; Mg2+ – 3,4; К+ – 2,1; HCO Значение минерализации природных вод определяется в г/л, поэтому необходимо выразить концентрации анионов и катионов в этих единицах. Поскольку плотность воды по условию задачи равна 1000 г/л, концентрации примесей, выраженные в млн–1, численно равны концентрациям, выраженным в мг/л. Поэтому, чтобы получить содержание примесей в г/л, достаточно умножить значение их содержания в млн–1 на 10–3: Сi(г/л) = 10–3 . Сi(млн–1). Содержание примесей в природной воде, выраженное в г/л, составит: Са2+ – 2,0 . 10-2; Na+ – 5,8 . 10-3; Mg2+ – 3,4 . 10-3; К+ – 2,1 . 10-3; HCO По условию задачи при определении минерализации ионы HCO 2HCO Образующиеся в этом процессе молекулы воды и диоксида углерода не вносят вклада в минерализацию, поскольку при 105°С переходят в газовую фазу. Концентрацию образующихся ионов CO [CO 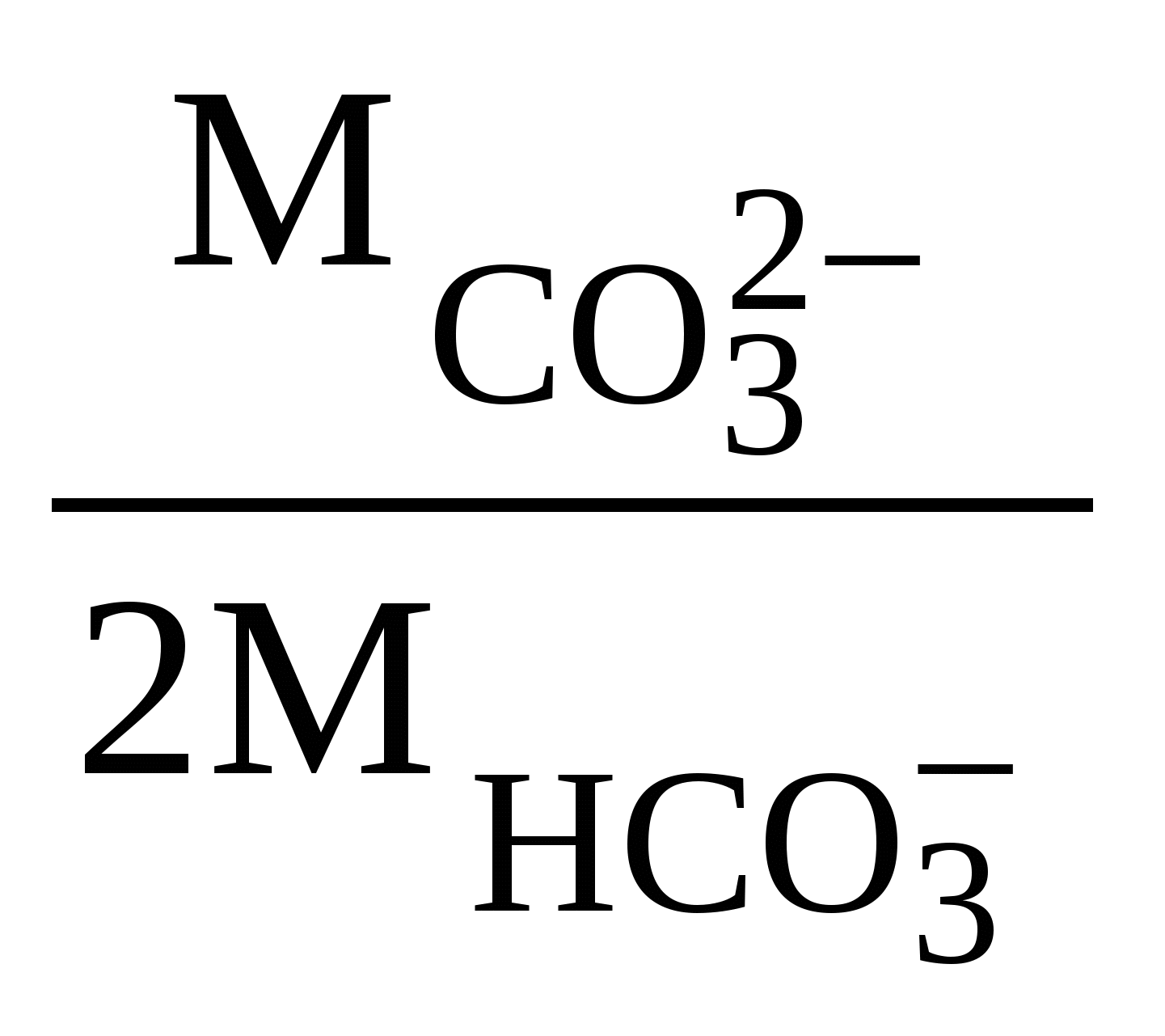 , ,где [CO Концентрация ионов CO [CO Поскольку по условию задачи все ионы, кроме HCO М = [CO М = 1,7 . 10–2 + 2,0 . 10–2 + 5,8 . 10–3 + 3,4 . 10–3 + 2,1 . 10–3 + + 1,2 . 10–2 + 5,7 . 10–3 = 6,6 . 10–2 (г/л). Поскольку полученное значение минерализации меньше 0,2 г/л, природные воды, отвечающие среднему составу речной воды, следует отнести к ультрапресным водам (таблица 3). Ответ: природные воды, отвечающие среднему составу речной воды, следует отнести к ультрапресным водам. Пример 5. Охарактеризуйте морскую воду в соответствии с классификацией, разработанной О.А. Алекиным. Решение. Преобладающим анионом в морской воде является анион хлора, поскольку его концентрация, выраженная в ммоль-экв./л, намного превосходит концентрации других анионов (Пример 2). Поэтому морские воды следует отнести к классу хлоридных вод. Преобладающим катионом в морской воде является катион натрия (Пример 2), поэтому эти воды следует отнести к группе натриевых вод. Для определения типа воды просуммируем концентрации катионов кальция и магния в морской воде, выраженные в ммоль-экв./л, и сравним сумму с концентрацией гидрокарбонат-иона: CCa2+ + CMg2+ = 10,0 + 45,3 = 55,3 ммоль-экв./л > СHCO = 2,3 ммоль-экв./л. Следовательно, морская вода не относится к первому типу вод. Сравним суммарную концентрацию анионов НСО C HCO = 55.3 ммоль-экв./л. Следовательно, морская вода не относится и ко второму типу вод. Сравним концентрации ионов хлора и натрия, выраженные в ммоль-экв./л: CCl– = 534,6 ммоль-экв./л > СNa+ = 459,1 ммоль-экв./л. Следовательно, морскую воду следует отнести к третьему типу вод. Ответ: по классификации О.А. Алекина морскую воду следует отнести к классу хлоридных вод натриевой группы третьего типа. |
