ПособФХпроцЧ.2ГидросфХОС05. Учебное пособие Физикохимические процессы в гидросфере
 Скачать 31.55 Mb. Скачать 31.55 Mb.
|
4. Кислотно-основное равновесие в природных водоемахВ соответствии с необходимостью соблюдения электронейтральности растворов в природных поверхностных водах выполняется равенство: [Na+]+[K+]+ 2[Са2+] + 2[Mg2+] + [Н+] = = [Сl–] + [НСО При отсутствии процессов растворения и образования новых фаз ионы Na+, К+, Са2+, Cl–, SO [Н+] = [НСО В этой связи изучению равновесий, возникающих в так называемой карбонатной системе, следует уделить особое внимание. 4.1. Карбонатная система и рН атмосферных осадковНеорганические соединения углерода, находящиеся в природных водах в виде производных угольной кислоты, тесно взаимосвязаны друг с другом и образуют карбонатную систему. В контакте с водой диоксид углерода растворяется до наступления равновесия:   CO2(r) СО2(p-p) + Н2О Н2СО3 (22) CO2(r) СО2(p-p) + Н2О Н2СО3 (22)Угольная кислота диссоциирует по первой ступени с образованием ионов водорода и гидрокарбоната: Н  2СО3 Н+ +НСО 2СО3 Н+ +НСОКонстанта равновесия этого процесса равна: K1 = 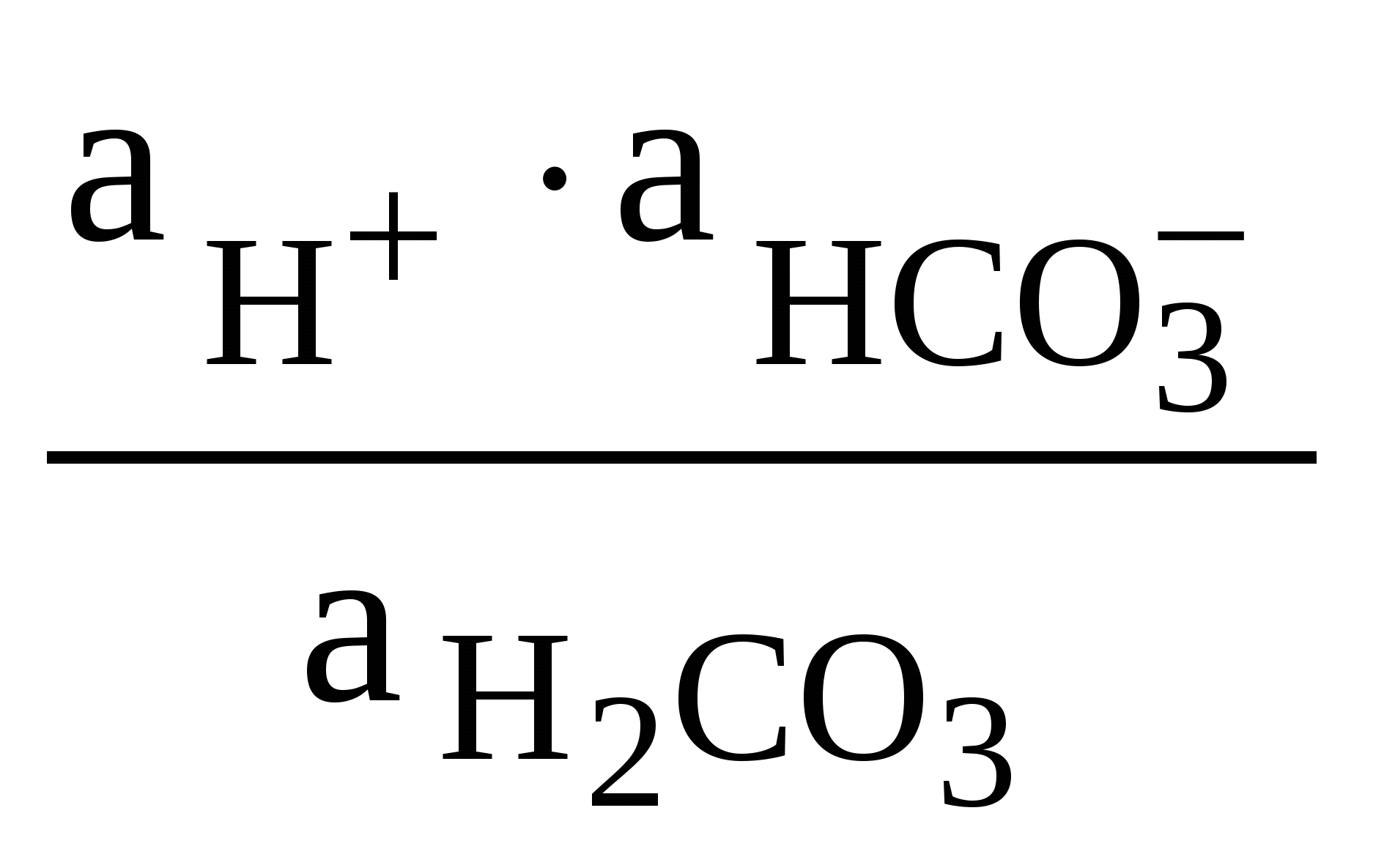 (24) (24)Диссоциация угольной кислоты по второй ступени протекает значительно слабее и приводит к появлению карбонат-ионов:  НСО НСОКонстанта диссоциации угольной кислоты по второй ступени имеет вид: K1 = 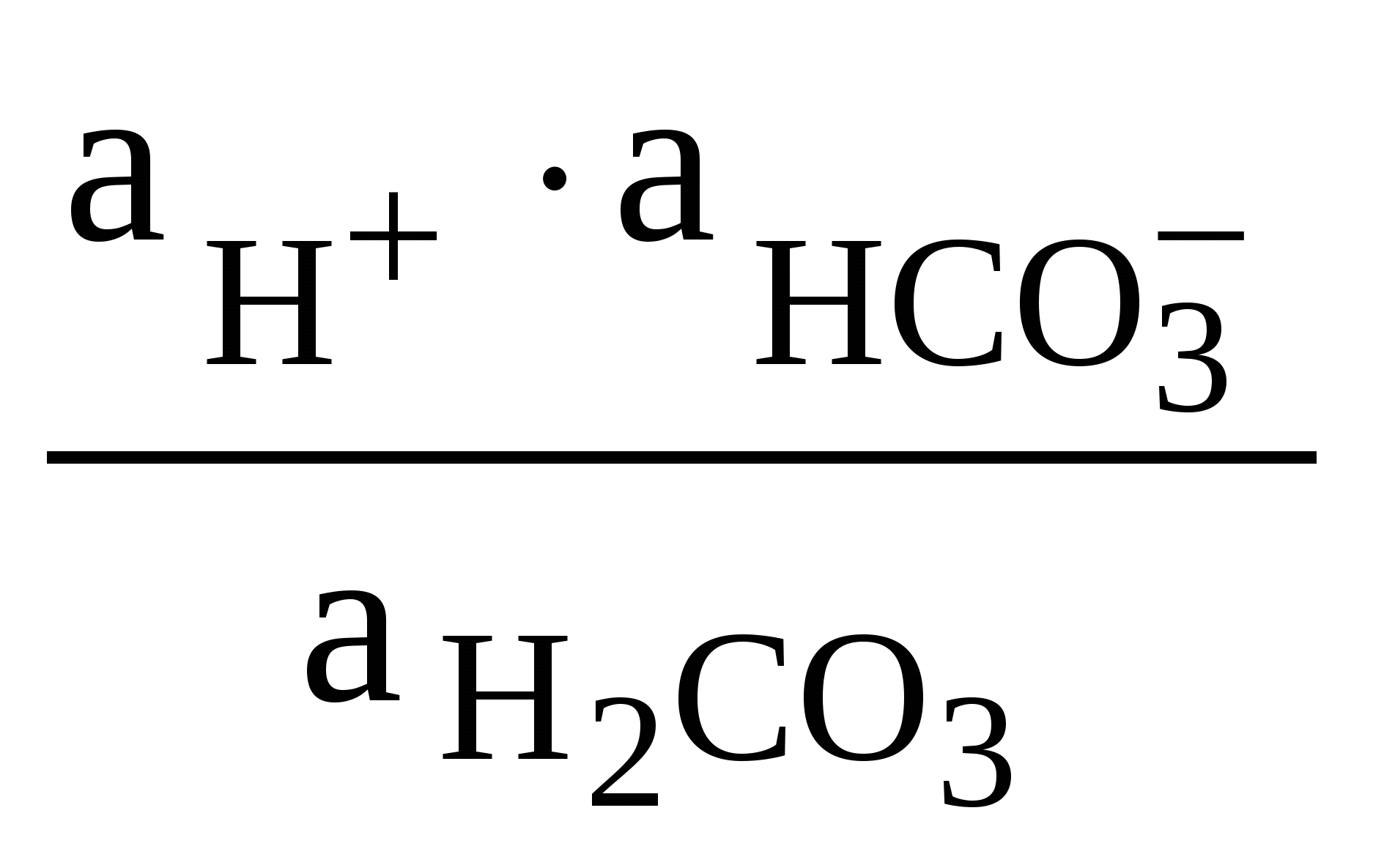 (26) (26)Если известна суммарная активность карбонатов и рН раствора, всегда можно вычислить активность каждого из компонентов карбонатной системы. Для ориентировочных расчетов удобно использовать распределительную диаграмму, которая представляет собой зависимость содержания в мольных долях компонентов карбонатной системы от величины рН раствора (рисунок 2). Метод построения распределительной диаграммы, который является общим для подобных систем (например, для системы, образующейся при растворении SО2 в воде), рассмотрен в Примере 11. 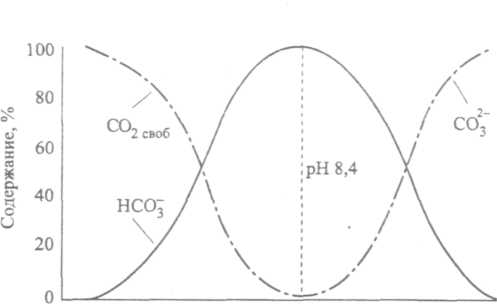 4 5 6 7 8 9 10 11 рН Рис. 2. Зависимость содержания отдельных компонентов карбонатной системы от рН раствора (распределительная диаграмма) Анализ уравнений (22-26), описывающих процесс растворения диоксида углерода в воде, позволяет вывести уравнение зависимости концентрации ионов водорода в растворе от парциального давления диоксида углерода в воздухе. Константа диссоциации угольной кислоты по второй ступени примерно на четыре порядка меньше, чем константа диссоциации по первой ступени (таблица 7 Приложения), поэтому при оценке влияния угольной кислоты на значение рН атмосферных осадков процесс диссоциации по второй ступени можно не принимать во внимание. При диссоциации угольной кислоты по первой ступени (уравнение 23) концентрации образующихся гидрокарбонат-ионов и ионов водорода равны между собой: [Н+] = [HCO К1 = [Н+]2/[Н2СО3] Учитывая малую долю недиссоциированной угольной кислоты в растворе (не более 1% суммы концентраций СО2 + H2CO3) и значительные трудности разделения этих двух составляющих при экспериментальном определении их концентраций в растворе, под концентрацией Н2СОз обычно подразумевают концентрацию растворенного диоксида углерода, которая в соответствии с законом Генри равна: [CO2]p-p=Kг(CO где [СО2]p-p – концентрация растворенного диоксида углерода, моль/л; Kг(СО2) – константа Генри для углекислого газа, моль/(л . Па) или моль/(л . атм); РСО2– парциальное давление диоксида углерода в воздухе (Па или атм). Учитывая это, уравнение (27) можно представить в виде: К1 = [Н+]2/[Н2СО3] = [Н+]2/[СО2]р-р; К1 = [Н+]2/(КГ (СО2) РСО2). (29) Из уравнения (29) легко вывести зависимость концентрации ионов водорода в растворе от парциального давления диоксида углерода в атмосферном воздухе: [H+] = (K1КГ (СО2) РСО2)1/2. (30) Отсюда легко найти рН раствора, находящегося в контакте с воздухом, содержащим диоксид углерода: рН = –lg[H+] = –lg(K1КГ (СО2) РСО2)1/2. (31) Необходимо отметить, что подходы к оценке значения рН при равновесии для процессов растворения таких газов, как, например, СO2, SO2, NH3, в воде, не содержащей других примесей, являются общими. Поэтому уравнение (31) может быть использовано для оценки рН атмосферных осадков, когда в воздухе присутствуют диоксид углерода, диоксид серы, аммиак или другие газы и их смеси, поскольку в этом случае в растворе практически отсутствуют источники примесей, способных повлиять на рассмотренные равновесия. Оценки, проведенные для растворов, образующихся при контакте с водой воздуха, содержащего 0,035%(об.) диоксида углерода и не содержащего других кислых газов, показывают, что рН образующегося раствора будет равен 5,7. Поскольку такое содержание диоксида углерода отвечает средним значениям, характерным в последнее время для атмосферного воздуха, следует ожидать, что рН атмосферных осадков в случае отсутствия других кислых газов и аммиака будет около 5,7 (Пример 12). В реальных условиях рН атмосферных осадков зависит от степени загрязнения атмосферного воздуха и изменяется как в меньшую, так и в большую сторону (Пример 13). В некоторых района Земли в настоящее время выпадают преимущественно осадки с рН < 5,7; такие осадки называют кислотными, часто употребляется термин «кислотные дожди». Основной вклад в кислотность таких осадков (до 80%) вносят соединения серы, около 15% приходится на соединения азота и до 5% кислотности атмосферных осадков связывают с соединениями хлора. |
