ПособФХпроцЧ.2ГидросфХОС05. Учебное пособие Физикохимические процессы в гидросфере
 Скачать 31.55 Mb. Скачать 31.55 Mb.
|
4.3. Карбонатное равновесие в океанеНеорганические соединения углерода в морской воде представлены, как и в случае пресных поверхностных и глубинных вод, диоксидом углерода и ионами НСО Таблица 5. Коэффициенты активности ионов НСО
Для воды океана величина ионной силы может быть определена как функция хлорности: I = 0,0147 + 0,03592 . С1%о + 0,000068 . (С1%о)2, (45) где I – ионная сила раствора; Cl%o –величина хлорности воды в промилле. При расчетах карбонатных равновесий для морской воды следует использовать данные об активности ионов. Коэффициенты активности ионов НСО 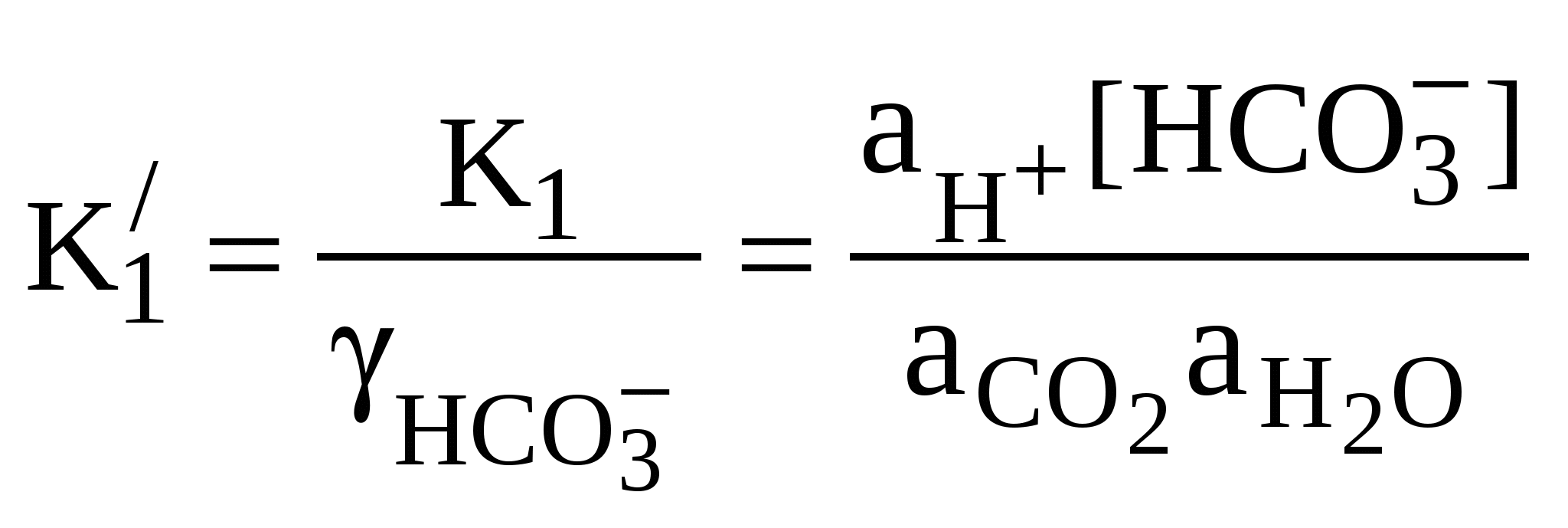 ; (46) ; (46)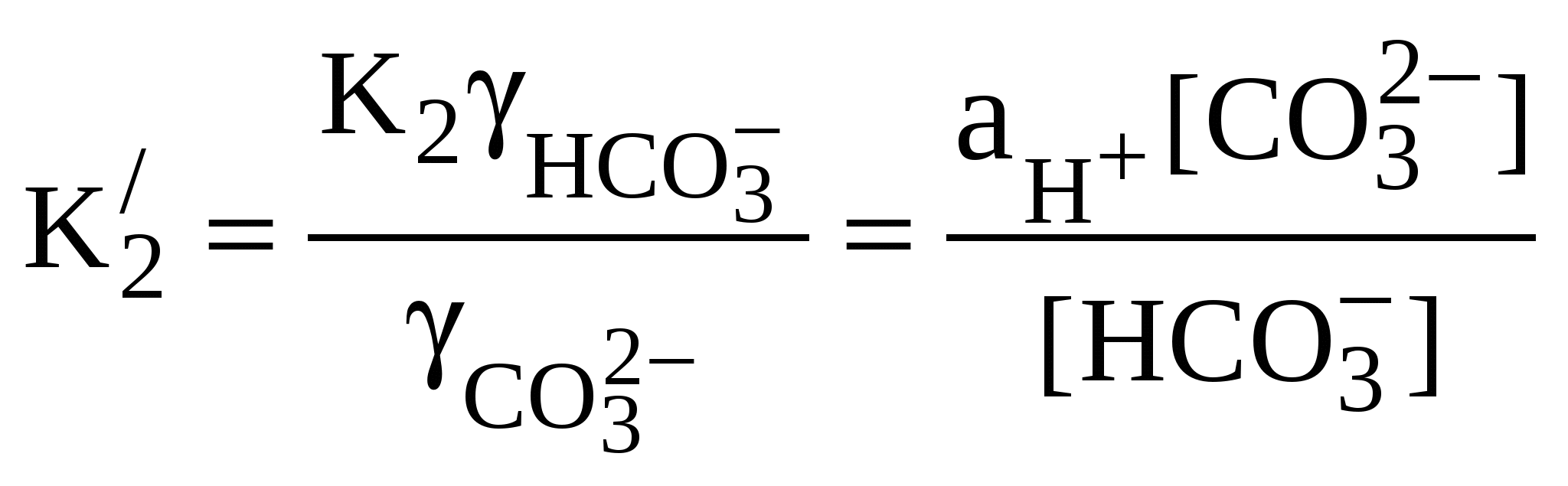 , (47) , (47)где К1 и К2 – термодинамические константы диссоциации. В отличие от термодинамических констант, смешанные константы диссоциации угольной кислоты зависят от солености и хлорности морской воды. Их использование позволяет избежать необходимости введения коэффициентов активности, так как они уже учтены при экспериментальном определении констант. При различных хлорности и температуре воды значения констант диссоциации угольной кислоты по первой и второй ступеням могут быть найдены, например, по уравнениям: Протекание процессом растворения или осаждения СаСО3 в рассматриваемой карбонатной системе океана зависит, помимо парциального давления СO2 и температуры, от солености воды и величины гидростатического давления. В океанах создается весьма неоднородное распределение насыщенности воды карбонатом кальция; по глубине обычно выделяют четыре зоны с различной степенью насыщения воды карбонатами. Первая зона – поверхностный слой воды до глубины 300-800 м – значительно пересыщена. Этому способствуют сравнительно высокие температуры и низкие парциальные давления диоксида углерода. Вторая зона охватывает слой глубиной до 1500-2000 м. В связи с интенсификацией процесса окисления органического вещества в этой зоне происходит увеличение Рсо2 и может возникнуть недонасыщение карбонатом кальция. Третья зона (до 3500-4500 м) отличается состоянием, близким к равновесному. Четвертая зона (от 3500-4500 м до дна) характеризуется ярко выраженным недонасыщением воды карбонатом кальция, связанным с ростом гидростатического давления. | |||||||||||||||||||||||||||
