ПособФХпроцЧ.2ГидросфХОС05. Учебное пособие Физикохимические процессы в гидросфере
 Скачать 31.55 Mb. Скачать 31.55 Mb.
|
3. Основные процессы формирования химического составаприродных водПри формировании химического состава природных вод принято выделять прямые и косвенные, а также главные и второстепенные факторы, влияющие на содержание в них растворенных компонентов. Прямыминазывают факторы, которые оказывают непосредственное влияние на химический состав воды и связаны с химическим составом контактирующих с данной природной водой веществ (минералов, горных пород, почв и др.). Косвенныефакторы оказывают влияние на состав природных вод через посредство прямых факторов; к ним относятся температура, давление и др. Главныефакторы определяют содержание главных анионов и катионов (т. е. класс и тип воды по классификации О.А. Алекина). Второстепенныефакторы вызывают появление некоторых особенностей данной воды (цвета, запаха и др.), но не влияют на ее класс и тип. По характеру воздействия на формирование состава природных вод все факторы делят на 5 групп:
3.1. Процессы растворения газов в природных водахКогда идеальный газ находится в равновесии с растворителем, то количество газа, которое растворено, пропорционально парциальному давлению данного газа. Это утверждение, которое известно как закон Генри, может быть записано математически следующим образом: Сi,р-р = КГiРi, (1) гдеСi,р-р– концентрация i-й примеси в растворе, моль/л; КГi – константа Генри для данной температуры раствора, моль/(л . Па) или моль/(л-атм); Рi – парциальное давление i-й примеси в газовой фазе, находящейся в равновесии с раствором, Па или атм. Простой иллюстрацией закона Генри, с которой можно столкнуться в повседневной жизни, является поведение газированного напитка. Газированный напиток приготовлен растворением СО2 при давлении около 2 атм. Не заполненное жидкостью пространство в бутылке содержит СО2 под этим давлением. Когда газированный напиток открыт и находится в контакте с воздухом, где парциальное давление диоксида углерода значительно ниже, то равновесие нарушается, и СО2 выходит из раствора (этот процесс сопровождается шипением напитка). При нагревании растворов растворимость в них газов понижается. Из изменения КГi п с температурой можно вывести основной термодинамический принцип, управляющий растворением газов, а именно: переход из газообразного состояния в растворенное – процесс, для которого Н0и S0являются отрицательными величинами. Растворенное состояние более упорядоченно, чем газ. Повышение температуры, таким образом, способствует переходу растворенных газов в газообразное состояние (–TS0 для растворения становится более положительным). Практическое следствие, например, – это выделение растворенных летучих соединений из горячей воды и их накопление в закрытых душевых кабинках (например, радона или летучих органических соединений – таких, как трихлорэтилен). С этим явлением связано и уменьшение содержания кислорода в верхнем слое воды рек и озер в жаркие летние дни. Поэтому крупные рыбы в летние дни чаще находятся на глубине, где температура ниже и равновесное содержание кислорода выше. Некоторое понижение температуры рек и увеличение интенсивности обмена между воздухом атмосферы и речной водой происходит, как известно, на перекатах и речных порогах. Поэтому эти места более привлекательны для рыб и известны опытным рыболовам. 3.2. Процессы растворения твердых веществ в природных водахДля описания процессов взаимодействия между твердыми веществами и природными водами в настоящее время широко используются методы равновесной термодинамики. В общем виде такое взаимодействие можно представить уравнением 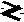 aA + bB cC + dD (2) aA + bB cC + dD (2)Константа равновесия этого процесса может быть определена из уравнения 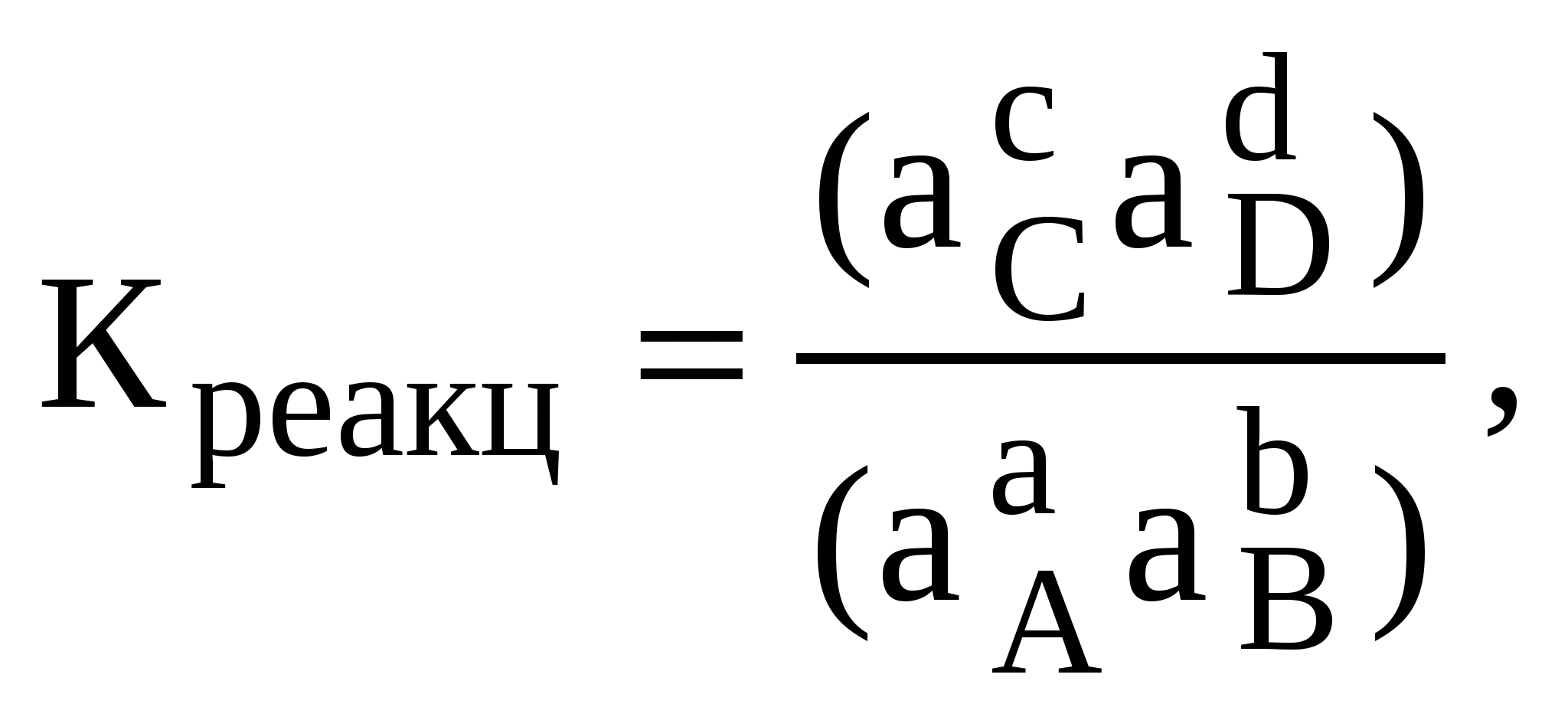 (3) (3)где Креакц – константа равновесия процесса растворения; ai– активность продуктов и реагентов при установлении равновесия в степени, соответствующей их стехиометрическому коэффициенту. Численное значение константы равновесия в стандартных условиях (температура 298К, давление 101,3 кПа) может быть определено через величину энергии Гиббса реакции, которая, в свою очередь, может быть легко рассчитана по разности между суммой энергий Гиббса образования из простых веществ продуктов реакции и суммой энергий Гиббса образования реагентов, для стандартных условий: где R– универсальная газовая постоянная, Дж/(моль . К); Т0 – температура при стандартных условиях, 298 К); 2,3 – коэффициент перехода от значения в натуральных логарифмах к значению в десятичных логарифмах. Значения энергии Гиббса образования ионов и молекул широко представлены в справочной литературе, некоторые из них приводятся в таблице 1 Приложения. Основными факторами, оказывающими влияние на значение константы равновесия процесса растворения, являются температура и давление. Значение константы равновесия при температуре, отличающейся от стандартных условий, может быть определено по уравнению где К0, Т0 и К1, Т1– константы равновесия и температуры реакций в стандартных и рассматриваемых условиях соответственно; Нреакц – значение энтальпии реакции, равное разности между суммой энтальпий продуктов и суммой энтальпий реагентов; R – универсальная газовая постоянная. Для большинства реакций растворения, протекающих в природных условиях, Нреакц меняется в пределах от –20 до +20 кДж/моль. При таких изменениях энтальпии реакции для температуры 338 К, которая представляется максимальной для большинства поверхностных вод, логарифм отношения констант равновесия будет изменяться примерно от –4 до +4: –4 Таким образом, для большинства реакций растворения, протекающих в поверхностных водах, максимальное изменение константы равновесия может составлять от 0,4 до 2,5 от соответствующего значения К0: 0,4К0 Такие изменения константы равновесия представляются значительными, поэтому при оценке растворимости твердых веществ в природных условиях необходимо учитывать влияние температуры на процесс растворения. Влияние давления на значение константы равновесия можно оценить по уравнению: где К1и К0– константы равновесия при общем давлении Р и 1 атм соответственно; V – изменение молярного объема в процессереакции, см3/моль; R – универсальная газовая постоянная, см3 . атм/(град . моль); Т0 – значение температуры при стандартных условиях, 298 К. Для большинства процессов растворения твердых соединений в природных условиях изменение молярного объема не превышает 40 см3/моль. Поэтому при увеличении давления до 100 атм логарифм отношения констант равновесия будет равен примерно: lg(K1/K0) 0,07. (7) В этом случае значение константы равновесия будет отличаться от значения константы равновесия при стандартных условиях примерно на 17%. Следовательно, влияние давления на процесс растворения твердых веществ в природных водах целесообразно учитывать для подземных вод и глубинных вод океанов и морей лишь тогда, когда давление в системе вода – порода значительно превышает атмосферное. Важными характеристиками природных вод и твердых веществ при рассмотрении процессов растворения являются часто используемые в зарубежной литературе показатели агрессивности и неустойчивости. Показатель агрессивностиприродных вод характеризует способность данной воды перевести твердое вещество в раствор. Численное значение показателя агрессивности по отношению к данному веществу определяется величиной логарифма отношения константы равновесия к частному от деления произведения активности ионов (продуктов), образующихся в процессе растворения и содержащихся в данной воде, на произведение активности реагентов, содержащихся в растворяемом веществе: где А – показатель агрессивности воды; К – константа равновесия процесса растворения данного вещества; ПА – произведение активностей продуктов реакции, содержащихся в данной воде, и реагентов, содержащихся в растворяемом веществе, соответственно. Показатель агрессивности воды часто используют для сравнения растворяющей способности природных вод. Чем больше 4, тем в большей степени система неравновесна и тем более интенсивно протекает процесс растворения данного вещества. Показатель неустойчивостихарактеризует степень удаленности системы от состояния равновесия. Этот показатель удобно использовать при сравнении устойчивости различных твердых веществ по отношению к одной и той же природной воде. Чем больше значение показателя неустойчивости, тем данное вещество менее устойчиво. Показатель неустойчивости I по численному значению равен показателю агрессивности, взятому с обратным знаком: I = –A. (9) Эта величина может быть рассчитана по уравнению В случае, который достаточно часто встречается в природных условиях, когда растворяется чистое твердое вещество, активность которого может быть принята равной единице, а в водном растворе содержатся только ионы и молекулы Н2О, описание процесса упрощается. Уравнение процесса растворения в этом случае можно представить уравнением АaBb = aA+b + bB–a. (11) Константа равновесия в этом случае равна произведению активностей образующихся ионов в степенях, соответствующих их стехиометрическим коэффициентам: Для определения направления процессов растворения или осаждения в этом случае удобно использовать показатель степени неравновесности: где (ПА)прод – произведение активностей ионов в растворе; Кравн – константа равновесия процесса растворения. Степень неравновесности характеризует ненасыщенность ( Константы равновесия процессов растворения, как уже отмечалось выше (уравнение 4), являются величинами, определяемыми термодинамическими параметрами системы. Они связаны соответствующими зависимостями с активностью продуктов процесса растворения (уравнения 3 и 12), поэтому могут быть использованы для определения концентрации соответствующих примесей лишь в any чае бесконечно разбавленных растворов, когда коэффициенты активности всех компонентов равны единице. Для оценки концентрации примесей в растворе часто используют понятие произведения растворимости (ПР), которое для процесса, представленного уравнением (11), будет иметь вид: ПР = [А+b]а[В–а]b, (14) где [А+Ь]а и [В-а]b – концентрации ионов в растворе (моль/л) в степени, соответствующей стехиометрическому коэффициенту реакции (11). Произведение растворимости и константа равновесия процесса растворения связаны между собой. Так, для реакции (11) эту связь можно представить уравнением ПР = Kравн/( где Значения коэффициентов активности ионов можно рассчитать по уравнениям Дебая – Хюккеля или по уравнению где Аи В– константы, зависящие от температуры и давления; а– константа, характеризующая радиус гидратированного иона (зависит от природы иона); I – ионная сила раствора, которая равна где Сi– концентрации ионов, присутствующих в растворе; zi – заряды соответствующих ионов. Значения коэффициентов А. В и а приводятся в справочной литературе, некоторые из них представлены в таблица 8 Приложения. |
