ПособФХпроцЧ.2ГидросфХОС05. Учебное пособие Физикохимические процессы в гидросфере
 Скачать 31.55 Mb. Скачать 31.55 Mb.
|
5.2. Взаимосвязь между окислительно-восстановительнымии кислотно-основными характеристиками природных водПеренос электрона в редокс-процессе сопровождается переносом протона, обусловливая тем самым для реакций, протекающих в водном растворе, жесткую взаимосвязь между окислительно-восстановитель-ным и кислотно-основным равновесием. Например, если ион Fe(II) отдает электрон, то выделяются три иона водорода, что приводит в конечном результате к образованию труднорастворимого гидроксида железа (III) и увеличению концентрации ионов водорода в растворе: [  Fe(H2O)6]2+ Fe(OH)3 + 3Н2О + 3Н+ + Fe(H2O)6]2+ Fe(OH)3 + 3Н2О + 3Н+ + Протеканием этой реакции объясняется кислый характер шахтных вод и образование характерного осадка «ржавчины» в местах выхода на поверхность подземных вод, содержащих ионы двухвалентного железа. Величина окислительно-восстановительного потенциала реакций, протекающих с участием ионов водорода или гидроксила, зависит от рН раствора. Одной из форм представления таких зависимостей являются диаграммы Рассмотрим принципы построения диаграммы Вода может окисляться 2Н2О О2 + 4Н+ + 4 либо восстанавливаться: 2Н2О + 2 Реакции (79) и (80) определяют пределы изменения Перепишем уравнение (79) в виде: Константу равновесия этой реакции можно представить уравнением: В качестве граничных условий при описании пределов устойчивости воды обычно принимают давление кислорода 101 кПа (1 атм), при этом Р(кисл) = 1. Активность воды также можно принять равной единице. В этом случае уравнение (82) можно представить в виде: Прологарифмировав уравнение (2.83), умножим его левую и правую части на минус единицу; заменив выражения отрицательных логарифмов активности электронов и ионов водорода на Величину логарифма константы равновесия этой реакции легко найти из значения энергии Гиббса образования молекул воды, поскольку Gобразования кислорода, ионов водорода и электронов по термодинамическим конвенциям принимаются равными нулю, поэтому lg К = Отсюда зависимость В общем случае получим: Уравнение (87) определяет окислительную границу устойчивости воды. При заданном значении рН для воды, находящейся в равновесии с атмосферным кислородом, ( Путем аналогичных рассуждений можно получить зависимость  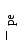 Рис. 4. Зависимость окислительно-восстановительного потенциала (для различных природных вод) и пределов устойчивости воды от рН Поскольку Gреакции (88) равно нулю, то и значение логарифма константы равновесия этой реакции равно нулю. Поэтому при граничных условиях, когда парциальное давление водорода равно 1 атм, получаем уравнение: Природные воды обычно находятся в контакте с воздухом, в котором парциальные давления кислорода и водорода меньше 1 атм, поэтому их окислительно-восстановительные потенциалы будут находиться в интервале значений, определяемых уравнениями (86) и (91). На рисунке 4 представлены зависимости величины Диаграммы Как уже отмечалось выше, в реальных природных водах окислительно-восстановительные процессы протекают при участии бактерий. В каждой из окислительно-восстановительных реакций участвует свой тип бактерий, и реакции протекают в строгой последовательности. Раньше протекают реакции, обеспечивающие бактериям наибольшую энергию, т. е. те реакции, для которых в данных условиях окислительно-восстановительный потенциал имеет наибольшее значение. Поэтому при построении обобщающих |
