ПособФХпроцЧ.2ГидросфХОС05. Учебное пособие Физикохимические процессы в гидросфере
 Скачать 31.55 Mb. Скачать 31.55 Mb.
|
5.3. Редокс-буферность природных водНаряду с редокс-уровнем Анализ зависимости величины окислительно-восстановительного потенциала от рН раствора и от парциального давления кислорода в равновесном воздухе показывает, что редокс-уровень системы слабо зависит от содержания кислорода в воздухе. Пока в системе есть свободный кислород, величина O  2 + 2 H + + 2 2 + 2 H + + 2H  2O2 + 2Н+ + 2 2O2 + 2Н+ + 2Лимитирующей при этом является реакция (92). Значение ре этой реакции при рН 7 равно 4,5. в то время как Однако если контакт природных вод с воздухом, содержащим кислород, будет нарушен, достаточно быстро может резко измениться редокс-состояние воды. Как показано в Примере 23, в случае отсутствия поступления кислорода при температуре 298 К в воде может быть окислено не более 7,9 мг/л органических веществ, если их молекулярную формулу принять как {СН2О}. При этом весь кислород будет израсходован. В случае, если восстановители, например органические соединения, продолжают поступать, в системе начинают происходить окислительно-восстановительные реакции без участия кислорода. При этом редокс-уровень системы снизится. Рассмотрим реакции, наиболее важные с точки зрения редокс-буферности и состояния водных экосистем в целом. Денитрификация. Роль реакции состоит в превращении нитрата (важного компонента питания) в биологически инертный молекулярный азот. При этом бактерии используют для окисления органического вещества до СО2 кислород нитратных ионов: 2,5Cоpr + 2NO В процессе динитрификации помимо азота могут образоваться гемиоксид, оксид и диоксид азота, которые играют важную роль в процессах, протекающих в тропосфере (оксид и диоксид азота) и стратосфере (гемиоксид азота). В то же время, поскольку концентрация нитрат-ионов в природных водах достаточно низкая (исключение могут составлять лишь почвенные воды), эти ионы не оказывают влияния на редокс-буферность природных вод. Восстановление сульфатов, или сульфат-редукция. Это реакции, в которых бактерии используют для окисления органического вещества кислород сульфатных ионов, образуя в качестве продуктов жизнедеятельности сульфидные формы: 2Cоpr + SO Если рН воды выше 7, образуется главным образом ион HS–, а в присутствии любых способных к реакциям соединений железа сульфидные формы будут реагировать с ними, образуя осадки в виде сульфидов. Восстановление сульфатов оказывает существенное влияние на состояние экосистем водоемов. Для большинства компонентов флоры и фауны H2S является высокотоксичным. Превращение оксидов железа в сульфиды обычно вызывает изменение цвета воды от красноватого или коричневатого до черного или серого. Вещества, сорбированные ранее на гидроксиде Fe(III) (например, ионы тяжелых металлов или фосфат-ионы), будут выделяться в раствор. При этом многие тяжелые металлы (например, Си, Zn, Mo, Pb, Hg), которые в окисленных водах были представлены относительно растворимыми соединениями (при не очень высоких рН), образуют малорастворимые сульфиды. Поскольку сульфат-ионы относятся к главным ионам природных вод, имеют широкое распространение и содержатся в природных йодах во многих случаях в достаточно больших концентрациях, oни способны на некоторое время стабилизировать редокс-уровень системы, несмотря на возможное поступление восстановителей. При этом системы будет отрицательным, поскольку при рН 7 для реакции (94) Ферментация. Протекающий при участии микроорганизмов процесс разрушения органических веществ приводит к появлению новых, более простых органических соединений. Брутто-уравнение бактериальной ферментации выглядит следующим образом: [Органическое соединение А] [органическое соединение В] + СО2 (96) Самой простой и одной in наиболее важных реакций этого типа является образование метана: Сорг + 2Н2О СО2 +СН4. (97) Процессы ферментации протекают при значениях 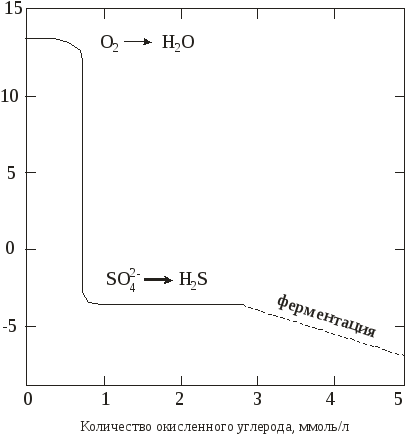 Количество окисленного углерода, моль/л Рис. 5. Изменение (исходные значения [O2] = 10 мг/л, [SO в зависимости от концентрации разложившегося органического вещества (в пересчете на углерод) при рН 7. На рисунке 5 представлена зависимость изменения редокс-уровня системы в зависимости от количества поступающих в нее восстановителей (Сорг), которая наглядно демонстрирует уровни, отвечающие «забуференным» состояниям, характерным для большинства природных вод. Предполагается, что вода первоначально была в равновесии с атмосферным кислородом, но дополнительное поступление кислорода в процессе разложения – органического вещества отсутствовало. Кроме того, реакции, включающие соединения азота, создают лишь небольшую буферность между уровнями О2/Н2О и SO Обычно значения    Количество окисленного углерода, усл. ед. Рис. 6. Изменение в зависимости от концентрации разложившегося органического вещества; рН = const = 7 В подземных водах, находящихся в контакте с осадками, редокс-реакции с участием твердой фазы могут также «забуферивать» Хотя восстанавливающим агентом в природных водах обычно является органическое вещество, снижение |
