|
|
Учение о растворах,расчетные задачи на приготовление растворов различных концентраций
Вопросы и задания для самоподготовки
(обязательные домашние задания, выполняемые в отдельной тетради)
Понятие скорости химической реакции
Влияние концентрации реагирующих веществ на скорость реакции. ЗДМ
Влияние температуры. Правило Вант-Гоффа. Уравнение Аррениуса
Зависимость скорости реакции от катализатора
Энергия активации, активированные молекулы
Молекулярность и порядок реакции
Типы катализа и механизм действия катализаторов
Какие реакции называются необратимыми? Сформулируйте условия практической необратимости реакции
Размерность величины скорости химической реакции
Перечислить факторы, влияющие на скорость химической реакции. Примеры.
Сформулируйте закон действия масс
Какой физический смысл имеет константа скорости химической реакции?
Что такое температурный коэффициент реакции?
Скорость реакции между растворами хлорида калия и нитрата серебра, концентрации которых составляют 0,2 и 0,3 моль/л соответственно, а 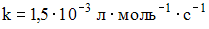 , равна ________ моль·л–1·с–1. , равна ________ моль·л–1·с–1.
1) 9·10–3 2) 9·10–4 3) 9·10–5 4) 9·10–6
Значение концентрации исходных веществ, при которых скорость элементарной гомогенной реакции 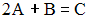 численно равна константе скорости, составляет _____ моль/л. 1 численно равна константе скорости, составляет _____ моль/л. 1
1)1 2)2 3)3 4)4
При высокой температуре (более 40 °С) активность ферментов … снижается
1) снижается 2) не изменяется 3) повышается 4) сначала снижается,потом повышается
При повышении давления в 2 раза скорость гомогенной элементарной химической реакции 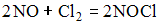 увеличивается в ___ раз(–а). 8 увеличивается в ___ раз(–а). 8
1) 2 2) 4 3) 8 4) 16
Если образец карбоната магния растворяется в серной кислоте при 25оС за 16 секунд, а при 55оС за 2 секунды, то температурный коэффициент скорости реакции равен …
1) 2.67 2) 0.5 3) 8 4) 2
Константа скорости реакции омыления этилового эфира уксусной кислоты гидроксидом натрия при 10°С равна 2,38 (время выражено в минутах). Найти скорость реакции, если смешали 1 л 0,5 М раствора эфира и 1 л 0,5 М раствора гидроксида натрия.
СН3СООС2Н5 + NaOH → CH3COONa + С2Н5ОН
Ответ: 0,1487 моль/л·мин.
Скорость химической реакции 2NO+O2 → 2NO2 при концентрациях реагирующих веществ оксида азота (II) 0,3 моль/л и кислорода 0,15 моль/л составила 1,2·10–3 моль/л·с. Найти значение константы скорости реакции.
Ответ: 8,88·10–2 л2/моль2·с.
Задания для самоконтроля (включены в коллоквиум и зачетное занятие)
При уменьшении концентрации вещества A2 в 3 раза скорость одностадийной реакции
2A 2(г) + B2 (г) = 2A2B(г) :
1) увеличивается в 3 раза 2) уменьшается в 3 раза 3) увеличивается в 9 раз 4) уменьшается в 9 раз
Во сколько раз нужно увеличить внешнее давление, чтобы скорость одностадийной реакции А(г) + 2В = 2AB возросла в 125 раз?
1) 5 2) 25 3) 100 4) 125
Если температурный коэффициент химической реакции равен 2, то при повышении температуры от 20°С до 50°С скорость реакции…
1) увеличивается в 6 раз 2) уменьшается в 4 раза 3) уменьшается в 2 раза 4) увеличивается в 8 раз
Если температурный коэффициент химической реакции равен 3, то при повышении температуры от 10 до 40оС скорость реакции:
1) увеличивается в 27 раз 2) уменьшается в 8 раз 3) увеличивается в 7 раз 4) увеличивается в 3 раза
Чему равен температурный коэффициент реакции, если при увеличении температуры с 20 до 30 °С скорость ее увеличилась в 3 раза:
1) 9 2) 3 3) 2 4) 6
Закон, выражающий влияние концентраций реагирующих веществ на скорость химической реакции, называется законом:
1) Гесса 2) Аррениуса 3) Вант-Гоффа 4) действующих масс
При повышении температуры от 50°С до 70°С и значении температурного коэффициента 3 скорость химической реакции увеличится в:
1) 2 раза 2) 3 раза 3) 6 раз 4) 9 раз
Как формируется правило Вант–Гоффа?
1) при повышении температуры на 10 градусов скорость химической реакции увеличивается в 2 – 4 раза
2) для большинства химических реакций скорость реакции увеличивается с ростом температуры
3) скорость реакции пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам реакции
4) для большинства химических реакций скорость реакции уменьшается с ростом температуры
Укажите уравнение Аррениуса о температурной зависимости скорости реакции:
1) 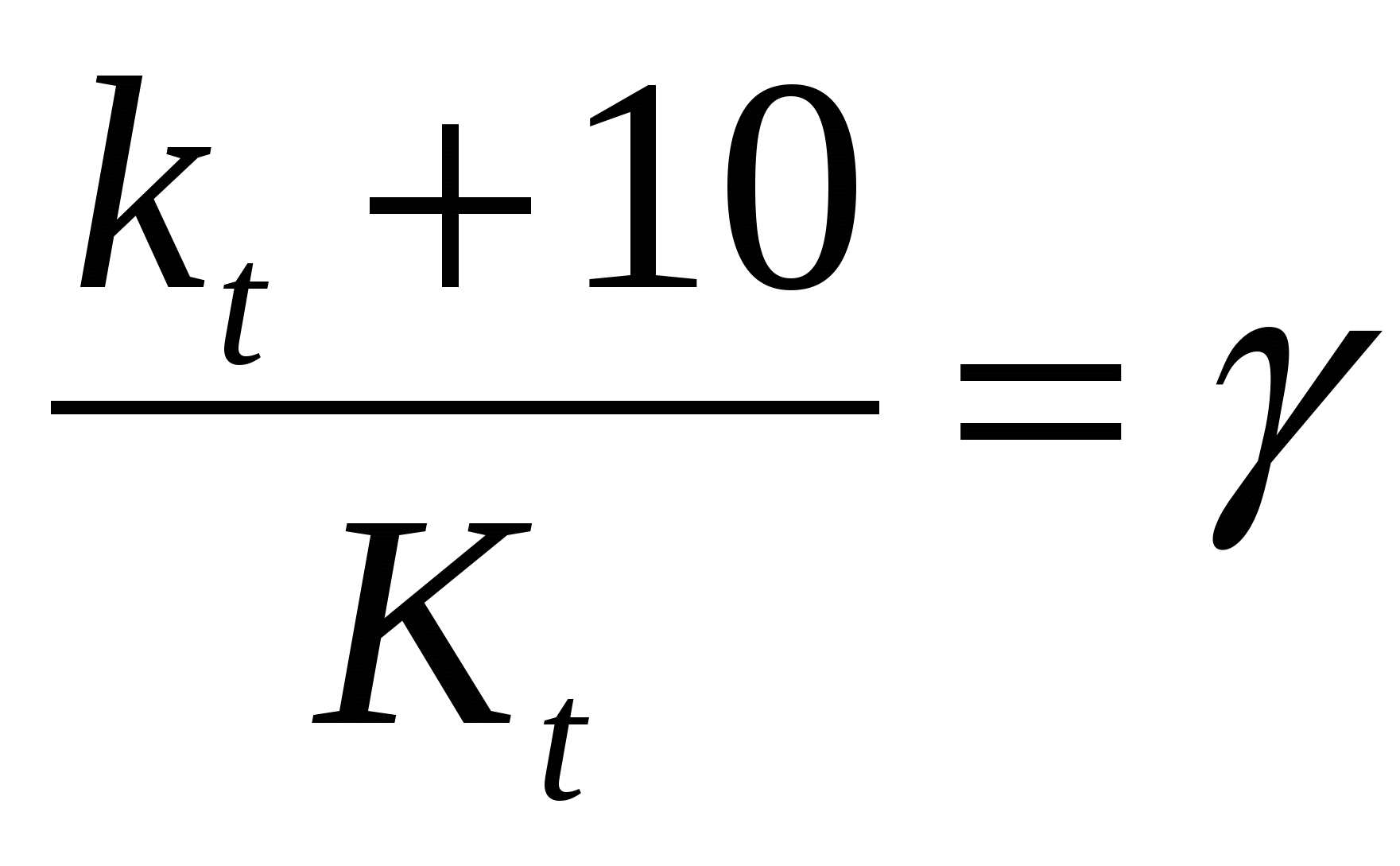 2) k = A∙e-Ea/RT 3) ν = k∙Ca∙Cb 4) ν2 = ν1∙γΔt/10 2) k = A∙e-Ea/RT 3) ν = k∙Ca∙Cb 4) ν2 = ν1∙γΔt/10
Укажите правило Вант–Гоффа о температурной зависимости скорости реакции:
1) ν2 = ν1∙γΔt/10 2) k = A∙e-Ea/RT 3) ν = k∙Ca∙Cb 4) 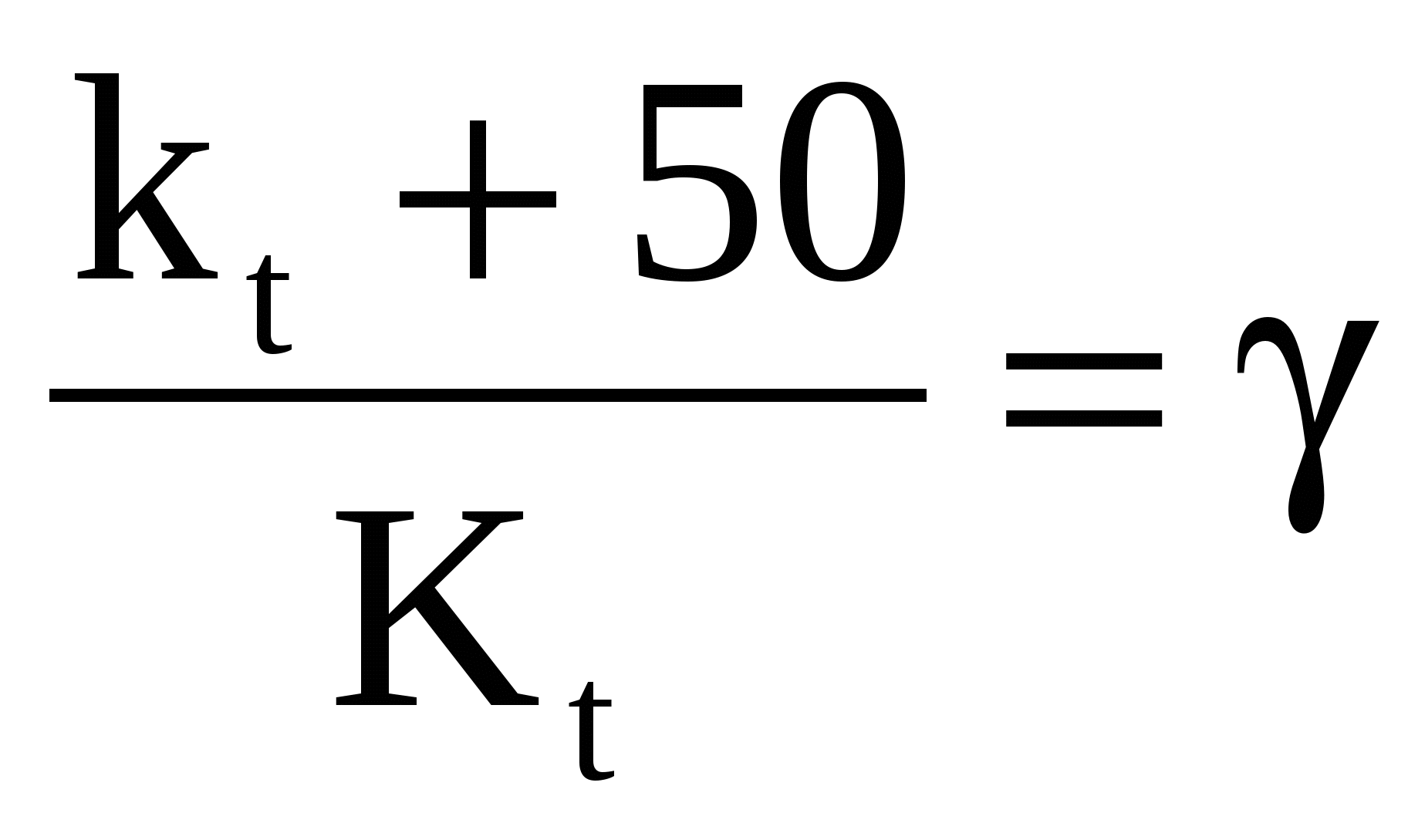
Когда численное значение константы скорости и скорости совпадают?
1) если концентрации реагирующих веществ постоянны и равны единице
2) если концентрации реагирующих веществ постоянны и не равны единице
3) если реагирующие вещества и продукты реакции находятся в одной фазе.
4) если концентрации реагирующих веществ постоянны и равны
Какая стадия называется лимитирующей стадией сложной химической реакции?
1) самая быстрая 2) имеющая низкую энергию активации 3) самая медленная 4) первая
Скорость химической реакции зависит от:
1) времени, температуры, концентрации
2) природы реагирующих веществ, температуры, концентрации
3) времени, температуры, концентрации, природы реагирующих веществ
4) времени, температуры, давления
Сформулируйте основной закон химической кинетики:
1) скорость сложной реакции, состоящей из ряда последовательных стадий, определяется скоростью самой медленной стадии
2) скорость реакции пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам в уравнении реакции
3) скорость реакции определяется изменением числа реагирующих молекул в единицу времени в единице объема
4) скорость реакции определяется суммой стехиометрических коэффициентов исходных веществ
Константа равновесия реакции зависти от:
1) температуры и концентрации; 2) температуры и давления;
3) температуры и природы реагирующих веществ. 4) давления;
Как изменится скорость реакции 2NO(r) + О2(г) ↔ 2NО2(r), если объем ре
акционного сосуда увеличится в 2 раза?
уменьшится в 4 раза 3) уменьшится в 8 раза
увеличится в 4 раза 4) увеличится в 8 раз
Константа равновесия реакции N2О4(г) ↔ 2NО2(r) при 25°С равна 0,1. В каком направлении будет идти реакция при следующих концентрациях веществ: c(NО2) = c(N2О4) = 0,02 моль/л?
1) ∆G = -3,98 кДж, в прямом 2) ∆G = 0, равновесие
3) ∆G = -3,98 кДж, в обратном 4) ∆G = +3,98 кДж, в прямом
Константа скорости реакции Н2(г) + I2(г) ↔ 2HI(г) при 7140 К равна 0,111 л/моль-с. В сосуд
объемом 2 л ввели по 2 моль водорода и иода. Чему будет равна скорость реакции в тот момент, когда в реакционной смеси образуется 0,2 моль иодоводорода?
1) 0,1 2) 0,111 3) 0,00111 4) 0,0111
Константа скорости разложения оксида азота(V) равна при 35°С 8,76∙10-3 мин-1, а при 45°С 2,99∙102 мин-1. Вычислите энергию активации в указанном интервале температур.
1) 100кДж/моль 2) 1,ЗкДж/моль 3) 10ОДж/моль 4) 200 кДж/моль
При 590°С константа скорости прямой реакции Н2+12 ↔ 2HI равна 0,16, а
обратной 0,0047. Вычислить константу равновесия.
1) 34 2) 0, 0294 3) 64 4) 96
Чему равна константа равновесия обратимой реакции (25°С), для которой ∆G°298 =5,714 кДж/моль?
1) 0,1 2) 1,0 3) 10 4) 100
Задания для самостоятельной работы на занятии
При 20°С константа скорости некоторой реакции равна 10-4 мин-1, а при 50°С — 8∙10-4 мин-1. Чему равен температурный коэффициент скорости реакции?
1) 2 2) 3 3) 4 4) 5
Чему равна скорость химической реакции, если концентрация одного из реагирующих веществ в начальный момент была равна 1,2 моль/л, а через 50 мин. Стала равна 0,3 моль/л?
1) 0,024 моль/л∙мин 2) 0,018 моль/л∙мин 3) 0,006 моль/л∙мин 4) 0,012 моль/л∙мин
Определить температурный коэффициент скорости реакции, если при понижении температуры на 30°С реакция замедлилась в 8 раз?
1) 3,00 2) 2,67 3) 2,00 4)4,50
Чему равна скорость реакции гидролиза дипептида, если его концентрация в начальный момент была равна 0,1 моль/л, а через 30 сек стала равна 0,05 моль/л?
1) 0,2 моль/л∙мин 2) 0,1 моль/л∙мин 3) 0,00167 моль/л∙мин 4) 0.167 моль/л∙мин
 Константа равновесия реакции N2О4(r) ↔ 2NО2(r) при 25°С равна 0,1. В каком направлении будет идти реакция при следующих концентрациях веществ: c(NО2) = c(N2О4) = 0,1 моль/л? Константа равновесия реакции N2О4(r) ↔ 2NО2(r) при 25°С равна 0,1. В каком направлении будет идти реакция при следующих концентрациях веществ: c(NО2) = c(N2О4) = 0,1 моль/л?
1) ∆G= 0, равновесие 2) ∆G= -24,6, в прямом 3)∆ G =-24,6, в обратном 4) ∆G= +24,6, в прямом
Как изменится скорость прямой реакции N2 + 3H2 → 2NH3, если объем газовой смеси уменьшить в 2 раза?
Ответ: скорость реакции увеличится в 16 раз.
Температурный коэффициент скорости некоторой реакции равен 3. Как изменится скорость этой реакции при повышении температуры от 80° до 130°С?
Ответ: скорость реакции увеличится в 243 раза.
Найти температурный коэффициент скорости реакции, если константа скорости при 120°С составляет 5,88∙10–4, а при 170°С она равна 6,7∙10–2 (л2∙моль-2·с-1).
Ответ: 2,58.
Какие из ионов: меди (II) или кальция (II) – могут катализировать реакцию окисления бромид-ионов в кислой среде бихромат-ионами?
Как изменяются скорости прямой и обратной реакций в газовой фазе для равновесной системы 2A+B2↔2AB, если уменьшить объем, занимаемый газами, в 3 раза?
Ответ: скорость прямой реакции увеличится в 27 раз, обратной – в 9 раз.
Лабораторные работы
1. Взаимодействие тиосульфата натрия с кислотой.
2. Взаимодействие цинка с кислотой.
3. Взаимодействие перманганата калия со щавелевой кислотой.
Темы докладов УИРС
1. Молекулярность и порядок реакции.
2. Энергия активации.
3. Изучение кинетики модельных систем металлоферментов.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Цель занятия.
Получить представление об обратимых и необратимых процессах, о химическом равновесии – для изучения вопросов биофизической и биологической химии, физиологии и фармакологии.
Исходный уровень знаний
1. Знание закона действия масс применительно к гомогенным и гетерогенным системам.
2. Знание зависимости скорости реакции от различных факторов.
3. Умение рассчитать изменение скорости химической реакции при заданных концентрациях и температуре.
После изучения темы студент должен:
— знать:
– термодинамическое и кинетическое условия химического динамического равновесия;
– сущность химического равновесия и принципы смещения равновесия;
— уметь:
– рассчитывать константу равновесия в гомогенных и гетерогенных системах по величинам равновесных концентраций;
– прогнозировать направление смещения равновесия под влиянием различных факторов;
– рассчитывать равновесные концентрации веществ.
Учебно-целевые вопросы:
1. Реакции необратимые и обратимые, относительность такого деления;
2. Некоторые термодинамические функции системы и критерий направления процесса;
3. Термодинамические условия необратимости реакции и химического равновесия.
4. Химическое динамическое равновесие:
– определение кинетического условия химического равновесия;
– вывод константы равновесия, ее физический смысл;
– классификация реакций по величине константы равновесия;
– динамический характер химического равновесия;
– смещение равновесия, принцип Ле Шателье (1884 г.);
– факторы, влияющие на химическое равновесие – концентрация, давление, температура, катализатор.
5. Значение химического равновесия в биологических системах.
Вопросы и задания для самоподготовки
(обязательные домашние задания, выполняемые в отдельной тетради)
Реакции необратимые и обратимые, относительный характер такого деления
Понятие о химическом равновесии и кинетическое условие химического равновесия
Термодинамическое условие химического равновесия
Константа равновесия
Смещение химического равновесия. Принцип Ле Шателье
Равновесие в гетерогенных системах
Применение ЗДМ к растворам слабых электролитов
Какие внешние признаки обратимой реакции? Примеры.
Почему химическое равновесие называется динамическим?
Выведите константу равновесия для реакции взаимодействия оксида серы (IV) и кислорода
Какой физический смысл имеет константа равновесия? От каких факторов она зависит?
Найти константу равновесия реакции горения угля (серы)
В каком направлении сместится равновесие при повышении давления?
Вычислить константу равновесия в равновесной системе: водород, йод, йодоводород, если начальные концентрации водорода и йода по 0,02 моль/л, а равновесная концентрация йодоводорода – 0,03 моль/л.
Ответ: константа 36.
Состояние химического равновесия характеризуется
1) прекращением протекания прямой и обратной химической реакций
2) равенством скоростей прямой и обратной реакций
3) равенством суммарной массы продуктов суммарной массе реагентов
4) равенства суммарного количества вещества продуктов суммарному количеству вещества реагентов
Равновесие в реакции А+Б ↔ В - Q при повышении температуры смещается
1) вправо, так как это эндотермическая реакция
2) влево, так как это экзотермическая реакция
3) вправо, так как это экзотермическая реакция
4) влево, так как это эндотермическая реакция
При изменении давления химическое равновесие не смещается в реакции
1) СО(г) + Сl2 (г) ↔ СОСl2 (г) 2) СО2(г) + С↔2СО(г)
3) 2СО(г) + О2(г) ↔2СО2(г) 4) С + О2 (г) ↔СО2(г)
При понижении давления химическое равновесие смещается в сторону
1) эндотермической реакции 2) экзотермической реакции
3) уменьшения объема реакционной смеси 4) увеличения объема реакционной смеси
Химическое равновесие сместится в одну сторону при повышении давления и понижении температуры в системе:
1) N2 + ЗН2 ↔2NH3 + Q 2) N2 + О2↔ 2NO - Q 3) Н2 + Cl2↔ 2HC1 + Q 4) С2H2(г)↔ 2С + Н2 – Q
При понижении давления химическое равновесие смещается в сторону исходных веществ в системе
1) 2CO(г) +O2(г) ↔2CO2(г) + Q 2) N2(г) + O2(г) ↔2NO(г) – Q
3) SO2Сl2(г) ↔ SO2(г) + Cl2(г) – Q 4) H2(г) + Cl2(г) ↔2HCl(г) + Q |
|
|
 Скачать 431.5 Kb.
Скачать 431.5 Kb.
