урок химии 8. урок химии 9. Урок химии по теме Общие химические свойства металлов. Ряд активности
 Скачать 69.61 Kb. Скачать 69.61 Kb.
|
|
Урок химии по теме: «Общие химические свойства металлов. Ряд активности». 9 класс Тип урока: урок изучения нового материала Вид урока: мультимедийный Цель урока: систематизировать сведения о химических свойствах металлов, рассмотренных при изучении материала курса химии 8,9 классов, выявить особенности протекания реакций металлов со сложными веществами, подчеркнуть химическую функцию металлов как восстановителей. Оборудование и реактивы: на столах учащихся: раствор соляной кислоты (НCl), CuSO4 (раствор), металлы: цинк, медь, железо ( железные гвозди на ниточках), пробирки, штатив для пробирок, емкость для слива, спиртовка, щипцы, спички. На столе учителя: предметный столик, спички, спиртовка, вата, шпатель, асбестовая прокладка, порошок магния, натрий, эксикатор с водой, фенол-фталеин. Оснащение урока. Компьютер, мультимедиапроектор, экран, таблицы « Растворимость кислот, солей и оснований в воде», « Периодическая система химических элементов Д.И.Менделеева», «Электрохимический ряд напряжений металлов», рабочие листы учащихся. Ход урока: I. Орг. момент (готовность учащихся к уроку) (1 мин.) II. Проверка опорных знаний (10 мин.). Контроль ЗУН а) Решение задач по карточке. б) Блиц опрос – небольшой мозговой штурм. (3 мин.) На какие группы мы разделили элементы Периодической системы? Ответ: Металлы и неметаллы. Определите расположение металлов в ПСХЭ Ответ: Нижний угол относительно диагонали Вор-Астат, и все элементы побочных подгрупп. Какая кристаллическая решетка свойственна для металлов? Ответ: Металлическая кристаллическая решетка Чем она отличается от всех других? Ответ: в узлах металлической кристаллической решетки располагаются атомы и положительные ионы металлов, между которыми находится свободные электроны. Какие общие физические свойства металлов объясняются наличием металлическая кристаллической решети. Ответ: электропроводность, теплопроводность, металл блеск, пластичность, легкость тугоплавкость, легкоплавкость, твердость, мягкие Как называется способность вещества изменять форму под внешним воздействием и сохранять ее после прекращения воздействия? (пластичность); Какой металл самый легкий? Ответ: литий (Li) Назовите самый тяжелый металл? Ответ: Осмий (Os) Лучшие проводники электричества среди металлов? Ответ: серебро и медь; Назовите самый тугоплавкий металл? Ответ: Вольфрам (W) Какой металл самый легкоплавкий? Ответ: Ртуть (Hg) Назовите самый пластичный металл? Ответ: Золото (Au) Какие металлы легко режутся ножом? Ответ: щелочные металлы. Название известного сплава на основе алюминия (дюралюминий); Важнейшие сплавы на основе железа? (чугун и сталь); Какой неметалл входит в состав сплавов железа (углерод); Укажите не менее трех металлов, которые могут выступать в качестве легирующих добавок? (хром, никель, молибден) В детстве мы читали о нем в сказке Андерсена. Его звон слышали заблудившиеся путники и находили дорогу. Он может болеть «чумой» Какой это металл? (2.8.18.18.4) Ответ: олово. При раскопках этрусских гробниц (1000 лет до н.э) были обнаружены зубные протезы. Вопрос: из какого металла они были сделаны? Ответ: золото. Тестовые задания по теме «Химические свойства металлов» Задание: выберите один правильный ответ. Вариант 1 1.При взаимодействии кальция с водой образуются: а) оксид кальция и водород; б) гидроксид кальция и водород; в) гидроксид кальция 2. Ртуть из раствора нитрата ртути (II) можно получить с помощью: а) серебра; б) натрия; в) меди 3. Какой металл взаимодействует с водой с образованием оксида: а) барий; б) хром; в) медь 4. С раствором серной кислоты с образованием соли и водорода реагирует: а) ртуть; б) алюминий; в) золото 5. При взаимодействии с кислородом образует пероксид: а) медь б) железо в) натрий Вариант 2 1.При взаимодействии цинка с водой образуются: а) оксид цинка и водород; б) гидроксид цинка и водород; в) гидроксид цинка 2. Медь из раствора нитрата меди (II) можно получить с помощью: а) серебра; б) натрия; в) железа 3. Какой металл взаимодействует с водой с образованием щелочи: а) барий; б) хром; в) медь 4. С раствором серной кислоты с образованием соли и водорода реагирует: а) ртуть; б) свинец; в) золото 5. При обычных условиях с азотом взаимодействует: а) литий б) железо в) хром Проверка теста.
Самопроверка : 5 правильных ответов – «5» 4 правильных ответов – «4» 3 правильных ответов – «3» III. Изучение нового материала. ( 27 мин.- 30 мин.) Постановка цели урока. Актуальность изучения данной темы. Актуализация знаний (1-2 мин.) Учитель: «Роберт Вуд, знаменитый американский физик и великий любитель всяческих проделок, направлялся из лаборатории домой на обед. Дорога шла через негритянский квартал. Была зимняя оттепель, и огромная лужа распростерлась по мостовой между тротуарами, на которых толпились негры, вышедшие погреться на солнышке. Проходя мимо них, Вуд громко закашлял и на виду у всех плюнул в лужу, незаметно бросив в том же направлении кусок натрия величиной с грецкий орех. Прогремел взрыв, полетели искры, и большое желтое пламя поднялось над поверхностью воды. Затем раздались вопли, молитвы и один голос громче, чем все остальные вместе взятые, пробасил: «спасайся, кто может, негры! Этот человек плюнул огнем! На вид он молодой, но только сам старый дьявол, сам старый сатана умеет это делать!» О каких свойствах натрия идет речь в этом отрывке? Ученик: О химических Учитель: Следовательно, тема нашего урока «Характерные химические свойства металлов» Организация познавательной деятельности (20-25 мин.) Учитель: Мир вокруг нас – это совокупность физических и химических превращений веществ. Как ведут себя металлы в этом мире, с какими веществами они взаимодействуют и каким должно быть их практическое применение. От чего зависят химические свойства металлов? ( Химические свойства металлов зависят от их активности) Как делятся металлы по активности? Приведите примеры (По активности металлы делятся на активные (натрий, кальций) и неактивные (медь, ртуть)) Где и как можно узнать о активности металла? (В электрохимическом ряду активности металлов. Если металл стоит в ряду активности до водорода, то это активный металл. Если после водорода, то это неактивный металл Li K Ca Na Mg Al | Zn Cr Fe Ni Pb (H2) Cu Hg Ag Pt Au Активные малоактивные неактивные Химические свойства металлов делятся на две группы – с простыми веществами и сложными Чем обусловлены химические свойства металлов? (2) 1 Большим радиусом 2 Небольшим числом электронов на внешнем уровне Чем, с точки зрения окислительно-восстановительных процессов, являются металлы в реакциях? (3) Ответ: Металлы являются только восстановителями, т.к их атомы легко отдают электроны, превращаясь при этом в положительно заряженные ионы – катионы. М0 – nе- →Мn+. Чем обусловлены Для того, чтобы прошла данная реакция необходимо наличие окислителя. Вопрос к классу: Вспомните вещества, которые могут выступать в качестве окислителя при взаимодействии с металлами. Составить список этих веществ: Кислород, галогены, сера, водород и др., вода, кислоты (2) Как называются продукты взаимодействия металлов с кислородом, галогенами, серой, азотом ? (учащиеся дают ответы, сверяют их с записью на слайдах). Эпиграф — высказывание М.В. Ломоносова: “Химии никоим образом научиться невозможно, не видав самой практики и не принимаясь за химические операции”. А сейчас на некоторое время вы станете химиками-аналитиками! Правила техники безопасности. Лабораторный опыт №1. Прокаливание медной пластинки в пламени спиртовки. (признак реакции при прокаливании медной проволоки – изменение цвета, наблюдаем почернение – образование оксида меди (II), уравнение реакции 2Cu + O2 = 2CuO) Наблюдения, уравнения реакций записывают в рабочем листе. Следующие два опыта мы посмотрим на видеофрагменте: Демонстрационный опыт 1 (видеоклип): горение магния в кислороде. Вопрос: Как вы можете объяснить этот опыт? Где подобный процесс мог применяться? ( В прошлом веке использовался фотографами для улучшения освещения) Ученик у доски: Составляет уравнение реакции горения магния в кислороде, определяет окислитель и восстановитель. Демонстрационный опыт 2 (видеоклип): Взаимодействие сурьмы с хлором. Ученик у доски: Составляет уравнение реакции взаимодействия сурьмы с хлором, определяет окислитель и восстановитель. Закрепление. Допишите уравнения реакций взаимодействия металлов с другими неметаллами. Al + I2 → Fe + S → Na + N2 → Ca + P → Физкультпауза Выполняются упражнения для глаз 2) Взаимодействие металлов с водой. Как металлы реагируют с водой? Активные металлы(Li – Na) + вода → гидроксид металла(щелочь) + Н2↑ Металлы средней активности(Mg – Pb) + вода → оксид металла + Н2↑ Неактивные металлы (Bi – Au) + вода → не реагируют Посмотрите маленький фрагмент. «Как вы думаете ?»… имеет ли смысл фраза, которую мы слышали в сказке: «К морю синему пошли и море синее зажгли?». Демонстрационный опыт 2 (видеоклип): Взаимодействие калия с водой. Лабораторный опыт №2: взаимодействие натрия с водой: Ученик у доски: Составляет уравнения реакции взаимодействия натрия с водой. Фиксирует признаки химической реакции, определяет окислитель и восстановитель. Уравнение реакции: 2Na + 2H2O = 2NaOH + H2 Почему металлы первой группы (А) называют щелочными? (образуется щелочь). Докажите! (капают в раствор фенолфталеин. Раствор окрасился в малиновый цвет, значит среда – щелочная,) Закрепление. Допишите уравнения возможных реакций взаимодействия металлов водой. Al + H2O → Zn + H2O → Ag + H2O → Проблема: почему алюминий при обычных условиях не реагирует с водой? (алюминий прокрыт оксидной пленкой, которая его и защищает) Это свойство имеет практическое значение, т.к. для изготовления посуды не берут калий, натрий, а именно алюминий, цинк, железо. 3) Взаимодействие металлов с кислотами. Лабораторный опыт №3. Взаимодействие цинка, железа, меди с соляной кислотой. ТБ 1 вариант - Zn + HCl 2 вариант - Cu + HCl 3 вариант – Fe + HCl Учитель: контролирует правила ТБ при выполнении опытов, навыки и умения экспериментальной работы. Запись в тетрадях уравнений реакций, Zn + HCl → ZnCl2 + H2 Fe + HCl → FeCl2 + H2 Cu + HCl → не идёт Это свойство используется для получения водорода в лаборатории. Объясните результаты опыта. Вывод. Металлы , стоящие в ряду активности до водорода вытесняют его из растворов кислот, а после водорода - не вытесняют. . Но для этой реакции есть несколько поправок. Если образуется растворимая соль; Кроме щелочных и щелочно-земельных металлов; Азотной кислота и . концентрированная серная кислота реагируют особенно, при этом никогда не выделяется водород. Взаимодействие металлов с солями. Лабораторный опыт № 4. Взаимодействие железа с сульфатом меди и меди с хлоридом железа (III). Учитель: контролирует правила ТБ при выполнении опытов, навыки и умения экспериментальной работы. Запись в тетрадях уравнений реакций, наблюдения Fe + CuSO4 → FeSO4 + Cu FeCl2 + Cu → не идет Для этой реакции тоже есть поправки, которые совпадают с первой и второй поправкой для кислот Объясните результаты опыта. Вывод. Более активные металлы вытесняют менее активные из растворов их солей. Закрепление. Допишите уравнения возможных реакций. Ag + CuCl2 → Zn + FeCl3 → Fe + AgNO3 → Задания на определение катионов металлов Для распознавания веществ используют качественные реакции на катионы и анионы. Мы сейчас говорим о металлах, значит на какие ионы нам нужно обратить внимание? (на катионы) Лабораторный опыт № 5 : I. Задание: Определить катионы металлов в трех пробирках при поморщи одного реагента. Реактивы: MgСl2, AlCl3, CuCl2 Какой ход ваших мыслей для выполнения данного задания? (Так как нужно определить катионы металлов, мы должны найти что то общее в свойствах катиона Mg2+, Аl3+ и Cu2+. Это можно посмотреть в таблице растворимости. Все эти катионы образуют нерастворимые или малорастворимые основания. Значит, возможно, образование осадка. Следовательно, общим реагентом для них будет щелочь. Следовательно, для проведения исследования, используем имеющийся у нас на столах гидроксид натрия) CuCl2 +2NaOH=Cu(OH)2 +2NaCl2 Сu2++2OH- = Cu(OH)2 ↓(голубой осадок) МgСl2+ 2NaOH=Ca(OH)2 +2NaCl2 Mg2++2OH- = Mg(OH)2 (белый осадок) 2AlCl3 +3NaOH= 2Al(OH)3 +3NaCl2 2Al3+ +3OH-= 2Al(OH)3 ↓ (белый осадок) Al(OH)3 + NaOH = Na [Al (OH)4] (осадок растворяется) Al(OH)3 + OH- = Na+ + [Al (OH)4]- (образование голубого осадка говорит о наличии в растворе катионов меди, значит в пробирке № 3 хлорид меди; в двух других пробирках образовался белый осадок. Для распознавания добавим в эти пробирки еще щелочь. В пробирке №2 осадок растворился, значит в этой пробирке хлорид алюминия – он амфотерный и растворяется в избытке щелочи. А тогда в пробирке № 1 хлорид магния. IV. Закрепление нового материала. Предлагается ребятам выполнить интерактивное упражнение: С какими из веществ будут реагировать предложенные металлы при нормальных условиях? Выбрать правильные ответы. Ответить на вопросы. С какими веществами реагируют металлы? Чем являются металлы в реакциях – окислителями или восстановителями? Какие поправки вводятся для реакций металлов с водой, кислотами, солями? Для чего нужно изучать химические свойства металлов? Где их можно использовать? Где применить полученные знания? Ответ: Металлы широко используются человеком в технике, медицине, различных отраслях промышленности, но при использовании надо учитывать их свойства: взаимодействие с кислородом, водой, различными солями. V.Итоги урока. «Самооценка». Учащиеся оценивают свою работу на уроке по результатам теста и своим ответам. Учитель корректирует оценки и выставляет их в журнал. VI. Домашнее задание. Для всех: §11 , упр. 7,8 (письменно) Придумать кроссворд по теме «Металлы» Тема: Химия металлов Урок: Общие свойства металлов. Металлическая связь 1. Взаимодействие с кислородом Для металлов характерны общие физические свойства: они обладают особенным металлическим блеском, высокой тепло- и электропроводностью, пластичностью. Для металлов также характерны некоторые общие химические свойства. Важно запомнить, что в химических реакциях металлы выступают в качестве восстановителей: отдают электроны и повышают свою степень окисления. Рассмотрим некоторые реакции, в которых участвуют металлы. ВЗАИМОДЕЙСТВИЕ С КИСЛОРОДОМ Многие металлы могут вступать в реакцию с кислородом. Обычно продуктами этих реакций являются оксиды, но есть и исключения, о которых вы узнаете на следующем уроке. Рассмотрим взаимодействие магния с кислородом. Магний горит в кислороде, при этом образуется оксид магния: 0 0 +2 -2 2Mg + O2 = 2MgO  Рис. 1. Горение магния в кислороде Атомы магния отдают свои внешние электроны атомам кислорода: два атома магния отдают по два электрона двум атомам кислорода. При этом магний выступает в роли восстановителя, а кислород – в роли окислителя. 2. Взаимодействие с галогенами Для металлов характерна реакция с галогенами. Продуктом такой реакции является галогенид металла, например, хлорид.  Рис. 2. Горение калия в хлоре Калий сгорает в хлоре образованием хлорида калия: 0 0 +1 -1 2К + Cl2 = 2KCl Два атома калия отдают молекуле хлора по одному электрону. Калий, повышая степень окисления, играет роль восстановителя, а хлор, понижая степень окисления,- роль окислителя 3. Взаимодействие с серой Многие металлы реагируют с серой с образованием сульфидов. В этих реакциях металлы также выступают в роли восстановителей, тогда как сера будет окислителем. Сера в сульфидах находится в степени окисления -2, т.е. она понижает свою степень окисления с 0 до -2. Например, железо при нагревании реагирует с серой с образованием сульфида железа (II): 0 0 +2 -2 Fe + S = FeS 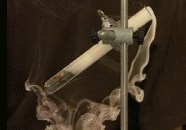 Рис. 3. Взаимодействие железа с серой Металлы также могут реагировать с водородом, азотом и другими неметаллами при определенных условиях. 4. Взаимодействие с водой С водой без нагревания реагируют только активные металлы, например, щелочные и щелочноземельные. В ходе этих реакций образуется щелочь и выделяется газообразный водород. Например, кальций реагирует с водой с образованием гидроксида кальция и водорода, при этом выделяется большое количество теплоты: Ca + 2H2O = Ca(OH)2 + H2 Менее активные металлы, например, железо и цинк, реагируют с водой только при нагревании с образованием оксида металла и водорода. Например: 0 +1 -2 +2 -2 0 Zn + H2O = ZnO + H2 В этих реакциях окислителем является атом водорода, входящий в состав воды. Металлы, стоящие в ряду напряжении правее водорода, с водой не реагируют. 5. Взаимодействие с кислотами Вы уже знаете, что с кислотами реагируют металлы, стоящие в ряду напряжений левее водорода. В этих реакциях металлы отдают электроны и выступают в качестве восстановителя. Окислителем являются катионы водорода, образующиеся в растворах кислот. Например, цинк реагирует с соляной кислотой: 0 +1 -1 +2 -1 0 Zn + 2HCl = ZnCl2 + H2 Иначе протекают реакции металлов с азотной и концентрированной серной кислотами. В этих реакциях водород практически не выделяется. Мы погорим о таких взаимодействиях на следующих уроках. 6. Взаимодействие с солями Металл может реагировать с раствором соли, если он активнее, чем металл, входящий в состав соли. Например, железо замещает медь из сульфата меди (II): 0 +2 +2 0 Fe + CuSO4 = FeSO4 + Cu Железо – восстановитель, катионы меди – окислитель. 7. Внутреннее строение металлов Попробуем объяснить, почему металлы обладают общими физическими и химическими свойствами. Для этого рассмотрим модель внутреннего строения металла. Атомы металлов имеют относительно большие радиусы и малое число внешних электронов. Эти электроны слабо притягиваются к ядру, поэтому в химических реакциях металлы выступают в роли восстановителей, отдавая электроны с внешнего энергетического уровня. В узлах кристаллической решетки металлов находятся не только нейтральные атомы, но и катионы металла, т.к. внешние электроны свободно перемещаются по кристаллической решетке. При этом атомы, отдавая электроны, становятся катионами, а катионы, принимая электроны, превращаются в электронейтральные атомы.  Рис. 4. Модель внутреннего строения металла Химическуюсвязь, котораяобразуетсяврезультатепритяжениякатионовметаллаксвободноперемещающимсяэлектронам, называютметаллической. Электро– и теплопроводность металлов объясняются наличием свободных электронов, которые могут быть носителями электрического тока и переносчиками теплоты. Пластичность металла объясняется тем, что при механическом воздействии не рвется химическая связь, т.к. химическая связь устанавливается не между конкретными атомами и катионами, а между всеми катионами металла со всеми свободными электронами в кристалле металла. |
