УЧЕБНИК Детская анестезиология и реаниматология. Михельсон В.А., Гребенников В.А. 2001. УЧЕБНИК Детская анестезиология и реаниматология. Михельсон В.А. В. А. Михельсон В. А. Гребенников оглавление предисловие к 1 изданию 5 Часть первая. Общие вопросы детской анестезиологии и реаниматологии 6 Глава краткий исторический очерк
 Скачать 3.14 Mb. Скачать 3.14 Mb.
|
5.2. Система дыхания5.2.1. Анатомо-физиологические особенности. Полость носа у ребенка относительно уже, а ее дно наклонено таким образом, что язык соприкасается с задней стенкой глотки на большем протяжении, чем у взрослых. Поэтому при ингаляции кислорода или проведении анестезии масочным способом могут возникнуть трудности, связанные с поддержанием свободной проходимости верхних дыхательных путей. Носовые ходы у маленького ребенка уже, чем у взрослого и поэтому при отеке слизистой оболочки или повышенной секреции чаще развивается их полная непроходимость. А поскольку новорожденный не может быстро перейти от носового дыхания к дыханию через рот, то возникают приступы апноэ. Гортань у новорожденного ребенка расположена относительно высоко, на три позвонка выше, чем у взрослого; голосовая щель находится на уровне III шейного позвонка. Анатомические взаимоотношения языка надгортанника и гортани усложняют проведение прямой ларингоскопии и интубации трахеи и могут затруднять использование изогнутого клинка Макинтоша. Надгортанник относительно длиннее и шире, чем у взрослых и располагается под углом в 45О к продольной оси. Поэтому, не приподняв клинком ларингоскопа надгортанник, невозможно увидеть голосовую щель. Наиболее узким местом дыхательных путей является трахея в области перстневидного хряща. Утолщение слизистой оболочки в этом месте на 1 мм (например, при катаральном воспалении) уменьшает просвет дыхательных путей на 75% у новорожденных и только на 20% у детей старшего возраста. Именно по этому отек слизистых оболочек у маленьких детей очень опасен и может быстро привести практически полной обструкции дыхательных путей. Трахея у новорожденного ребенка длиной около 5 см, поэтому требуется особая аккуратность при введении и фиксации интубационной трубку. Стенки трахеи довольно мягкие и могут быть сдавлены пальцами анестезиолога даже при наложении лицевой маски. Грудная клетка маленького ребенка более эластична, чем у взрослого, поэтому при обструкции дыхательных путей у ребенка раньше возникают выраженные втяжения уступчивых мест. Ребенок не может создать необходимое для расправления легких отрицательное внутриплевральное давление, в связи с чем ограничивается возможность увеличения дыхательного объема, раньше возникает экспираторное закрытие дыхательных путей. Неспособность ребенка к значительному увеличению объема вентиляции также связана с более горизонтальным, чем у взрослого расположением ребер и меньшей кривизной купола диафрагмы, являющейся основной дыхательной мышцей. Состав мышечных волокон новорожденного и взрослого также значительно различаются. Волокна I типа (медленно сокращающиеся, устойчивые к усталости) составляют у недоношенного ребенка всего 10%, у доношенного - 30% и только после года их количество приближается к уровню взрослого (55%). Архитектоника нижних дыхательных путей у взрослого и ребенка практически не различается. У младенца, родившегося в срок, имеется примерно 24 млн. альвеол, к 3-м месяцам их количество утраивается, к году возрастает в 5-6 раз (300-600 млн. у взрослого). Общая газообменная поверхность легких у новорожденного в 20 раз меньше, чем у взрослого, что примерно соответствует соотношению масс тела. 5.2.2. Вентиляция. Весь объем газа, находящийся в легких в состоянии максимального вдоха, т.е. общую емкость легких, принято разделять на ряд статических объемов и емкостей. Общепринятая терминология деления легочных объемов представлена на рис. 5.1. Первые дыхательные движения плода обнаруживаются уже на 11 неделе гестационного периода. Периоды дыхания редко длятся более 10 минут и чередуются с апноэ продолжительностью до 1-2 часов. В третьем триместре беременности продолжительность дыхательных движений у плода достигает нескольких часов в сутки. При переходе от внутри - к внеутробной жизни из легких адсорбируется около 30 мл/кг жидкости. Первые несколько вдохов характеризуются развитием высокого транспульмонального давления (около 50 см H2O), после чего легкие новорожденного ребенка почти полностью расправляются. У доношенного новорожденного общая емкость легких составляет около 160 мл и примерно половина от этой величины приходится на функциональную остаточную емкость. Дыхательный объем новорожденного равен примерно 6 мл/кг, а минутная вентиляция – 200-300 мл/кг/мин.  Рис. 5.1. Как известно, не весь воздух поступающий в легкие, достигает перфузируемых альвеол и принимает участие в газообмене. Часть дыхательного объема (VT), не вступившего в газообмен с кровью, принято называть дыхательным мертвым пространством (VD). Фракция мертвого пространства в дыхательном объеме (VD/VT) примерно одинакова во всех возрастных группах (0,3). Однако малые абсолютные величины мертвого пространства у новорожденных (2 мл/кг), определяют необходимость уделять особое внимание выбору элементов дыхательного контура наркозной и дыхательной аппаратуры. В отличие от статистических легочных объемов, альвеолярная вентиляция (VA) у новорожденного (100-150 мл/кг/мин) значительно выше, чем у взрослого (60 мл/кг/мин). 5.2.3. Механика дыхания. Газообмен между альвеолярным воздухом и внешней средой осуществляется вследствие ритмических сокращений дыхательных мышц. Величина мышечного усилия определяет объем и скорость движения газа, поэтому взаимодействие этих показателей, с известной долей приближения, может быть описано на основе законов механики. Перемещению воздуха по дыхательным путям противодействует сопротивление двух типов: эластическое и неэластическое (аэродинамическое). В клинической физиологии для характеристики эластических свойств легких и грудной клетки чаще используют термин “податливость” - величина, обратная эластичности. Податливость (С) определяется как способность к изменению объема на единицу изменения давления: С = V/ P и выражается в литрах на 1 см вод. ст. Податливость легких сильно изменяется с возрастом ( CL новорожденного составляет 0,004 л/см H2O, а взрослого - 0,15 л/см H2O ). Величина податливости зависит от морфологических особенностей легкого, объема крови в легочных сосудах, количества жидкости в интерстициальном пространстве, объема легочной ткани, участвующей в газообмене, бронхиального тонуса. Снижение податливости наблюдается при респираторном дистресс-синдроме, отеке легких, ателектазах, интерстициальной эмфиземе, после продолжительных оперативных вмешательств. Аэродинамическое сопротивление дыхательных путей определяется величиной перепада давлений, которая необходима для получения данной объемной скорости движения воздуха: RAW = P /V , см H2O/ (л . с). На величину аэродинамического сопротивления наибольшее влияние оказывает радиус воздухоносных путей, а также их длина и вязкость газа. Однако, периферические дыхательные пути создают не более 20% от общей величины аэродинамического сопротивления. Это связано с тем, что в результате деления бронхов, начиная с четвертой генерации, их суммарный просвет прогрессивно возрастает. Поэтому в клинической практике заметное увеличение аэродинамического сопротивления отмечается при нарушениях свободной проходимости верхних и первых трех генераций нижних дыхательных путей. Резко повышается аэродинамическое сопротивление при крупе, подсвязочном отеке, стенозирующем трахеобронхите. Необходимо помнить, что проведение назогастрального зонда у новорожденного ребенка может увеличить аэродинамическое сопротивление дыхательных путей более, чем на 50%. 5.2.4. Диффузия газов. Переход газов через альвеолярно-капиллярную мембрану протекает по физическим законам. Количество газа, переходящее через легочную мембрану в единицу времени, т.е. скорость диффузии, прямо пропорциональна давлению газа по обе стороны мембраны и обратно пропорциональна сопротивлению диффузии. Для характеристики сопротивления диффузии газов в легких принято использовать обратную величину, проводимость, называемую диффузионной способностью легких. Это количество газа, переходящее через альвеолярно-капиллярную мембрану в 1 мин, при разнице парциального давления газа по обе стороны мембраны в 1 мм рт. ст. Диффузионная способность пропорциональна поверхности легких, поэтому в педиатрической практике обычно ориентируются не на абсолютные цифры диффузионной способности, а на отношение их к функциональной емкости. Эта характеристика примерно одинакова у детей всех возрастных групп. Нарушения диффузии газов обычно сказывается лишь на газообмене кислорода, поскольку его растворимость, а соответственно и диффузионная способность в 20 раз меньше, чем у углекислого газа. Альвеолярно-артериальный градиент СО2 начинает увеличиваться тогда, когда диффузия падает более, чем в 10 раз. Нарушения диффузионной способности наблюдаются при отеке легких, респираторном дистресс-синдроме, интерстициальной пневмонии, бронхолегочной дисплазии и некоторых других заболеваниях. Однако, более значимые нарушения диффузионной способности происходят при уменьшении поверхности эффективного газообмена, например после обширных резекций легочной ткани, а чаще при выраженных нарушениях вентиляционно-перфузионных отношений. 5.2.5. Вентиляционно-перфузионные отношения. Эффективность легочного газообмена зависит не столько от абсолютных значений альвеолярной вентиляции или легочного кровотока, сколько от соотношения этих величин. В первые сутки поле рождения перфузия легких преобладает над вентиляцией. В дальнейшем уровень общего вентиляционно-перфузионного отношения устанавливается такой же, как у взрослых, и составляет 0,8. Схематически могут быть представлены три варианта распределения вентиляции и кровотока. 1. Вентиляция соответствует кровотоку (VA/Q=0,8 ). В этом случае кровь, оттекающая от альвеол, будет иметь нормальный газовый состав. 2. Вентиляция преобладает над кровотоком ( VA/Q>0,8 ). Этот вариант возникает при гипервентиляции нормально перфузируемых альвеол или при нормальной вентиляции и сниженном легочном кровотоке. При этом, парциальное давление кислорода в крови останется нормальным, а PaCO2 - будет уменьшаться. 3. Вентиляция меньше кровотока (VA/Q<0,8 ). Такая ситуация возможна при сниженной вентиляции на фоне сохранившегося кровотока или в случае увеличения кровотока выше нормальных величин. В этих условиях развивается артериальная гипоксемия, а парциальное напряжение углекислого газа длительное время остается нормальным в связи с его высокой диффузионной способностью. Во время операции и наркоза происходят заметные изменения как общих, так и регионарных вентиляционно-перфузионных отношений. Одной из главных причин, вызывающих эти изменения, является длительное неподвижное положение больного во время операции. Примерно через 1-2 часа происходит смещение регионарной вентиляции снизу вверх, в то время как перфузируются преимущественно нижележащие отделы легких. Кроме того, у пациента находящегося в горизонтальном положении, ЖЕЛ уменьшается в среднем на 8-10% из-за более высокого стояния купола диафрагмы.Влияние на вентиляционно-перфузионные отношения оказывают также ИВЛ, ингаляции гипероксических дыхательных смесей, действие анестетиков, миорелаксантов и некоторых других лекарственных препаратов. Следует отметить, что ИВЛ и полодение больного влияют преимущественно на регионарное распределение вентиляции, в то время как анестетики изменяют главным образом регионарную перфузию. Нарушения легочной перфузии могут наблюдаться после массивных гемотрансфузий. Патогенез этих нарушений связан с обструкцией легочных капилляров агрегатами из клеточных элементов крови (эритроцитов, лейкоцитов, тромбоцитов). Агрегаты всегда содержаться в старой крови, но они могут образовываться и внутри сосудов, особенно при гипотензии и шоке. Подобные нарушения наблюдаются при газовой и жировой эмболии. Значительные изменения в распределении легочного кровотока происходят при снижении давления в легочной артерии. Прекращается перфузия верхних отделов легких, возрастает величина дыхательного мертвого пространства. Снижение давления в легочной артерии может наступить в результате применения вазодилататоров и ганглиоблокирующих препаратов, вследствие уменьшения ОЦК при кровотечении или потере жидкости. Крайней степенью нарушения вентиляционно-перфузионных отношений является развитие внутрилегочного вено-артериального шунтирования. Это явление наблюдается при полном прекращении вентиляции альвеол, но сохраняющемся кровотоке. Прекращение вентиляции и развитие ателектазов чаще всего происходит при обструкции бронхов, раннем экспираторном закрытии воздухоносных путей или первичном коллапсе альвеол, связанном со снижением уровня сурфактанта. Независимо от того, что происходит вначале - коллапс альвеол или экспираторное закрытие дыхательных путей, в конечном итоге всегда развивается ателектаз, так как закрытый в альвеоле газ диффундирует в кровь. Скорость спадения альвеол зависит от характера заполняющего ее газа. При дыхании кислородом или гелий-кислородными смесями она в несколько раз выше, чем при дыхании воздухом. 5.2.5. Легочный сурфактант. Сурфактант - это мономолекулярный слой поверхностно-активных веществ, находящийся на границе раздела между альвеолярным эпителием и воздухом. Уменьшая поверхностное натяжение, сурфактант препятствует спадению альвеол во время экспираторной фазы. Он также эмульгирует комочки мокроты, препятствуя агломерации и уменьшая адгезию. Кроме того, липидные компоненты сурфактанта повышают макрофагальную фагоцитарную активность и уменьшают воспаление, ингибируя секрецию интерлейкинов (IL-1 и IL-6). Сурфактант на 90% состоит из липидов и на 10% - из белков апопротеинов. Основная доля первых приходится на фосфолипиды, а из всех фосфолипидов более 70% составляют фосфатидилхолины, в основном дипальмитоилфосфатидилхолин, обладающий поверхностно-активными свойствами (Рис. 5.2.). Сурфактант синтезируется альвеолярными эпителиальными клетками 2-го типа, начиная с 22-26 недели внутриутробного развития. До 32 недели синтез сурфактанта осуществляется с помощью метилтрансфераз, а в более поздние сроки гестации и после рождения преобладает более эффективный фосфохолинтрансферазный путь. Скорость обновления поверхностно-активных фосфолипидов в легких у взрослых составляет 14 часов, а в период новорожденности она в 10-12 раз выше. Такие патологические состояния периода ранней адаптации как гипоксия, гипервентиляция, гипероксия, переохлаждение, перегревание, увеличивают скорость разрушения сурфактанта. Недостаточный синтез и (или) быстрая инактивация сурфактанта, маленький диаметр альвеол, высокая податливость грудной клетки и низкая растяжимость легочной ткани у недоношенных детей приводит к прогрессирующему ателектазированию легких и развитию респираторного дистресс-синдрома (РДС). Определение концентрации фосфолипидов (лецитин/сфингомиелин) в околоплодных водах используют для оценки зрелости легких плода. Отношение Л/С меньше 1 наблюдается до 32 недели гестационного развития, равное 2-м – примерно на 35 неделе и 4 – 6 у доношенного ребенка. Рис.5.2. Состав сурфактанта 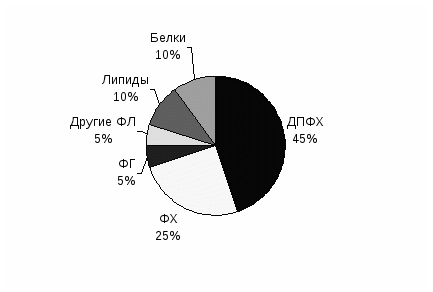 5.2.6. Негазообменные функции легких. Частицы и некоторые микроорганизмы, оседающие в дыхательных путях, фагоцитируются альвеолярными макрофагами и затем удаляются мерцательным эпителием или перевариваются под действием гидролаз. Продуцируемый плазматическими клетками иммуноглобулин А (IgA) нейтрализует определенные вирусы и способствует лизису бактерий. Защитную функцию выполняют также интерферон, лизоцим, лактоферрин. Нормальное функционирование альвеолярного эпителия может нарушаться в связи с недостаточным увлажнением и согреванием дыхательной смеси при использовании искусственных воздухоносных путей (интубационная трубка, трахеостомическая канюля), токсическим воздействием ингаляционных анестетиков и лекарственных препаратов (фторотан, закись и окись азота, кортикостероиды, салицилаты и др.), а также при ацидозе, гипоксемии, гипокапнии, гипотермии и многих других патологических состояниях. Легкое является важным регулятором уровня многих биологически активных веществ в крови. Клетками легкого секретируются или высвобождаются гистамин, простагландины E и F, брадикинин, серотонин, ангиотензин II и многие другие субстанции. В тоже время, такие вазоактивные вещества как ангиотензин I, серотонин, АТФ, простагландины, норадреналин почти полностью или в значительной степени удаляются или инактивируются при однократном прохождении крови через легкие. Легкие как эластичный резервуар могут депонировать большое количество жидкости, поддерживая непрерывность кровотока и участвуя в регуляции ОЦК. Наконец, капиллярная сеть легких является биологическим фильтром, очищающим кровь от патологических примесей: клеточных агрегатов, сгустков фибрина и др. 5.2.7. Регуляция дыхания. У новорожденного ребенка регуляция вентиляции так же, как у взрослого, осуществляется с помощью рефлекторных и биохимических механизмов, однако эффективность функционирования этой системы значительно ниже. Так в ответ на гиперкапнию происходит очень непродолжительное по времени и незначительное увеличение объема вентиляции. При сопутствующей гипоксемии реакция на гиперкапнию может отсутствовать вовсе. В тоже время, новорожденные весьма чувствительны к изменениям РаО2. Назначение гипероксических дыхательных смесей приводит к заметному уменьшению объема вентиляции. Реакция на гипоксемию зависит от гестационного и постнатального возраста и температуры тела. Недоношенные дети и доношенные моложе 1-й недели жизни в состоянии нормотермии обычно отвечают на гипоксемию двухфазной реакцией: непродолжительный период усиления дыхания с последующей депрессией. У охлажденных новорожденных в ответ на гипоксемию развивается депрессия дыхания без предшествующего увеличения вентиляции. Рефлексы с барорецепторов легких, регулирующие глубину и частоту дыхания, у новорожденных детей выражены сильнее, чем у взрослых. При повышении давления в дыхательных путях происходит заметное увеличение дыхательного объема и уменьшение частоты дыхания. Поэтому методика ППД чаще и успешнее используется при лечении дыхательных расстройств у новорожденных детей, но следует помнить, что эти рефлексы угнетаются под действием анестетиков и седативных препаратов. У большинства недоношенных и части доношенных детей нередко отмечается периодическое дыхание (тахипноэ чередующееся с периодами апноэ продолжительностью 5-10 сек.). В эти периоды возникает небольшое изменение уровня РаСО2 и частоты сердечных сокращений, что впрочем не имеет значимых функциональных последствий. Периодическое дыхание обычно исчезает в возрасте 1-2 месяцев. 5.3. СИСТЕМА КРОВООБРАЩЕНИЯ 5.3.1. Формирование Закладка сердца начинается на 2-3 неделе после зачатия и уже к 6-й неделе гестационного развития сердце становится четырехкамерным с наличием атриовентрикулярных клапанов. Поэтому большинство врожденных пороков сердца (ВПС) формируется именно в этот период. К наиболее частым причинам возникновения ВПС относятся хромосомные нарушения, мутации одного гена, неблагоприятные воздействия факторов среды (алкоголизм, инфекции, лекарственные препараты) и некоторые заболевания у матерей, такие как сахарный диабет и фенилкетонурия. Нередко ВПС является частью определенных синдромов. При алкоголизме матери чаще всего формируются дефекты межжелудочковой и межпредсердной перегородок, открытый артериальный проток. Примерно в 30% случаев возникает эмбриофетальный алкогольный синдром. Из лекарственных препаратов тератогенным действием обладают амфитамины, прогестагены, некоторые гипотензивные и противосудорожные препараты, оральные контрацептивы. 5.3.2. Кровообращение плода и новорожденного Относительно хорошо оксигенированная кровь из плаценты (SaO2 – 80%) через пупочную вену и аранциев проток попадает в нижнюю полую вену, где смешивается с кровью из нижней части тела плода. Далее циркулирует только смешанная артериовенозная кровь и ни один из органов плода, за исключением печени, не снабжается кровью насыщенной кислородом более, чем на 60-65%. Вследствие особенностей строения правого предсердия большая часть крови (примерно 2/3) попадает непосредственно в левое предсердие через овальное окно, где смешивается с кровью из легочных вен. Эта кровь поступает в левый желудочек и выбрасывается в восходящую аорту, направляясь к верхним конечностям и голове. Оставшаяся часть крови из нижней полой вены смешивается в правом предсердии с кровью из верхней полой вены и затем выбрасывается правым желудочком в легочную артерию. Около 90% выброса правого желудочка сбрасывается через артериальный проток в нисходящую аорту, оставшиеся 10% питают легкие через систему легочной артерии. Таким образом, овальное окно и артериальный проток функционируют как обходные шунты, обеспечивающие поступление крови из полых вен, минуя легкие, в большой круг кровообращения. Величина давления в правом желудочке и легочной артерии превышает аналогичный показатель в левом желудочке и аорте на 10-20 мм рт.ст., а лёгочное сосудистое сопротивление превышает системное примерно в 4-5 раз. Перевязка пуповины исключает из кровообращения плаценту с ее низким сосудистым сопротивлением. С первыми вдохами ребенка альвеолы заполняются воздухом и артерии механически растягиваются. Легочное сосудистое сопротивление снижается примерно в пять раз и во столько же раз возрастает легочный кровоток. Важную роль в падении сосудистого сопротивления играет улучшение оксигенации и освобождение таких вазоактивных веществ как аденозин, брадикинин, простациклин и эндогенный оксид азота. Период быстрого снижения легочного сосудистого сопротивления занимает 3-12 часов. В это время давление в легочной артерии становится ниже аортального и соответственно изменяется направление шунтирования крови через артериальный проток – сброс становится преимущественно лево-правым. В дальнейшем постепенное снижение давления в системе легочной артерии связывают главным образом с морфологической перестройкой легочных сосудов. Инволюция гипертрофированного мышечного слоя артериол и мелких артерий продолжается в течение 2-3 месяцев. Конечным результатом этих изменений является закрытие фетальных коммуникаций, несущих кровь в обход легких. Даже если и не происходит их полного закрытия, меняется соотношение сосудистых сопротивлений в малом и большом кругах кровообращения, и увеличенное системное сосудистое сопротивление направляет кровь в лёгочное русло. 5.3.3 Регуляция кровообращения Одной из основных составляющих работы сердечно-сосудистой системы является сердечный выброс или минутный объем (СВ, МОС). МОС - показатель функции сердца, отражающий величину выброса крови желудочком в одну минуту. Для сравнения сердечного выброса у больных разного веса и возраста его относят к единице площади тела и таким образом определяют СИ (сердечный индекс). Можно несколько повысить МОС, увеличив частоту пульса, однако если частота сердечных сокращений находится в пределах физиологической нормы, то соответствующее увеличение МОС можно достичь увеличением ударного объема. Ударный объем (УО) - это объем крови, выбрасываемой сердцем во время каждого сокращения, т. е. систолы. Его величину определяют три фактора: 1) преднагрузка; 2) постнагрузка; 3) контрактильный статус миокарда. С позиций механики мышечное сокращение определяется несколькими силами, воздействующих на миокард в покое (диастола) и при активном сокращении (систола). В покое состояние миокарда определяется величиной преднагрузки и эластичностью (способности к растяжению). Преднагрузка желудочка - это диастолический объем крови, зависящий в определенной степени от конечно-диастолического давления и податливости миокарда. В клинических условиях измерение диастолического объема или податливасти - трудная задача. Поэтому для характеристики этих показателей в клинических условиях определяют давление наполнения желудочка или предсердий, которое на практике позволяет судить о преднагрузке. Клинический критерий преднагрузки - величина конечно-диастолического давления в желудочках (КДД). Закон Старлинга характеризует взаимосвязь между КДД и УО (Рис.5.3.). В период систолы состояние миокарда зависит от способности к сокращению и величины постнагрузки. Так у здоровых детей при повышении сосудистого сопротивления и артериального давления пропорционально увеличивается мощность желудочков сердца (закон “гомеометрической регуляции”), а сердечный выброс и давление в левом и правом предсердии не меняются. При наличии симптомов недостаточности сократительной способности миокарда появляется зависимость между сердечным выбросом и сосудистым сопротивлением. Постнагрузка - сопротивление левому желудочку при его опорожнении. Наибольшее влияние на ее величину оказывают артерий и артериол. Наиболее точный индикатор постнагрузки - общее периферическое сосудистое сопротивление. На практике о величине постнагрузки судят по среднему давлению в аорте. Сократительная способность миокарда (контрактильность) – это свойство миокардиальных волокон изменять силу своих сокращений. И преднагрузка, и постнагрузка существенным образом влияютна сократимость миокарда. Вместе с тем они делают очень трудным определение истинных показателей состояния сократимости здорового сердца даже с применением методов катетеризации. Наиболее точно оценить контрактильность миокарда можно при выполнении вентрикулографии с одновременной регистрацией внутрижелудочкового давления. Множество предложенных для клинической практики формул и коэффициентов лишь косвенно отражает контрактильность миокарда. Однако при этом необходимо иметь в виду, что каждый из факторов (преднагрузка, постнагрузка и контрактильность миокарда) может независимо воздействовать на УО таким образом, что он достигает своего предельного значения. Следовательно, воздействие необходимо производить с учетом влияния этих факторов на соотношение “доставка кислорода миокарду/баланс потребления”. Регуляция преднагрузки. Преднагрузку можно увеличить путем дополнительной инфузии жидкости. Она повышается при венозном спазме и уменьшается при стимуляции диуреза, дилатации вен или увеличении ударного объема. О точном значении давления наполнения левого желудочка после операции можно судить по данным изучения внутрисердечной гемодинамики при помощи катетеризации полостей сердца или косвенно с помощью эхокардиографического исследования. В некоторых случаях желудочек мало податлив, для существенного увеличения диастолического объема необходимо большее давление наполнения. Одним из факторов, реально снижающих преднагрузку и часто встречающихся в клинической практике, является гиповолемия. Она приводит к снижению сердечного выброса. Гиповолемия характеризуется снижением давления в левом предсердии. При рентгенологическом исследовании это состояние может проявляться понижением венозного рисунка легких. Лечение гиповолемии довольно простое, оно осуществляется заместительной инфузионной терапией. В основе контроля лежит определение уровня давления в левом предсердии при повышении сердечного выброса. Регуляцией постнагрузки широко пользуются в интенсивной терапии для улучшения сердечного выброса и функции миокарда, поскольку снижение постнагрузки приводит к увеличению МОС. У детей, перенесших операцию, особенно новорожденных, часто отмечается повышение общего периферического сопротивления. Вазодилататоры, как известно, снижают сосудистое артериальное сопротивление, при этом сердечный выброс повышается. Дальнейшее улучшение насосной функции миокарда может быть достигнуто использованием нескольких препаратов, улучшающих сократительную функцию (например, допамина). Регуляция сократительной способности миокарда. Введение инотропных препаратов увеличивает силу и растяжимость миокардиальных волокон, что способствует лучшему опорожнению левого желудочка при каждом сокращении. Благодаря этомуповышается сердечный выброс. Идеальное инотропное средство, по-видимому, должно увеличивать сократимость миокарда, но при этом не действовать на частоту сердечных сокращений. К сожалению, в настоящее время такого средства нет. Однако, уже сейчас врач имеет несколько препаратов, каждый из которых повышает инотропные свойства миокарда. Наиболее подходящим инотропным агентом является допамин - естественный предшественник норадреналина. Допамин увеличивает сократимость миокарда и уменьшает общее легочное и общее периферическое сосудистое сопротивление. При назначении инотропных средств следует учитывать их метаболические эффекты. Инотропные препараты увеличивают потребление кислорода миокардом, что в свою очередь требует увеличения коронарного кровотока. Возникающий дисбаланс может усилить ишемию миокарда или даже привести к развитию некроза. Это важно учитывать в первую очередь при лечении недоношенных детей. 5.4. СИСТЕМА МОЧЕВЫДЕЛЕНИЯ Дифференциация нефронов у плода заканчивается примерно к 35 неделе гестационного развития. Плод продуцирует довольно большое количество мочи, которая является основной частью околоплодных вод. После рождения экскреция мочи сохраняется на довольно высоком уровне, затем несколько снижается и вновь возрастает к концу первой недели. Для новорожденных нормальная скорость диуреза составляет 1-3 мл/кг/час. Расположение почек относительно костных ориентиров у детей отличается от такового у взрослых. Нижний полюс почки у новорожденных лежит в большинстве случаев ниже гребня подвздошной кости, у детей старше 2 лет он не доходит до него, а в возрасте 3-5 лет топография почек становится как у взрослых. При рождении отмечается дольчатое строение почек. Дольчатость сохраняется до 2-4 лет, а затем исчезает. Мочеточники у детей имеют относительно более широкий просвет, извилистость, слабое развитие мышечных волокон. Мочевой пузырь у детей раннего возраста расположен выше, чем у взрослых, по отношению к костным ориентирам. У детей первого года жизни он прилегает к передней брюшной стенке и с увеличением возраста постепенно опускается в малый таз. Скорость гломерулярной фильтрации у новорожденных в несколько раз меньше, чем у взрослых. (Таб. 5.1.). У здорового ребенка такое ограничение функции не приводит к увеличению уровня мочевины и креатинина в крови, однако, при повышении осмотической нагрузки происходит довольно длительная задержка воды и электролитов - так называемая, гипертоническая экспансия экстрацеллюлярной жидкости. Концентрационная способность почек у новорожденного также снижена и максимальная осмолярность мочи в первые дни жизни не превышает 700-800 мосмоль/кг и только к 6 месяцам может подниматься до 1200 мосмоль/кг. Функция почек в поддержании КОС у младенцев можно считать удовлетворительной, поскольку уже с первых суток жизни кислотность мочи может поддерживаться на уровне рН 4.5-5.0, что обеспечивает выведение кислых метаболитов.
Более чем у 90% новорожденных, находящихся в критическом состоянии развивается нарушение функции почек, так называемая ишемическая нефропатия, основными причинами которой являются снижение сердечного выброса и гипоперфузия почек. При несвоевременном устранении действия преренальных факторов патологические изменения происходят и в паренхиме почек. 5.5. ЖЕЛУДОЧНО-КИШЕЧНЫЙ ТРАКТ При проведении обезболивания и процессе интенсивной терапии нередко производится зондирование желудка, поэтому анестезиолог должен знать возрастные размеры пищевода (Табл. 5.2.).
У детей раннего возраста отмечается физиологическая слабость кардиального сфинктера и в то же время хорошее развитие мышечного слоя привратника. Все это предрасполагает к срыгиванию и рвоте. Об этом необходимо помнить при проведении анестезии, особенно с использованием миорелаксантов, так как в этих случаях возможна регургитация – пассивное (и поэтому поздно замечаемое) вытекание содержимого желудка, что может привести к его аспирации и развитию тяжелой аспирационной пневмонии. Емкость желудка увеличивается пропорционально возрасту до 1-2 лет. Дальнейшее увеличение связано не только с ростом тела, но и с особенностями питания. Примерные величины емкости желудка у новорожденных и грудных детей представлены в табл. 5.3.
Указанные величины весьма приблизительны, особенно в условиях патологии. Например, при непроходимости верхних отделов желудочно-кишечного тракта стенки желудка могут растягиваться, что ведет к увеличению его емкости в 2-5 раз. Физиология желудочной секреции у детей разного возраста в принципе не отличается от таковой у взрослых. Кислотность желудочного сока может быть несколько ниже, чем у взрослых, но это часто зависит от характера питания. рН желудочного сока у грудных детей 3,8-5,8, у взрослых в разгар пищеварения до 1,5-2,0. Моторика желудка в нормальных условиях зависит от характера питания, а также от нейрорефлекторных импульсов. Высокая активность блуждающего нерва стимулирует гастроспазм, а спланхнического нерва – спазм привратника. Время прохождения пищи (химуса) по кишечнику у новорожденных составляет 4-18 часов, у более старших детей – до суток. Из этого времени 7-8 часов тратится на прохождение по тонкому кишечнику и 2-14 часов – по толстому. При искусственном вскармливании грудных детей время переваривания может доходить до 48 часов. | ||||||||||||||||||||||||||||||||||||
