Методичка по порокам ЖКТ. В. Г. Баиров С. А. Караваева Попов А. А. Врожденные пороки развития пищеварительного тракта у новорожденных
 Скачать 7.2 Mb. Скачать 7.2 Mb.
|
|
В.Г. Баиров С.А. Караваева Попов А.А. Врожденные пороки развития пищеварительного тракта у новорожденных В структуре хирургической патологии новорожденных ведущее место (около 80%) занимают пороки развития. Частота врожденных аномалий не имеет тенденции к снижению. Среди детей с пороками развития, требующими экстренной хирургической помощи, около 30% пациентов имеют множественные аномалии. В этой группе больных отмечается особенно высокая летальность, которая, даже в условиях современной хирургической помощи новорожденным, имеет незначительную тенденцию к уменьшению. Своевременная диагностика врожденных аномалий имеет крайне важное значение для выбора оптимальной лечебной тактики и прогноза заболевания. За последние 20 лет в Центре хирургии новорожденных г. Санкт-Петербурга (ДГБ №1) накоплен опыт лечения более 3000 пациентов с пороками развития. К наиболее часто встречающимся порокам развития относятся следующие: Атрезия пищевода Пороки развития ЖКТ Аноректальные аномалии Пороки развития передней брюшной стенки Диафрагмальные грыжи Спинномозговые грыжи Пороки мочевой системы Большую роль в решении проблемы диагностики врожденных аномалий играет антенатальное обследование, проводимое с 14-18й недели беременности. Оно позволяет выявить основные виды пороков развития задолго до рождения ребенка (табл.1). Одна из главных целей планомерно проводимого обследования беременных женщин – выявление патологии плода. В случае антенатальной диагностики порока будущие родители должны быть подробно, доступным языком информированы о заболевании их будущего ребенка и возможностях его коррекции. На основании этой информации они в праве решить судьбу своего еще нерожденного ребенка. Таблица 1. Сроки возможной зхографической визуализации некоторых ВПР
Большая часть пороков развития хорошо поддается лечению, и поэтому, если такая беременность желанна, то ее целесообразно сохранять. Однако, некоторые виды аномалий до сих пор во всем мире считаются либо неизлечимыми, либо социальная адаптация этих больных весьма сложна и не обеспечивает ребенку и его родителям элементарного качества жизни. К таким аномалиям относятся пороки развития центральной нервной системы (рахишизис, микроцефалия, врожденная гидроцефалия), некоторые врожденные пороки сердца (гипоплазия левых отделов). Не решена во всем мире проблема лечение муковисцидоза, проявляющегося в периоде новорожденности мекониальной кишечной непроходимостью и приводящего к смерти в более старшем возрасте от развивающейся легочной недостаточности. Таким образом, при антенатальной диагностике врожденных пороков развития вопрос о дальнейшей тактике очень сложен и решаться должен только после консультации хирурга-неонатолога. Атрезия пищевода Атрезия пищевода (АП) – врожденный порок развития, заключающийся в нарушении целостности пищевода и существовании двух несообщающихся между собой сегментов, каждый из которых может заканчиваться слепо или свищом сообщаться с трахеобронхиальным деревом (трахеопищеводный свищ – ТПС). Частота порока достаточно велика – 1:3000 новорожденных. При антенатальной диагностике не всегда, к сожалению, удается увидеть слепо заканчивающийся верхний сегмент пищевода. Однако, заподозрить эту патологию до родов позволяет обнаружение многоводия, отсутствие визуализации желудка у плода при повторных УЗИ-обследованиях, а также выявление других пороков развития, часто сочетающихся с АП. Частота сочетанных аномалий при АП превышает 50%. Это прежде всего врожденные пороки сердца, ЖКТ, скелета. Довольно высока частота и хромосомных болезней, преимущественно трисомии по 21й паре. Для АП характерны и определенные комбинации нескольких пороков у одного больного. Именно факт частого одновременного сочетания АП с некоторыми аномалиями явился основанием для выделения и описания VACTERL–ассоциации (V - вертебральные пороки, A - аноректальные, С - кардиальные, Т – трахеальные, Е – эзофагеальные, R – ренальные, L – пороки конечностей). Наиболее часто (88%) встречается атрезия пищевода с нижним трахеопищеводным свищем. Верхний сегмент пищевода при этом варианте порока слепо заканчивается, обычно на уровне Th2 - Th4, стенка сегмента гипертрофирована, диаметр его намного больше диаметра нижнего сегмента, который начинается от трахеи, чаще от ее мембранозной части. Между сегментами, как правило, существует диастаз, величина которого определяет выбор метода лечения. Атрезия пищевода с верхним и нижним трахеопищеводным свищом, а также только с проксимальной фистулой встречается крайне редко (4%), равно как и изолированный ТПС без атрезии пищевода (3%). Изолированная форма атрезии пищевода (без трахеопищеводного свища – 5%) почти всегда сопровождается большим диастазом между сегментами. Диагностика и лечебные мероприятия в родильном доме Основным клиническим симптом АП является обильное выделение из ротовой полости пенистой слюны, которую ребенок не может проглотить. Если ребенка начинают кормить, то он давится, закашливается, часто при этом появляется разлитой цианоз, быстро присоединяется аспирационная пневмония, приводящая к нарастающей дыхательной недостаточности. Поэтому следующее правило является абсолютным в диагностике атрезии пищевода– диагноз АП должен быть поставлен до первого кормления. Достижению этой цели служит обязательное зондирование пищевода и желудка, которое должно проводиться непосредственно после рождения каждому ребенку. Эта процедура является не только диагностической, но и лечебной, поскольку при отсутствии АП позволяет опорожнить желудок новорожденного от заглоченных во время родов околоплодных вод и предотвратить возможную аспирацию. При АП зонд встречает препятствие на расстоянии примерно 8-10 см от края десен. Наиболее простым способом подтверждения диагноза является проба Элефанта. Для ее проведения в пищевод ребенка вводят зонд до ощущения упора и затем через этот зонд одним толчком вводят 10 мл воздуха. Если пищевод проходим, воздух бесшумно пройдет в желудок, если же имеется АП, воздух с шумом (за счет турбулентного тока) выйдет наружу. При первых подозрениях на АП, подтвержденных положительной пробой Элефанта, ребенок должен быть заинтубирован с целью проведения санации дыхательных путей, и, таким образом, снижения риска развития аспирационной пневмонии. После интубации больной находится на самостоятельном дыхании через интубационную трубку. Выраженная дыхательная недостаточность, требующая перевода на искусственную вентиляцию легких, чаще всего свидетельствует о наличии АП с широким нижним трахеопищеводным свищом. Следующим шагом, который должен предпринять врач родильного дома, является срочный перевод ребенка в специализированный хирургический стационар. Диагностика и лечебные мероприятия в хирургическом стационаре Новорожденных с АП следует госпитализировать в реанимационное отделение. Параллельно со стабилизацией функции жизненно важных органов проводят диагностические мероприятия с целью подтверждения АП и выбора оптимальной тактики и сроков лечения. Основным диагностическим методом является рентгенологическое обследование, которое позволяет не только подтвердить диагноз, но и : А) определить тип аномалии и ее основные характеристики (наличие или отсутствие свища, его ширина и др.) В) оценить состояние легких С) выявить сочетанную патологию. Рентгенологическое обследование проводят с использованием водо- или жирорастворимых контрастных веществ (урографин, верографин, тразографт, иодолипол и др.), разведенных до 20 – 30% концентрации. Недопустимо использование бариевой взвеси в связи с высокой опасностью аспирации и ее тяжелых последствий. Количество вводимого контрастного вещества должно быть минимальным: для доношенного ребенка не более 1 мл, для недоношенного - не более 0,5 мл. Высказываемые иногда опасения относительно токсического воздействия на организм новорожденного иодосодержащих препаратов не обоснованы. Мы никогда не наблюдали подобные осложнения, хотя наш опыт основан на лечении почти 600 больных с различными формами данного порока. Для введения контрастного вещества используют ороэзофагеальный или назоэзофагеальный зонд, который вводят в верхний сегмент пищевода до тех пор, пока конец зонда не упрется в дно сегмента. После введения контраста зонд извлекают и производят рентгенограммы в вертикальном положении в двух проекциях (прямая и боковая) с захватом грудной клетки и брюшной полости. После обследования необходимо снова ввести зонд в верхний сегмент и удалить (отсосать шприцом) содержимое. Можно проводить исследование с рентгеноконтрастным зондом без применения контрастного раствора. Такая методика имеет определенные недостатки (не позволяет до операции диагностировать проксимальный ТПС, искажает истинное положение верхнего сегмента в грудной клетке), поэтому мы предпочитаем контрастное рентгенологическое исследование. Рентгенологическая картина определяется видом аномалии. При АП с нижним ТПС (наиболее частая форма) контрастное вещество заполняет верхний сегмент пищевода, обозначая его уровень (как правило, Th2-4), в желудочно-кишечном тракте имеется газ, что свидетельствует о наличии нижнего ТПС. (рис.1). 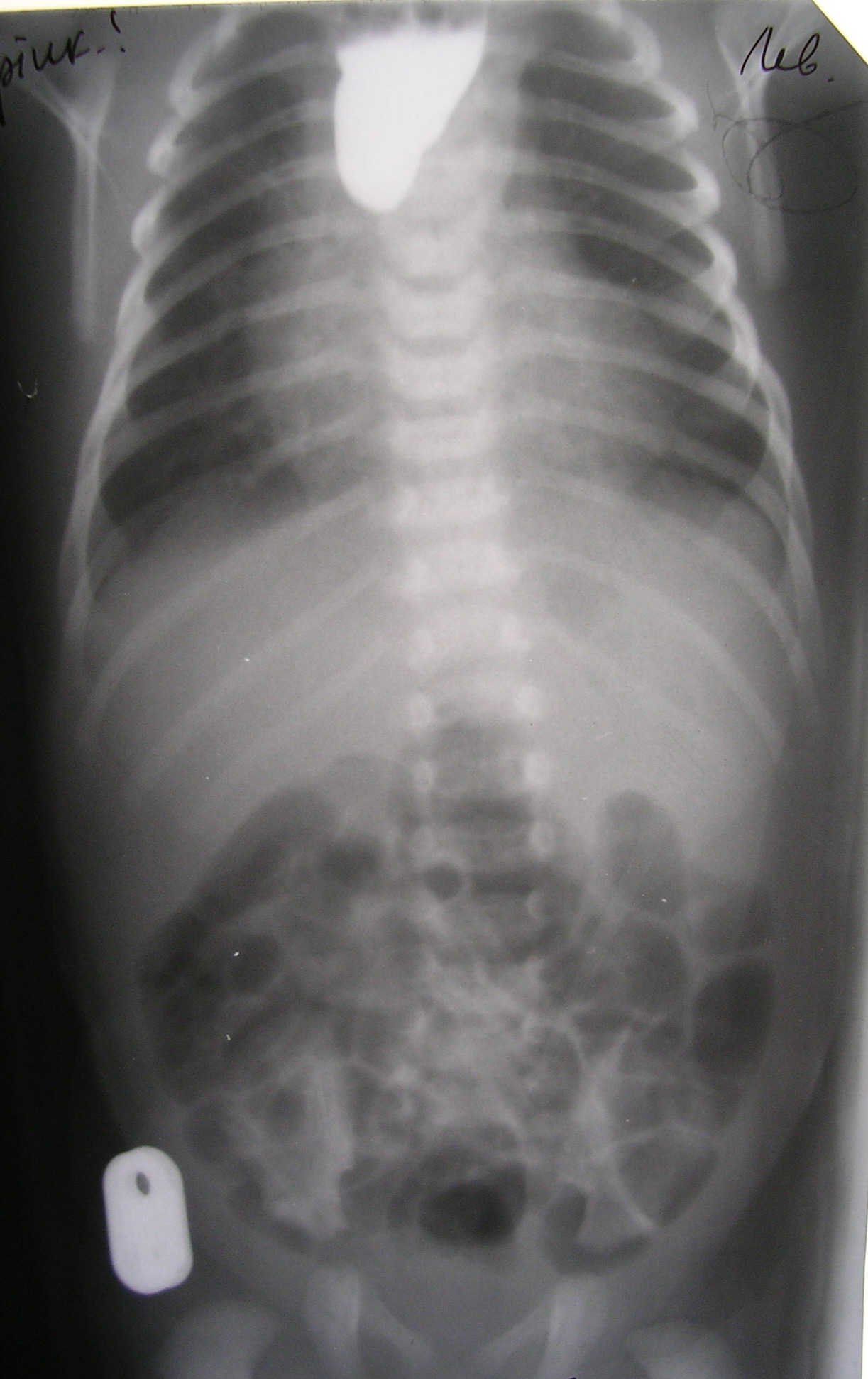 Рис. 1. Атрезия пищевода с нижним трахеопищеводным свищом. Степень газонаполнения кишечника определяется шириной ТПС. Выраженная пневматизация кишечных петель (особенно у ребенка нескольких часов жизни) говорит о наличии широкого ТПС. При изолированной форме АП контрастное вещество заполняет верхний сегмент пищевода (как правило, на уровне Th1-4), в желудочно-кишечном тракте газ отсутствует, что позволяет исключить нижний ТПС (рис.2).  Рис. 3. Атрезия пищевода (изолированная или несвищевая форма) Необходимо с особой осторожностью подходить к обследованию глубоко недоношенных детей, находящихся в тяжелом состоянии, поскольку у них резко замедлена перистальтика кишечника и соответственно его газонаполнение. У этой категории новорожденных иногда следует непосредственно перед операцией повторить рентгенограммы, чтобы окончательно убедиться в отсутствии газа в ЖКТ. При АП с верхним ТПС сразу после введения контрастное вещество из верхнего сегмента попадает в трахеобронхиальное дерево, в желудочно-кишечном тракте газ отсутствует. При АП с двумя (верхним и нижним) трахеопищеводными свищами - контрастное вещество обозначает верхний сегмент пищевода и далее контрастирует трахеобронхиальное дерево. В желудочно-кишечном тракте присутствует газ, что свидетельствует о наличии нижнего ТПС. При оценке рентгенограмм необходимо также обращать внимание на состояние легких и признаки сопутствующих пороков. Например, расширение тени сердца, даже при отсутствии шумов при аускультации, может свидетельствовать о сочетанном врожденном пороке сердца, а наличие двух уровней жидкости с газовыми пузырями в проекции желудка и двенадцатиперстной кишки говорит о дуоденальной непроходимости. Частое сочетание АП с врожденными пороками сердца диктует необходимость дооперационного ультразвукового исследования сердца и крупных сосудов. Кроме того, всем детям с АП проводят нейросонографию для определения состояния головного мозга (родовая травма, внутрижелудочковые кровоизлияния, пороки развития, признаки гипоксии и др.). Пациенты с АП редко нуждаются в экстренной хирургической помощи. Большая часть больных оперируется в срочно-плановом порядке после завершения всего комплекса обследования и тщательной предоперационной подготовки, в которую входят мероприятия, направленные на стабилизацию общего состояния ребенка: санация трахеобронхиального дерева, антибактериальная терапия, инфузионная терапия. Подготовка может продолжаться в течение одних или нескольких суток, как требует того состояние ребенка – чем более выражена пневмония, чем более тяжелы неврологические проявления (или какие-либо иные расстройства), тем длительнее может быть предоперационная подготовка. Показаниями же к экстренной хирургической помощи (через несколько часов от поступления) являются следующие: Широкий нижний ТПС, когда из-за большого сброса воздуха через свищ в ЖКТ, с одной стороны снижается оксигенация крови в легких, с другой - быстро нарастает вздутие живота, что влечет за собой высокое стояние куполов диафрагмы, ограничение экскурсии легких и, в результате - усугубление дыхательной недостаточности. Неэффективность самостоятельного дыхания у таких детей вынуждает переводить их на искусственную вентиляцию легких, что приводит к еще большему газонаполнению кишечных петель и таким образом замыкает порочный круг. Кроме того, наличие широкого свища способствует регургитации кислого желудочного содержимого в трахеобронхиальное дерево. Сочетание АП (с нижним ТПС) с пороками развития ЖКТ. При этой комбинации высока опасность рефлюкса застойного содержимого желудка в трахеобронхиальное дерево. Выбор метода хирургического лечения АП определяется видом аномалии. При двух наиболее частых вариантах порока - атрезии пищевода с нижним трахеопищеводным свищом и изолированной форме атрезии пищевода применяются принципиально различные виды оперативных вмешательств (рис.3).  Рис. 3. Алгоритм выбора хирургической коррекции атрезии пищевода. Лечение АП с нижним ТПС На современном этапе развития хирургии новорожденных во всех случаях при АП с нижним ТПС создается анастомоз пищевода - первичный или отсроченный. Первичный анастомоз накладывают в том случае, когда после отсечения ТПС от трахеи и мобилизации сегментов их удается свести без значительного натяжения. Отсроченный анастомоз пищевода показан в тех ситуациях, когда, несмотря на тщательную мобилизацию сегментов, диастаз между ними остается значительным, и наложить анастомоз без существенного натяжения не представляется возможным, либо когда состояние ребенка столь тяжелое, что не позволяет произвести радикальное вмешательство. Первичный анастомоз пищевода Операцию выполняют из заднебокового доступа в 3-м межреберье справа. Экстраплеврально выделяют органы заднего средостения, мобилизуют нижний сегмент пищевода до места впадения в трахею, как правило – это средняя треть трахеи, реже - вблизи бифуркации, и, в редких случаях, главный бронх. Ориентиром для обнаружения ТПС является vena azygos, поскольку она перекидывается через пищевод и трахею вблизи места деления трахеи на бронхи. Если вена "мешает" выделению нижнего сегмента, ее можно перевязать и рассечь. Делать это надо лишь в случае крайней необходимости, так как при некоторых врожденных пороках сердца и крупных сосудов непарная и полунепарная вены являются единственными коллекторами, через которые осуществляется отток крови от нижних отделов туловища и конечностей. Выделенный нижний сегмент пищевода отсекают от трахеи, дефект стенки трахеи ушивают непрерывным швом атравматической иглой (викрил 6/0), проводят контроль герметичности шва трахеи. При мобилизации нижнего сегмента в дистальном направлении не следует выделять стенку пищевода на большом протяжении, так как внутристеночное кровообращение нижнего сегмента, по сравнению с верхним, обеднено, и при значительном выделении стенки может возникнуть ишемия ее и, как следствие этого, недостаточность швов анастомоза пищевода. Следующим этапом мобилизуют верхний сегмент пищевода. Чтобы облегчить поиск сегмента, анестезиолог вводит в него до упора толстый желудочный зонд, при этом в операционном поле становится хорошо видно дно верхнего сегмента. Сегмент выделяют из окружающих тканей, причем выделить его можно, при необходимости, вплоть до глотки, не боясь вызвать нарушение кровообращения, поскольку кровоснабжение стенки верхнего сегмента всегда полноценное. Если после мобилизации сегменты можно сопоставить без значительного натяжения, создают первичный анастомоз пищевода. Небольшим натяжением можно пренебречь. Анастомоз накладывают по типу "конец в конец" однорядным непрерывным швом атравматической иглой (викрил 6/0). Некоторые авторы рекомендуют использовать отдельные швы. Во время наложения анастомоза в желудок заводят назогастральный зонд. Операцию заканчивают постановкой дренажа в ретроплевральное пространство и послойным ушиванием раны. В послеоперационном периоде ребенка длительно (6-8 суток) держат на искусственной вентиляции легких с абсолютной синхронизацией с аппаратом, что особенно важно в тех случаях, когда анастомоз наложен с некоторым натяжением. Новорожденного следует поддерживать в состоянии глубокого медикаментозного сна и миорелаксации. Заведенный в желудок во время операции назогастральный зонд не меняют до заживления анастомоза (10-12 суток). При соблюдении этих условий анастомоз заживает в наиболее благоприятных условиях. При гладком послеоперационном течении ретроплевральный дренаж удаляют на 6-е сутки, к 8-м суткам ребенка экстубируют и начинают энтеральное питание через зонд. Как только новорожденный начнет хорошо сосать соску, его переводят на вскармливание из рожка и удаляют желудочный зонд, а затем разрешают приложить к груди. Рентгенологическое обследование с контрастным веществом (эзофагография) целесообразно производить не ранее 14-15х суток послеоперационного периода, когда ребенок уже научился хорошо сосать и риск аспирации при дискоординации акта глотания минимален. Целью обследования является определение степени проходимости анастомоза пищевода и наличия возможных осложнений, прежде всего реканализации трахеопищеводного свища. В качестве контрастного вещества используют водорастворимые препараты. Снимки выполняют в вертикальном положении в двух проекциях. На рентгенограммах практически всегда видна зона анастомоза с широким верхним сегментом и несколько суженным нижним (рис.4), но это не обязательно является признаком стеноза зоны анастомоза. 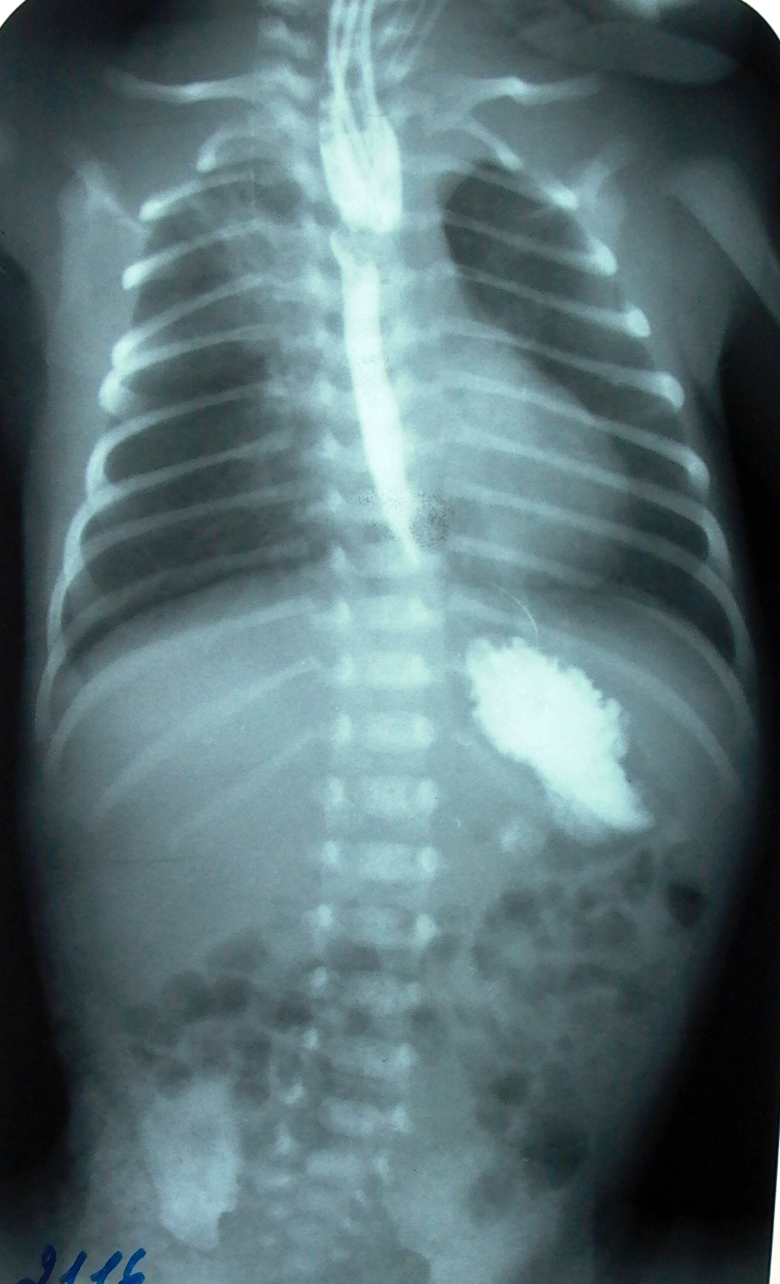 Рис. 4. Эзофагография на 14 сутки после наложения анастомоза пищевода. Для того, чтобы убедиться в действительном отсутствии стеноза зоны анастомоза всем детям на 21е сутки после операции производят "калибровочное" бужирование пищевода. Процедуру выполняют в рентгеновском кабинете под контролем экрана. Первое бужирование целесообразно делать под общим обезболиванием. Если при бужировании удается свободно провести буж №22, то на этом процедуру заканчивают, и в дальнейшем ребенок в бужировании, как правило, не нуждается. Если же при проведении бужей возникли трудности, то процедуру повторяют через день до тех пор, пока не удастся провести буж №22-24. В наиболее трудных случаях при послеоперационном стенозе пищевода приходится прибегать к бужированию по проводнику. После бужирования ребенку назначают курс лечения (масло облепихи, альмагель А, спазмолитики). Такой подход к лечению, с нашей точки зрения, наиболее рационален и позволил нам практически отказаться от наложения гастростом у детей с послеоперационным стенозом пищевода. Выписку детей из стационара осуществляют тогда, когда ребенок легко справляется с физиологическим объемом питания, прибавляет в весе, а имевшиеся дыхательные расстройства полностью устранены. Отсроченный анастомоз пищевода Ход операции от ее начала и до завершения мобилизации сегментов не отличается от описанного выше. Если, несмотря на мобилизацию сегментов, между ними сохраняется большой диастаз, или состояние ребенка не позволяет продолжать операцию, то принимается решение о наложении отсроченного анастомоза. Просвет нижнего сегмента ушивают обвивным швом наглухо, и сегмент фиксируют к межреберным мышцам максимально высоко в зоне реберно-позвоночного угла. Верхний сегмент пищевода не выводят из грудной клетки. Рану грудной клетки ушивают послойно после постановки дренажа в ретроплевральное пространство. Операцию заканчивают наложением гастростомы. Таким образом, ребенок остается с неустраненной атрезией пищевода, но с ликвидированным трахеопищеводным свищом. На протяжении последующих 8-10 недель (до операции наложения отсроченного анастомоза) необходимо обеспечить полноценный уход за малышом, заключающийся в налаживании постоянного, пассивного оттока слюны через назоэзофагеальный зонд и в частой (каждые 30 минут) активной аспирации слюны из верхнего сегмента пищевода. По мере физиологического усиления саливации к концу второго месяца жизни, частоту санаций увеличивают (каждые 10-15 минут). Хороший уход за ребенком способствует быстрому улучшению состояния пациента, что позволяет его экстубировать. В возрасте 2-2,5 месяцев проводят контрольное рентгенологическое обследование для определения величины диастаза между сегментами. С этой целью через гастростому в нижний сегмент пищевода вводят рентгеноконтрастный зонд или контрастное вещество. Одновременно контрастный зонд вводят и в верхний сегмент пищевода. На экране видно расстояние между сегментами. Как правило, указанный срок (8-10 недель) является достаточным, сегменты вырастают настолько, что становится возможным наложить прямой анастомоз пищевода без натяжения. Этапы оперативного вмешательства такие же, как и при первичном анастомозе пищевода, за исключением того, что при повторной торакотомии к органам заднего средостения возможен только трансплевральный доступ. Послеоперационное ведение соответствует описанному выше при первичном анастомозе пищевода. Гастростому закрывают через 1,5-2 месяца после наложения анастомоза, предварительно проверив рентгенологически проходимость пищевода и проведя калибровочное бужирование. Лечение изолированной формы АП Эта группа больных является наиболее сложной для лечения, так как при изолированной форме АП пищевод отсутствует на большом протяжении - верхний его сегмент, как правило, расположен не ниже Th1 , а нижний выстоит над диафрагмой всего на 3-4 см. По мнению некоторых специалистов, с ростом ребенка расстояние между сегментами сокращается, что позволяет в возрасте 3-9 месяцев наложить отсроченный анастомоз пищевода. Наш опыт и данные большинства авторов, к сожалению, не подтверждают это положение. Поэтому нами принята следующая лечебная тактика при изолированной форме АП: торакотомию этим детям не производят, а в периоде новорожденности ребенку накладывают шейную эзофагостому и гастростому или двойную эзофагостому (ДЭС), причем нижний сегмент пищевода (при ДЭС) низводят в брюшную полость из лапаротомического доступа. В возрасте 5-7 месяцев выполняют загрудинную пластику пищевода. В качестве трансплантата используют поперечный отдел ободочной кишки на левых ободочных сосудах. Трансплантат на шее анастомозируют с верхним сегментом пищевода, абдоминальный конец трансплантата вшивают в нижний сегмент по типу "конец в бок", а при недостаточной для анастомозирования с трансплантатом длине нижнего сегмента - в тело желудка (в этом случае с обязательной антирефлюксной защитой). На 7-8е сутки после операции, если нет сомнений в полном первичном заживлении всех анастомозов, начинают кормление через рот. Гастростому или нижнюю эзофагостому закрывают через 1,5-2 месяца, после предварительного рентгенологического обследования искусственного пищевода. |
