РПЗ (копия). В настоящее время более 80 всех измерений химического состава продуктов производства осуществляется физическими и физикохимическими методами
 Скачать 238.01 Kb. Скачать 238.01 Kb.
|
1 2 Практическое использование. Потенциометрический метод, который определяет pH раствора с использованием электрода, такого как стекло, очень важен на практике. То же самое верно для прямого измерения разности потенциалов (ионометрия) концентрации (активности) других ионов с использованием ионоселективного электрода. Кальциевый электрод используется в биомедицинских исследованиях, клинической медицине и т. Д. Это очень важно для практического использования. Ферментная функция и т. Д.). Известные ионоселективные мембранные электроды имеют почти одинаковую чувствительность к обоим ионам (кальций и магний) и поэтому используются для определения жесткости воды. Другой важной областью применения потенциометрии является потенциометрическое титрование кислот, оснований, солей и других веществ. Потенциометрические методы используются для анализа мутных и окрашенных растворов, а также растворов на основе смешанных и неводных растворителей. 1.3 Аппаратура и техника выполнения химического анализа При работе с обратимыми системами применяют установку потенциометрии при силе тока I = 0 (рис. 1а) и некомпенсационное титрование (рис. 1б). В работе с необратимыми системами применяют установку потенциометриии с поляризованными электродами, то есть потенциометрия при силе тока I = const (рис. 1в). Во время потенциометрического титрования по схеме «а» и «в», приведенных на рисунке 1, измеряют ЭДС потенциометрической ячейки, а при не компенсационном титровании по схеме «б» измеряют силу тока, возникающую в цепи ячейки за счет протекания химической реакции. При плавном изменении потенциала по данным зависимости «E-V» или «J-V» строят график (рис. 2). Объём раствора, пошедшего на титрование в точке эквивалентности, находят по перпендикуляру, опущенному из середины волны на ось абсцисс. При резком скачке потенциала от капли рабочего раствора (титранта) график строить необязательно. 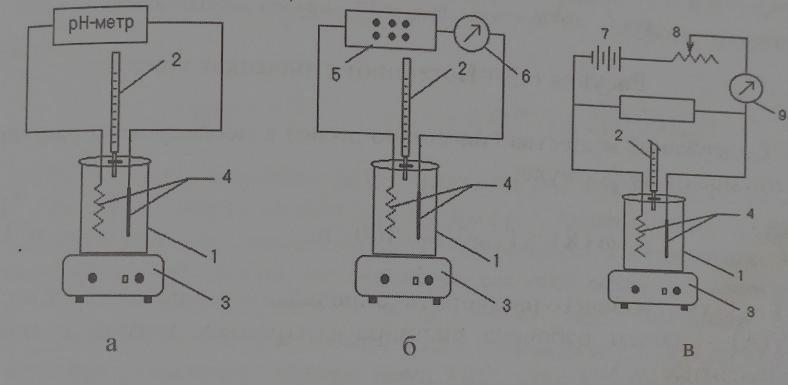 Рисунок 1 – Схемы установок для потенциометрии: 1 – стакан для титрования; 2 – бюретка; 3 – магнитная мешалка; 4 – электроды; 5 – магазин сопротивлений; 6 – микроамперметр; 7 – источник тока (10 В); 8 – реохорд на 1 мОм; 9 - гальванометр  Рисунок 2 – Потенциометрическая кривая: вид 1 – процесс окисления; вид 2 – процесс восстановления Содержание вещества (массовую долю) в исследуемом растворе рассчитывают по формуле: ω (Х) = ТА/Х · V (A) · 100/m, (1.4) где ТА/Х - титр рабочего раствора по определяемому веществу, г/мл; V (A) - объём рабочего раствора (титранта), взятый в точке эквивалентности, мл; m – масса навески исследуемой пробы, г. 1.3.1 Определение рН раствора Для измерения рН растворов составляют ячейку, состоящую из стеклянного электрода и хлорсеребряного электрода сравнения, подключенных к прибору рН – метру. Принцип измерения рН растворов. Измерительная система представлена на рисунке 3. Здесь в анализируемую среду помещены два электрода: измерительный электрод, чувствительный к ионами водорода, и электрод сравнения, потенциал которого не меняется при изменении рН и состава среды (обычно используют хлорсеребряный электрод) 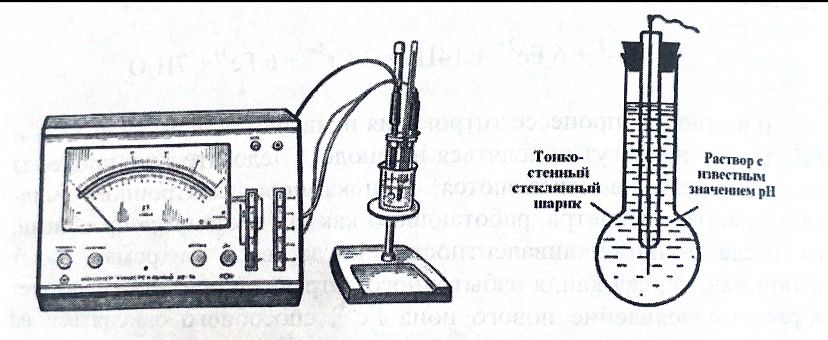 Рисунок 3 – Установка для рН – измерений и устройство стеклянного электрода Разность потенциалов Е, возникающая между электродами, измеряется высокоомным милливольтметром (рН-метром). Температура среды измеряется термометром. Так как потенциал электрода сравнения по определению остается постоянным (опорным), разность потенциалов Е обычно называют просто потенциалом электрода относительно электрода сравнения, а метод измерений – потенциометрическим. В качестве измерительного электрода для рН-измерений часто используют стеклянный электрод, который быстро и точно реагирует на изменение рН раствора. Заполнен данный электрод раствором 0,1 М соляной кислоты с известным значением рН. Потенциал такого электрода представляет собой разность потенциалов на обеих сторонах стеклянной мембраны. Считается, что при погружении стеклянного электрода в водный раствор молекулы воды проникают в силикатную решетку, образуя внешний и внутренний гидратированные слои. В процессе гидратации ионы натрия, не входящие в силикатную решетку и находящиеся в пустотах решетки, обмениваются на ионы водорода. Вследствие этого в кислых и щелочных растворах потенциал стеклянного электрода является функцией активности ионов водорода. Для уменьшения потенциала ассиметрии стеклянные электроды длительное время выдерживают в воде или в растворе 0,1 М HCL. 2 Экспериментальная часть 2.1 Методика проведения анализа Сущность потенциометрического метода анализа. Метод потенциометрического титрования основан на нейтрализации фосфорной кислоты водным раствором щелочи. Цель работы: Калибровка рН-метра; Стандартизация раствора гидроксида натрия; Определение молярной концентрации фосфорной кислоты в образце. Материалы и оборудование - магнитная мешалка с регулируемой скоростью перемешивания и магнитной мешалкой; - датчик рН – метра и аппарат SPARK; - штатив с зажимами; - пипетки; - мерный цилиндр 50 мл; - бюретка 50 мл; - стаканы объёмом 100 мл; - воронка; - пипетки Пастера; - стандартные буферные растворы; - 0,1 М стандартный раствор соляной кислоты; - раствор гидроксида натрия с (NaOH) = 0,1 М; - дистиллированная или деионизированная вода. Анализ. Калибровка рН – метра. Калибруйте рН – метр с двумя или тремя (в зависимости от руководства производителя) стандартными буферными растворами (значения рН 4, 7 и 10) в соответствии с руководством производителя оборудования. Проверьте рН контрольного буферного раствора (рН = 6,86). Стандартизировать раствор гидроксида натрия (прибл. С (NaOH) = 0,1 моль/дм3) с помощью 0,1 М раствора первичного стандарта соляной кислоты Поместите 5,00 см3 0,1 N раствора соляной кислоты первичного стандарта в химический стакан в 100 см3 и добавьте дистиллированную или деионизированную воду до 50 см3. Аккуратно поместите магнитную мешалку в стакан, содержащий раствор, и поместите стакан на магнитную мешалку. Погрузите электрод в раствор. Осторожно включите мешалку и отрегулируйте желаемую скорость перемешивания, следя за тем, чтобы стержень мешалки не попадал на электрод. Убедитесь, что рН – метр работает нормально, и позвольте показаниям на дисплее стабилизироваться. При перемешивании непрерывно добавляют раствора гидроксида натрия небольшими порциями из бюретки. Измеряйте оббьем в см3 добавленного титранта и значения рН после добавления каждой аликвоты титранта. После достижения конечной точки продолжайте титрование еще как минимум 5,00 см3. Титрование проводится не менее двух раз. Постройте график зависимости рН (по оси Y) от обьема титранта (по оси Х) с помощью миллиметровки и определите точку эквивалентности графически. Анализа исследуемого образца. Взять пипеткой 5,00 см3 образца в стакан обьемом 100 см3, добавьте 50 см3 дистиллированной или деионизированной воды. При постоянном перемешивании добавляют небольшие аликвоты раствора гидроксида натрия из бюретки. Запишите обьем в см3 добавленного титранта (V) и рН после добавления каждой аликвоты титранта. После достижения первой конечной точки продолжайте как минимум еще 5,00 см3 титранта. Титрование проводится не менее двух раз. По завершении титрования скорость магнитной мешалки устанавливается на «0». Извлеките рН – электрод и магнитную мешалку из стакана и тщательно промойте дистиллированной водой. Расчет Постройте график рН (по оси Y) и V титранта (по оси Х) с помощью Excel или миллиметровки и определите точки эквивалентности. Рассчитайте концентрацию фосфорной кислоты в образце по объёму 0,1 М раствора гидроксида натрия, использованного для титрования, до конечной точки кривой титрования. Сходимость (повторяемость) результатов анализа (А) в % рассчитывается по уравнению: А = 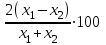 , (2.1) , (2.1)где х1 – больший результат двух параллельных измерений; х2 – меньший результат двух параллельных измерений. Рассчитайте среднее арифметические значение полученных результатов и округлите до второго знака после запятой. 2.2 Обработка результатов проведения эксперимента Калибровка рН – метра. Выполнена калибровка рН-метра, растворами с рН = 7 и рН = 9. Стандартизировать раствор гидроксида натрия (прибл. С (NaOH) = 0,1 моль/дм3) с помощью 0,1 М раствора первичного стандарта соляной кислоты Далее подготовила бюретку, залила раствор NaOH 0,1 M, и приготовила 4 раствора, где 1,2 – это HCL + H2O и 3,4 – это H3PO4 + H2O. Начала титрирование 1,2 растворов, где NaOH + HCL = NaCL + H2O, при том показатели эквивалента обозначились на одинаковом показателе V(NaOH) = 4,0. Далее титрировала небольшими аликвотами 3,4 растворы, где 3NaOH + H3PO4 = Na3PO4 + 3H2O, при том в данных титрированиях показатели эквивалента обозначились на одном показателе V(NaOH) = 8,0. После проделанной работы и убрала свое рабочее место, химический посуду и подготовилась делать график, отчет и решения. По формуле (2.2) C1V1 = C2V2 (2.2) рассчитываем концентрацию фосфорной кислоты: C2 (H3PO4) = 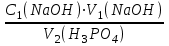 (2.3) (2.3)C2 (H3PO4)1 = 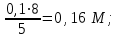 C2 (H3PO4)2 = 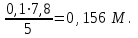 C2 (HCL) = 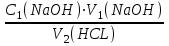 (2.4) (2.4)C2 (HCL)1 = 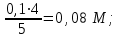 C2 (HCL)2 = 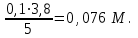 Ранее начертила графики и определила точки эквивалентности. Рассчитала сходимость результатов формуле (2.1): А = 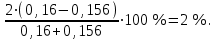 Сходимость: 100 % - 2 % = 98 %. Молярная концентрация фосфорной кислоты С = 0,16 М. Уравнение химической реакции: NaOH + HCL = NaCL + H2O Таблица 2.1 Результаты эксперимента
Уравнение химической реакции: 3NaOH + H3PO4 = Na3PO4 + 3H2O Таблица 2.2 Результаты эксперимента
3 Техника безопасности и охрана труда в химических лабораториях Многие из веществ, используемых в органической химии, являются в той или иной мере воспламеняющимися, или токсичными, или теми и другими одновременно. Поэтому при работе в лаборатории необходимо строго соблюдать основные правила техники безопасности независимо от того, какой выполняют эксперимент. 1. Категорически запрещается работать одному в лаборатории, так как в экстренном случае будет некому оказать пострадавшему первую помощь и ликвидировать последствия неудавшегося эксперимента. Работать следует только в отведенное время под контролем преподавателя или других сотрудников. 2. Необходимо соблюдать тишину, чистоту и порядок. Поспешность и неряшливость в работе часто приводят к несчастным случаям. Нельзя отвлекать от работы и отвлекать своих товарищей. Запрещается держать на лабораторном столе посторонние предметы (сумки, учебники и т.д.). 3. Категорически запрещается принимать и хранить пищу, пить водку и курить. 4. Каждый должен знать, где находятся средства индивидуальной защиты, аптечка, средства для тушения пожара. Кроме очков, в лаборатории должны быть защитные маски, респираторы и противогазы. Во всех лабораториях в легко доступных местах находятся средства для пожаротушения (ящики с песком и совком, огнетушители, противопожарные одеяла), а также аптечки, которые снабжены всеми медикаментами, необходимыми для оказания первой медицинской помощи (растворы борной кислоты, гидрокарбоната натрия, перманганата калия, танина, нашатырного спирта, а также вата, бинт, йодная настойка, активированный уголь, мазь от ожогов, склянка для промывания глаз). 5. В лаборатории необходимо находиться в застегнутом хлопчатобумажном халате. Это обеспечивает некоторую индивидуальную защиту и позволяет избежать загрязнения одежды. 6. Приступать к работе можно после усвоения всей техники ее выполнения. Если вы испытываете какие-либо сомнения в методике проведения эксперимента или в технике безопасности, прежде чем продолжить работу, проконсультируйтесь с преподавателем. 7. Нельзя проводить опыты в загрязненной посуде. Посуду следует мыть сразу после окончания эксперимента. 8. Категорически запрещается пробовать химические вещества на вкус. Нюхать вещества следует осторожно, не поднося сосуд близко к лицу, а лишь направляя к себе пары или газы легким движением руки, при этом не следует делать полный вдох. Жидкие органические вещества и их растворы запрещается набирать в пипетки ртом, для этого необходимо использовать резиновые груши и другие приспособления. 9. В процессе работы необходимо следить, чтобы вещества не попадали на кожу, так как многие из них вызывают раздражение и ожоги кожи и слизистых оболочек. 10. Все банки, в которых хранятся вещества, должны быть снабжены этикетками с соответствующими названиями. 11. Запрещается нагревать, смешивать и взбалтывать реактивы вблизи лица. При нагревании нельзя держать пробирку или колбу отверстием к себе или в направлении работающего товарища. 12. Необходимо пользоваться защитными очками в следующих случаях: а) при работе с едкими веществами (с концентрированными растворами кислот и щелочей, при дроблении твердой щелочи и т.д.); б) при перегонке жидкостей при пониженном давлении и работе с ваккум-приборами; в) при работе со щелочными металлами; г) при определении температуры плавления вещества в приборе с концентрированной серной кислотой; д) при работе с ампулами и изготовлении стеклянных капилляров. 13. Запрещено выливать в раковину остатки кислот и щелочей, огнеопасных и взрывоопасных, а также сильно пахнущих веществ. Для слива этих веществ в вытяжном шкафу должны находиться специальные сосуды с плотно притертыми крышками и соответствующими этикетками («СЛИВ КИСЛОТ», «СЛИВ ЩЕЛОЧЕЙ», «СЛИВ ОРГАНИКИ»). 14. Не разрешается бросать в раковину стекла от разбитой посуды, бумагу и вату. 15. После завершения работы необходимо отключить газ, воду, вытяжные шкафы и электроэнергию. 3.1 Правила работы в химической лаборатории Химию невозможно представить без химических опытов и экспериментов. В школах и научных учреждениях для этого предназначены специализированные помещения — химические лаборатории. В этих помещениях созданы все условия для комфортной работы. Однако не стоит забывать, что химия — наука о веществах и их превращениях, а некоторые вещества и продукты реакций вредны, опасны и токсичны. Поэтому при работе с ними требуются особые меры безопасности. Работать одному в лаборатории категорически запрещается, так как при возникновении несчастного случая некому будет оказать помощь пострадавшему и ликвидировать последствия аварии. Перед выполнением работы необходимо познакомиться с её описанием и продумать все действия, которые необходимо будет выполнить. Если при выполнении работы используются приборы и установки, то следует изучить их устройство и правила работы с ними. Во время работы в лаборатории необходимо соблюдать чистоту, тишину, порядок и правила техники безопасности. На лабораторном столе могут находиться только те вещества и предметы, которые необходимы для выполнения работы. В химической лаборатории можно работать только в специальном халате. Халат должен быть застёгнут на все пуговицы. Длинные волосы необходимо подбирать (убрать в пучок или иным способом). При проведении опытов с особо опасными веществами следует использовать респиратор, защитные очки, перчатки. Работы с токсичными, легковоспламеняющимися или горючими веществами необходимо проводить только в вытяжном шкафу с включённой вытяжкой. В лаборатории категорически запрещается хранить продукты питания и принимать пищу. При выполнении опытов необходимо использовать только целую и чистую лабораторную посуду. На любой посуде, в которой хранятся реактивы, должны быть этикетки с указанием названия веществ. Вещества не должны попадать на кожу лица и рук, так как они могут вызвать раздражение кожи и слизистых оболочек. 10. Твёрдые химические реактивы можно брать только шпателем, пинцетом или ложечкой. Категорически запрещается брать реактивы руками! 11. Работу с кислотами, твёрдыми щелочами, едкими и токсичными веществами следует проводить только в защитных очках и перчатках. При растворении твёрдых щелочей в воде необходимо добавлять щёлочь небольшими порциями в воду, избегая перегревания раствора. Разбавление кислот или щелочей необходимо производить в жаростойкой посуде. 12. При разбавлении концентрированных кислот и щелочей необходимо небольшими порциями при постоянном перемешивании приливать кислоту (или концентрированный раствор щёлочи) в воду, а не наоборот. Растворение кислот и щелочей в воде сопровождается выделением большого количества теплоты, что может привести к закипанию смеси, её разбрызгиванию и попаданию в глаза, на лицо и руки. 13. Жидкие химические вещества следует переливать, пользуясь воронкой. Склянку, из которой переливают жидкость, необходимо держать этикеткой к руке, чтобы не испортить надпись на ней. 14. Категорически запрещается набирать жидкости в пипетки ртом. Для набора жидкости в пипетку используется специальная груша. 15. Неизрасходованные реактивы нельзя высыпать или выливать обратно в сосуды, из которых они были взяты. 16. Категорически запрещается сливать в канализацию легковоспламеняющиеся и горючие жидкости, концентрированные растворы кислот и щелочей. Для их утилизации и слива используют специальные ёмкости. Категорически нельзя выбрасывать остатки неизрасходованных активных металлов, например, натрия, в канализацию или мусорное ведро — это может привести к пожару! Нельзя бросать в раковину фильтровальную бумагу, вату, стекла от разбитой посуды. 17. Нельзя зажигать спиртовку от другой спиртовки, так как спирт может пролиться и загореться, что приведёт к возникновению пожара. Нельзя задувать пламя спиртовки. Чтобы погасить пламя, спиртовку следует закрыть колпачком. 18. При нагревании растворов и веществ в пробирке необходимо использовать держатель. Пробирку следует заполнять не более чем на половину её объёма. Прежде чем приступить к нагреванию содержимого пробирки, её следует равномерно прогреть в пламени спиртовки. Во время нагревания жидких и твёрдых веществ в пробирках и колбах нельзя направлять отверстия сосудов на себя и на соседей, так как может произойти внезапный выброс вещества. Нельзя наклоняться над сосудом, в котором происходит нагревание или кипение жидкости. 19. Легковоспламеняющиеся и горючие жидкости категорически нельзя нагревать на открытом пламени, так как это может привести к пожару. 3.2 Правила ведения технической документации на выполненные работы Ведение лабораторного журнала. Лабораторный журнал — это документ, в котором в хронологическом порядке подробно указываются цели и задачи эксперимента, используемая установка и материалы, все условия проведения эксперимента, результаты измерений и т.п. Подробное и аккуратное ведение лабораторного журнала необходимо по следующим причинам: Далеко не все результаты экспериментов могут быть объяснены сразу же, поэтому лабораторный журнал должен позволять через любое время вернуться к полученным результатам и полностью восстановить, что делалось во время эксперимента, как и в каких условиях; Записи в лабораторном журнале лежат в основе любой научной публикации или отчёта; Лабораторный журнал имеет юридическую силу, так как в случае спорных вопросов позволяет исследователю защитить приоритет сделанного им открытия. Лекцию любого нобелевского лауреата украшает скан страницы его лабораторного журнала с датой сделанного открытия. Лабораторные журналы могут быть персональными или общими. В личном рабочем журнале экспериментатор ведет записи обо всех проводимых им экспериментах. Общий лабораторный журнал принадлежит научной группе или лаборатории и чаще всего «привязан» к конкретной экспериментальной установке – тогда в нем записывается информация о ходе всех работ, проводимых на данной установке. Традиционно лабораторный журнал представляет собой прочную тетрадь или журнал с пронумерованными страницами. Бывает, что тетрадь дополнительно укрепляют – прошивают ее толстой ниткой. Наличие в журнале пронумерованных страниц позволяет на его первых страницах собирать указатели на ключевые эксперименты. Все данные в журнал записываются ручкой, а не карандашом. Допускается вклеивание на страницы журнала компьютерных распечаток: таблиц, графиков и т.п. Точность и аккуратность – вот основные требования к записям в рабочем журнале. Если позже в журнале обнаружены опечатки или фактические ошибки, то исправления в журнал вносятся ручкой другого цвета. В общем лабораторном журнале обязательным требованием является то, что любая запись или исправление должны быть подписаны автором и указана дата. Достаточно часто встречается правило, что общий журнал категорически запрещается выносить из лаборатории. Заполненные лабораторные журналы хранятся в лаборатории или сдаются в архивы. Хорошим дополнительным правилом является сканирование страниц лабораторных журналов и хранение полученных файлов в нескольких копиях на разных компьютерах или носителях информации. В принципе возможно ведение лабораторного журнала сразу в электронном виде на компьютере - наверное, кто-то где-то так и делает сейчас или будет делать в будущем. При этом нужно учитывать возможность потери электронных файлов из-за технического или программного сбоя и сразу использовать системы создания резервных копий или использовать облачные хранилища данных. Чтобы журнал имел юридическую силу, каждая запись в нем должна содержать дату и время создания, электронную подпись автора, записи должны быть защищены от свободного редактирования. Так что на сегодняшний день все же наиболее распространено ведение рукописных лабораторных журналов. 3.3 Техника безопасности при работе в химической лаборатории Наиболее вероятными источниками несчастных случаев являются: неумелое обращение с химическими веществами (отравление, химические ожоги, пожары, взрывы, аллергии), с лабораторными приборами (поражение электрическим током, термические ожоги и травмы), а также со стеклянными приборами и посудой (порезы и т. д.). Допуск студентов к занятиям в лабораторию разрешается только после знакомства с инструкцией по технике безопасности и вводного инструктажа, что фиксируется личной росписью прошедших инструктаж. Лица, грубо нарушившие правила работы и техники безопасности в лаборатории, отстраняются преподавателем от выполнения лабораторных работ до сдачи зачета по технике безопасности. Ответственность за хранение реактивов, приборов, оборудования и материалов возлагается на лаборанта. Каждый работающий должен знать, где в лаборатории находятся аптечка и средства для оказания первой медицинской помощи, индивидуальные средства защиты (перчатки, противогаз, фартук), средства пожаротушения (ящик с песком, огнестойкое одеяло, огнетушитель). В конце занятий все студенты обязаны навести порядок на своем рабочем месте, проверить выключение электроэнергии, воды, приборов и аппаратов, убрать легко воспламеняющийся мусор, вымыть стеклянную посуду, сдать реактивы лаборанту. После этого сдать рабочее место дежурным по лаборатории, которые в свою очередь сдают лабораторию лаборанту. 3.4 Первая помощь при несчастных случаях. Противопожарная безопасность Несчастные случаи в лаборатории могут быть вызваны термическими, химическими ожогами, ранениями и отравлениями. Для оказания первой помощи в лаборатории должна быть аптечка: бинты, вата, раствор уксусной кислоты 8 %, 3-5 % раствор йода, 1 % раствор борной кислоты, 2,5 % раствор двууглекислого натрия и другие. В тяжёлых случаях необходимо обратится к врачу. Ожоги: при термических ожогах (огнём, паром, горячими предметами) первой степени (покраснение) на обожженное место следует наложить вату, смоченную 96 % спиртом этиловым. При ожогах второй степени (появление пузырьков) поступаю так же или накладывают вату, обработанную 3-5 % раствором марганца. В случае ожога третьей степени (разрушение тканей) раны накрывают стерильной салфеткой и немедленно вызывают врача. При химических ожогах кислотами, обожженное место обильно промывают водой, прикладывают примочки из 5 % раствора соды или фурацилина. При ожогах второй степени повязку со стрептоцидовой или синтомициновой эмульсией. При химических ожогах щелочами и концентрированными растворами аммиака обожженное место обильно промывают водой и накладывают повязки из 5 % раствора уксусной кислоты, лимонной кислоты. При ожогах негашеной известью, известь смывают и смазывают растительным маслом или вазелином. При ожоге формалином, обожженное место промыть водой. При попадании кислоты, щёлочи в глаз необходимо немедленно промыть большим количеством воды в течении 10-30 минут. Затем в случае ожога кислотой 2-3 % раствором бикарбоната натрия, при ожоге щелочью 2 % раствором борной кислоты, при попадании аммиака 0,5-1 % раствором квасцов. При химических ожогах полости рта щелочью, рот прополаскивают 3 % раствором уксусной кислоты или 2 % раствором борной кислоты. При ожогах кислотами рот прополаскивают 8 % раствором бикарбоната натрия. Ранения: при ранении стеклом рану очищают от осколков, а затем убедившись, что осколков стекла нет, смазывают йодом и завязывают бинтом. При сильных кровотечениях выше раны накладывают жгут, который можно держать не более 2 ч, обязательно под жгут следует положить записку с точным временем наложения жгута. Отравления: во всех случаях отравление химикатами следует немедленно вызывать врача или пострадавшего немедленно отправлять в медпункт. В исключительных случаях при отравлении щелочами пострадавшему следует дать выпить молоко или 2 % раствор уксусной или лимонной кислоты, при отравлении кислотами дать выпить воду со льдом, 1 % раствор питьевой соды. Противопожарная безопасность. Все помещения лаборатории должны соответствовать требованиям пожарной безопасности по ГОСТ и иметь средства пожаротушения. Лаборатория должна быть оснащена пожарными кранами (не менее одного на этаж) с пожарными рукавами. В каждом рабочем помещении должны быть в наличии огнетушители и песок, а в помещениях с огнеопасными и легковоспламеняющимися веществами - дополнительные средства пожаротушения. В помещении лаборатории на видном месте должен быть вывешен план эвакуации сотрудников в случае возникновения пожара. Распоряжением по лаборатории из числа сотрудников назначается группа (3 - 5 человек), которая организует все противопожарные мероприятия, получив инструктаж местной пожарной команды. Все сотрудники лаборатории должны быть обучены правилам обращения с огне- и взрывоопасными веществами, газовыми приборами, а также должны уметь обращаться с противогазом, огнетушителем и другими средствами пожаротушения, имеющимися в лаборатории. В помещениях лаборатории и в непосредственной близости от них (в коридорах, под лестницами) запрещается хранить горючие материалы и устанавливать предметы, загромождающие проходы и доступ к средствам пожаротушения. Курить в помещениях лаборатории строго запрещается! Без разрешения начальника лаборатории и лица, ответственного за противопожарные мероприятия, запрещается установка лабораторных и нагревательных приборов, пуск их в эксплуатацию, переделка электропроводки. Все нагревательные приборы должны быть установлены на термоизолирующих подставках. Запрещается эксплуатация неисправных лабораторных и нагревательных приборов. После окончания работы необходимо отключить электроэнергию, газ и воду во всех помещениях. Каждый сотрудник лаборатории, заметивший пожар, задымление или другие признаки пожара обязан: - немедленно вызвать пожарную часть по телефону; - принять меры по ограничению распространения огня и ликвидации пожара; - поставить в известность начальника лаборатории, который в свою очередь должен известить сотрудников, принять меры к их эвакуации и ликвидации пожара. ЗАКЛЮЧЕНИЕ Главное преимущество потенциометрического метода по сравнению с другими методами анализа - быстрота и простота проведения измерений. Время установления равновесного потенциала индикаторных электродов мало, что удобно для изучения кинетики реакций и автоматического контроля технологических процессов. Используя микроэлектроды, можно проводить определения в пробах объемом до десятых долей, см3. Потенциометрический метод дает возможность проводить определения в мутных и окрашенных растворах, вязких пастах, при этом исключая операции фильтрации и перегонки. Потенциометрические измерения относят к группе неразрушающих способов контроля, и анализируемый раствор может быть использован для дальнейших исследований. Погрешность определения при прямом потенциометрическом измерении составляет 2-10 %, при проведении потенциометрического титрования - 0,5-1,0 %. Интервал определения содержания компонентов потенциометрическим методом в различных природных и промышленных объектах - в пределах от 0 до 14 рН для стеклянных электродов, и от 10 до 10-5 (10-7) М определяемого иона для других типов ионоселективных электродов. Одним из достоинств метода потенциометрического титрования является возможность полной или частичной его автоматизации. Автоматизировать можно подачу титранта, запись кривой титрования, отключение подачи титранта в заданный момент титрования, соответствующий точке эквивалентности. Выполнила лабораторную работу по заданной теме. Я использовала соляную кислоту и фосфорную кислоту. В результате произошел скачок 9,90 при объеме соляной кислоты 4. Второй раз был скачок с результатом 9,66 при объеме 3,8. Следующая кислота – фосфор. Первый раз, когда я работала с этой кислотой, был скачок с результатом 5,01 при громкости 8. Второй раз был скачок с результатом 4,17 при объеме 7,8. По этим объемам я нарисовала 4 графика. Весь ход лабораторной работы я показала в своей курсовой работе. ЛИТЕРАТУРА 1. Абилканова Ф.Ж. Аналитическая химия. Химические методы анализа. – Алматы: Бастау, 2018. 2. Васильев В.П. и др. Аналитическая химия: Лабораторный практикум. – М.: Дрофа, 2006. 3. Гавва Н.Ф., Мантлер С.Н., Жуманазарова Г.М. Физико-химические методы анализа. – Алматы: Бастау, 2018. 4. Золотов Ю.А. Основы аналитической химии. – М.: Академия-Медиа, 2004.                       Дата Подпись № докум. Изм. Лист ЛистКР 0816000.0000.22 РПЗ 1 2 |
