Коллок2. Вариант 1 Основные положения спектроскопии. Спектр электромагнитного излучения
 Скачать 2.57 Mb. Скачать 2.57 Mb.
|
|
Электронные, колебательные и вращательные спектры молекул. Вращательная спектроскопия — вид микроволновой спектроскопии. Она измеряет поглощение или излучение света молекулами, для понимания изменений в их вращательной энергии. Электронная спектроскопия позволяет с высокой точностью определять наличие в молекулах определенных структурных групп (называемых хромофорными), для которых хорошо изучены характеристические электронные спектры. Колебательная спектроскопия – семейство методов исследования строения вещества по колебательным спектрам поглощения или рассеяния света, связанным с переходами между энергетическими состояниями, характеризующимися различными колебаниями атомов относительно равновесных положений. Вероятности электронных переходов. Электронная спектроскопия изучает электронные переходы между валентными молекулярными орбиталями. ??? Характеристики спектральных линий: положение в спектре, интенсивность . Спектральная линия — узкий участок спектра электромагнитного излучения, где интенсивность излучения усилена либо ослаблена по сравнению с соседними областями спектра. Положение линии в спектре обычно задаётся Интенсивность линий в спектре зависит от вероятности перехода из начального состояния is в конечное состояние fs. 2.Газовая хроматография: Газо-адсорбоционная и газо-жидкостная хроматографии. 1.Газо-адсорбоционная- адсорбционная хроматография. Разделение в газо-адсорбционной хроматографии достигается за счет различной адсорбции на НФ. 2.газо-жидкостная- распределительная хроматография. НФ – высокомолекулярная жидкость, нанесенная на твердый носитель. Разделение достигается за счет различной растворимости компонентов образца в ПФ и НФ. Схема газового хроматографа. 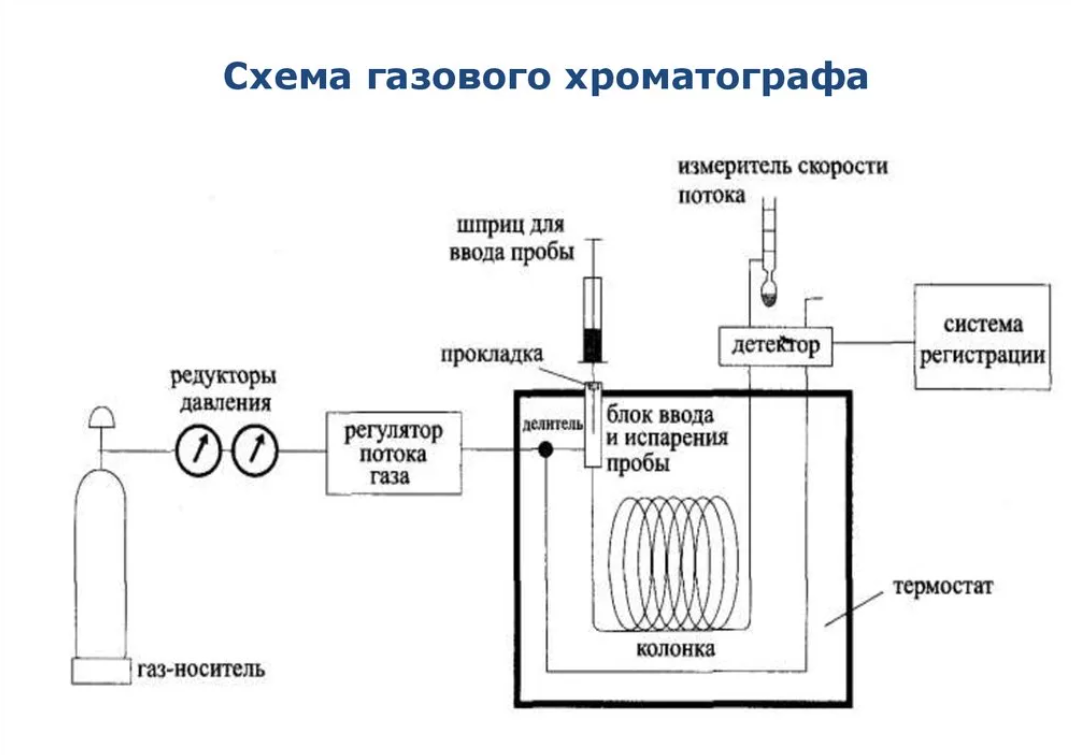 Подвижные и неподвижные фазы. В качестве подвижной фазы выступает газ (газ-носитель), а в качестве неподвижной фазы - твердый сорбент или жидкость, нанесенная на инертный твердый носитель или внутренние стенки колонки. Концепция теоритических тарелок. Теория теоретических тарелок является формальной и основана на представлении, что хроматографируемое вещество проходит через слой сорбента не непрерывным потоком, а порциями, распределяясь между подвижной и неподвижной фазами на отдельных элементарных участках слоя - так называемых «тарелках». Через каждую такую тарелку вещество проходит периодическими толчками. При этом предполагается, что за время каждого толчка, т. е. практически мгновенно, на тарелках успевает установиться равновесие распределения всех компонентов между подвижной и неподвижной фазами. Уравнение Ван Деемтера: интерпретация слагаемых и причины их возникновения. Уравнение Ван-Деемтера[1] используется в хроматографии и описывает зависимость между высотой, эквивалентной теоретической тарелке, и средней линейной скоростью подвижной фазы.  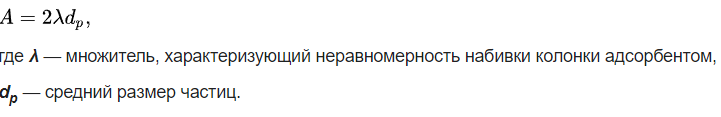   Вариант 4. 1.Молекулярная электронная спектроскопия (спектрофотометрия) Основные законы поглощения электромагнитного излучения. поглощение веществом электромагнитного излучения подчиняется определённым законам, которые справедливы для любых частиц (атомов, молекул) и любых видов электромагнитного излучения. Основные положения и законы абсорбции излучения справедливы для всех областей спектра – от рентгеновского до радиоизлучения. Количественно поглощение излучения системой описывается законами Бугера – Ламберта – Бера и аддитивности. Связь аналитического сигнала с концентрацией определяемого компонента: вывод уравнения Бугера-Ламбера-Бера.  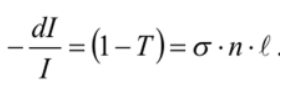  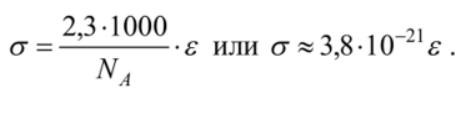   Устройство спектрофотометра. 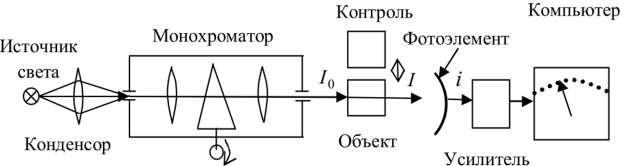 Области применения спектрофотометрического анализа. Для проверки сырья в различных производственных процессах. В синтетической химии в качестве предварительного исследования идентичности соединений. Часто проверяется наличие или отсутствие карбонильной группы. Это трудно определить любым другим методом. Для идентификации наркотиков. При проверке пленок, покрытий и упаковочных пластиков. Для количественного анализа. Для обнаружения полиморфов лекарств (это разные кристаллические формы молекулы, имеющие различные физические свойства, например, растворимость и температуру плавления, что может быть важным в процессе производства и биодоступности). 2.Хроматография: Явление, лежащее в основе разных видов хроматографии. По признаку природы явлений, лежащих в основе разделения, хроматографию подразделяют на четыре основных вида: адсорбционная, распределительная, осадочная и эксклюзионная. В основе адсорбционной хроматографии лежит адсорбция разделя-емых веществ на твердой поверхности выбранного адсорбента. В основе распределительной хроматографии лежит различная растворимость разделяемых веществ в жидкости. Разделение протекает на границе двух фаз, несмешивающихся между собой, – неподвижной (жид-кости) и подвижной (жидкости или газа), поэтому процесс разделения определяется различием коэффициентов распределения разделяемых веществ между обеими фазами. В основе осадочной хроматографии лежит образование нераство-римых соединений в результате химических реакций разделяемых веществ с реактивом-осадителем. Эксклюзионная хроматография представляет собой жидкостную хроматографию, основанную на различной способности молекул разного размера проникать в поры неионогенного геля, который служит неподвижной фазой. Качественный и количественный хроматографический анализ. Хроматографические методы анализа устанавливают качественный и количественный состав вещества. При качественных испытаниях пробу идентифицируют по ее хроматограмме, сравнивая полученные параметры с эталонными значениями, хранящимися в библиотеке данных. Количественный метод анализа строится на измерении пиков, формирующихся в зависимости от концентрации примесей. Лаборант изучает хроматограмму одним из следующих методов: Метод абсолютной градуировки. Зависимость параметров пика от концентрации разных веществ определяется экспериментально. Затем составляются графики и таблицы, с которыми в последующем и сравнивается хроматограмма. Благодаря простоте и высокой точности, метод является основным для выявления микропримесей. Метод внутренней нормализации. Сумма выбранных пиковых параметров (например, их высота или площадь) принимается за 100%. Далее рассчитывается отношение высоты отдельного изучаемого пика к суммарному значению, благодаря чему определяется массовая доля конкретного компонента в пробе. Метод внутреннего стандарта. В смесь вводится стандартное вещество, для которого заранее известен калибровочный график. Затем пики изучаемых компонентов сравниваются с пиками «стандарта». Метод применяют в случае исследования составов с переменным, но известным количеством анализируемых компонентов. Колонки : виды и особенности. Хроматографические колонки бывают двух основных типов – насадочные и капиллярные. Насадочным. оборудования, при котором оно равномерно заполнено твердой фазой — силикагелем, оксидом алюминия, целлюлозой. Капиллярным. Неподвижная фаза не занимает весь объем трубки, а нанесена на ее внутренние стенки тонким слоем. Носитель с растворенным веществом проходит по колонке с большой скоростью, разделяясь на поверхности адсорбента. Подобный способ хроматографии позволяет увеличить скорость и точность анализа, поэтому является предпочтительным для разделения большинства сложных веществ. Капиллярные колонки делят на: – открытые (незаполненные); – открытые с пористым слоем ; – открытые с твердым носителем . Основные типы детекторов. Хроматографический детектор – это прибор, преобразующий результаты разделения в форму, удобную для регистрации самописцем. Из существующих типов детекторов, используемых в газовой хроматографии, наиболее распространенные – это пламенно-ионизационный детектор (ПИД) и детектор по теплопроводности (ДТП),называемый термокондуктометрическим. Уравнение Голея и его отличие от уравнения Ван Дееметра.  Уравнение Голея Уравнение ГолеяКоэффициент CК в уравнении Голея, в отличие от уравнения Ван-Деемтера, учитывает не только замедленность массопереноса из газовой фазы в НФ и в обратном направлении, но и так называемую динамическую (или поперечную) диффузию. Области применения газовой хроматографии. С помощью газового хроматографа можно проводить анализ летучих веществ, а также полулетучих или даже нелетучих веществ, если придать им свойства летучести. Применения газовой хроматографии: Производственный анализ: - переработка нефти и газа - пластмассы - фармацевтика - химический синтез - парфюмерия - продукты питания - Экологический мониторинг: -Недропользование: - Судебно-медицинская экспертиза: Вариант 5. 1.Молекулярная электронная спектроскопия (спектофотоиетрия) Вывод уравнения Бугера-Ламберта-Бера.   Молярный коэффициент поглощения и его физический смысл. Молярный коэффициент светопоглощения (ε) – является основной характеристикой поглощения любой системы при данной длине волны. Физический смысл: молярный коэффициент поглощения представляет собой оптическую плотность раствора с концентрацией 1 моль/л, помещенного в кювету с толщиной поглощающего слоя 1 см. ε – имеет размерность см 2 /моль, т.к. А – безразмерная величина. Молярный коэффициент поглощения зависит от длины волны падающего света, температуры раствора и природы растворенного вещества и не зависит от толщины поглощающего слоя и концентрации растворенного вещества. Молярный коэффициент светопоглощения (ε) отражает индивидуальные свойства окрашенных соединений и являются их определяющей характеристикой Применение метода определения концентрации веществ. Процесс измерения концентрации различных веществ методом измерения преломления и определения коэффициента преломления .определения концентрации веществ в медицине, биологических исследованиях, в аналитической химии, фармацевтике; Интервал оптимальных оптических плотностей. Оптимальный интервал оптической плотности равен примерно 0,1-1,0. Области применения и метрологические характеристики. Высокая чувствительность приборов к наличию посторонних веществ, а также способность устанавливать, что в исследуемой пробе происходят химические реакции обусловили применение спектрофотометров в медицинских и фармацевтических целях. Также, как и с медициной, высокая чувствительность приборов позволяет устанавливать наличие малых количеств примесей в исследуемых образцах, что положительно влияет на качество и скорость анализа. Способность спектрофотометров работать с твёрдыми и жидкими пробами приводит к незаменимости этих приборов на металлургических и химических производствах. Высочайшая чувствительность метода позволяет определять даже мизерные, следовые количества многих веществ. В работе, связанной с анализом сточных и природных вод, это свойство спектрофотометров делает приборы незаменимыми при обнаружении наиболее опасных примесей. 2.Жидкостная хроматография. Определение жидкостной хроматографии. Жидкостная хроматография (ЖХ) - метод разделения и анализа сложных смесей веществ, в котором подвижной фазой является жидкость. Подвижная фаза в жидкостной хроматографии выполняет двоякую функцию: 1) обеспечивает перенос десорбированных молекул по колонке (подобно подвижной фазе в газовой хроматографии); 2) регулирует константы равновесия, а, следовательно, и удерживание в результате взаимодействия с неподвижной фазой (сорбируясь на поверхности) и с молекулами разделяемых веществ. Виды жидкостной хроматографии. ЖХ подразделяется на варианты в соответствии с характером основных проявляющихся межмолекулярных взаимодействий: – в ситовой хроматографии разделение компонентов осуществляется за счет разницы в растворимости молекул при их прохождении (фильтрации) через слой сорбента; – в адсорбционной хроматографии – за счет разницы в адсорбируемости молекул, проходящих через слой частиц сорбента, покрытых неподвижной фазой в виде тонкого слоя или поверхностнопривитых радикальных групп. – в ионообменной и ионной хроматографии – за счет разницы в способности к обмену ионами с ионообменниками; Нормально-фазовый и обращенно-фазовый вариант жидкостный хроматографии. Разделение методом нормально–фазовой хроматографии осуществляется в результате взаимодействия вещества с адсорбентами, такими как силикагель или оксид алюминия, имеющими на поверхности активные центры. Вариант жидкостной хроматографии, в котором используют сорбент с привитыми неполярными (как правило, длинными алкильными, С8 и С18, или алкилсилильными) группами и полярный растворитель (водно–метанольные, водно–ацетонитрильные смеси). Существует принципиальное различие между процессами сорбции на полярных поверхностях из относительно неполярных растворителей 11 (нормально–фазовый режим) и сорбции из воды либо сильнополярных растворителей на поверхностях неполярных. Причиной ассоциации на неполярных поверхностях являются так называемые сольвофобные взаимодействия в подвижной фазе. Уравнение Губера и его отличие от уравнения Ван Деемтера. 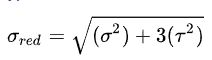 уравнение Губера уравнение ГубераСхема жидкостного хроматографа.  Анализируемые объекты, возможности метода. Жидкостная хроматография - это метод разделения пробы на компоненты, современный жидкостный хроматограф включает в себя не только систему разделения, но и систему количественного измерения содержания каждого компонента, т.е. систему детектирования (вместе с системой обработки хроматографического сигнала). Вариант 6 Классификация видов люминесценции по источникам возбуждения, механизму и длительности свечения. Закон Стокса-Ломмеля, правило зеркальной симметрии Лёвшина. Факторы, влияющие на интенсивность люминесценции. Тушение люминесценции. Диаграмма Яблонского-Теренина. Классификация видов люминесценции по источникам возбуждения, механизму и длительности сечения. Люминесценция–излучение, представляющее собой избыток над тепловым излучением тела, если его длительность после прекращения внешнего воздействия значительно превышает период световых колебаний. Люминесценция по виду возбуждения разделяется: Фотолюминесценция (возбуждение светом) Радиолюминесценция (возбуждение проникающей радиацией) Кандолюминесценция (возбуждения при механических воздействиях) Электролюминесценция (возбуждение электрическим полем) Хемилюминесценция (возбуждение при химических реакциях),биолюминесценция радикалорекомбинационная люминесценция Лиолюминесценция (возбуждение при растворении кристаллов) По длительности свечения разделяют: флуоресценцию (быстрозатухающая люм-ия) фосфоресценцию(длительная люм-ия) По механизму: Резонансная Метастабильная(вынужденная) Спонтанная |
