Вещества кислотного характера
 Скачать 0.5 Mb. Скачать 0.5 Mb.
|
Вещества кислотного характера:
Вещества нейтрального характера:
Вещества основного характера:
Общими методами изолирования «нелетучих» ядов являются: 1. Изолирование подкисленным этанолом. 2. Изолирование водой, подкисленной щавелевой кислотой. Оба метода вначале были разработаны для алкалоидов, а затем применены и к другим веществам. 3. Изолирование нейтральным ацетоном. 2.Теоретические основы метода изолирования, уравнение Гендерсона. Этапы изолирования токсикантов из биологического материала. Большинство «нгелетучих» ядов, являясь слабыми кислотами или слабыми основаниями, способны существовать в водном растворе в виде ионизированных или неионизированных (молекулярных) форм в зависимости от рН среды. Степень ионизации вещества (слабой кислоты или слабого основания) и необходимое для этого значение рН могут быть определены из уравнения степени ионизации (Гендерсона): 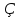 =100/1+ant log(pKa-pH) – для кислот =100/1+ant log(pKa-pH) – для кислот∝=100/1+ant log(pH-pKa) – для оснований pKa – показательионизации вещества этапы: изолирование из биологического обьекта очистка идентификация колличественное определение Изолирование нелетучих ядов из биологического материала основано на различной растворимости их ионизированно и молекулярной форм в воде и орг растворителях и на коэффициентер распределения молекулярной формы между водной и органической фазами. В процессе изолирования нелетучих ядов из биологического материала взаимодействуют 3 компонента: яд, биологический материал и экстрагент. При исследовании тканевого материала изолирование состоит из двух стадий: 1. Извлечения яда из твердой фазы в водную, 2. Извлечение яда из водной фазы в орг растворитель.
К экстрагенту предъявляются следующие основные требования: • способность легко проникать в клетки тканей; • высокая растворяющая способность (по отношению к яду); • селективность (по отношению к анализируемым соединениям). Селективный растворитель в какой-то мере исключает загрязнение вытяжки балластными веществами – жирами, белками, пигментами и другими. Растворители, которые обладали бы всеми этими свойствами в полной мере, встречаются редко. В химико-токсикологическом анализе наиболее часто используются следующие растворители: диэтиловый эфир, хлороформ, бензол, н-амилацетат, этилацетат, н-бутиловый, изоамиловый, изобутиловый спирты, н-гексан, н-гептан. Количество экстрагента обычно берётся вдвое больше по отношению к весу органов (1 : 2). Большие количества экстрагента, хотя и увеличивают эффективность экстракции, приводят к разбавлению извлечения и усложнению последующих операций, связанных с концентрированием веществ в извлечении. Время экстракции определяется моментом наступления равновесия в концентрациях вещества между твёрдой и жидкой фазами, что устанавливается экспериментально (по прекращению прироста концентрации вещества в экстрагенте). Для воды оно меньше (около 2 часов) по сравнению с этанолом (более 4 – 6 часов).
За счёт экстрагирования веществ вначале из кислого, а затем из щелочного водного раствора, их можно разделить на 2 подгруппы: 1. Вещества, экстрагируемые органическими растворителями из кислого раствора (вещества кислотного, нейтрального и частично слабоосновного характера). 2. Вещества, экстрагируемые из щелочного раствора (вещества основного и частично слабоосновного характера). Вещества со слабо выраженными основными свойствами могут частично перераспределяться из одной подгруппы в другую. К ним относятся производные пурина: кофеин, теобромин, теофиллин; опийные алкалоиды: папаверин, наркотин; производные индола: бруцин, стрихнин; стероидоподобный алкалоид – вератрин; некоторые синтетические лекарственные средства: антипирин, амидопирин, промедол; производные фенотиазина – аминазин и др. Для веществ нейтрального характера, не способных к ионизации, практически не требуется создания определённого значения рН, т.к. они экстрагируются органическим растворителем в молекулярной форме из любой среды. Разделение веществ на 2 подгруппы в значительной степени облегчает проведение последующего ненаправленного анализа с целью обнаружения неизвестного яда. На второй стадии изолирования продолжают играть свою роль уже рассмотренные выше факторы, такие, как: 1) растворимость яда, которая определяется степенью ионизации а и регулируется величиной рН среды; 2) природа экстрагента, его объём, время и кратность экстракции. Если на первой стадии изолирования веществ данной группы мы стремились перевести их в ионизированное состояние и сделать водорастворимыми, то на второй стадии наша задача заключается в том, чтобы перевести вещества в неионизированную (молекулярную) форму (а > 0), которая хорошо экстрагируется из водной фазы неполярным органическим растворителем. Необходимое для этого значение рН может быть рассчитано из уравнения, имеющего следующий вид: рН = рКа – 2 (3) для кислот, рН = рКа + 2 (3) для оснований. Понятно, что для веществ кислого характера на этой стадии требуется создание кислой среды, а для основных – щелочной. В качестве экстрагентов веществ из водной фазы подбирают неполярные органические растворители, которые: а) не смешиваются с водой и по удельному весу (d) значительно отличаются от нее, что предотвращает образование эмульсий в процессе экстрагирования (d = 1,0); б) имеют низкую температуру кипения, что облегчает их упаривание из экстракта; в) хорошо растворяют изолируемое вещество и обеспечивают высокий коэффициент распределения его между водной и органической фазами (Кр = Со/Св). Коэффициент распределения можно увеличить, добавив в водную фазу электролит, который способствует вытеснению вещества из водной фазы в слой органического растворителя за счет понижения его растворимости в воде (разрушение сольватной оболочки молекул). В качестве электролита используют натрия сульфат, аммония сульфат, натрия хлорид. По данным проф. В.Ф. Крамаренко, наиболее подходящим электролитом при изолировании алкалоидов является аммония сульфат. Наличие электролита в водной фазе приводит также к осаждению белков, что служит своеобразной очисткой полученного извлечения. Избыточное количество электролита, особенно при изолировании соединений кислотного характера, может привести к значительным потерям искомых веществ за счёт их осаждения. Исходя из перечисленных выше требований, наиболее подходящим экстрагентом для веществ кислотного характера является эфир, а для веществ основного характера хлороформ.
Необходимый объём экстрагента при однократной экстракции можно рассчитать, исходя из уравнения степени экстракции (Е): 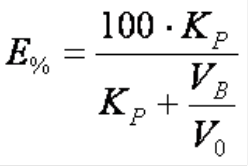 где: КP – коэффициент распределения; VВ – объём водной фазы; V0 – объём органической фазы. Время экстракции обычно не превышает 5 минут, т.к. экспериментально доказано, что за этот период времени большинство органических соединений переходит из водной в органическую фазу. Кратность экстракции обычно составляет 2 – 3, что обеспечивает полноту извлечения вещества за счёт поступления свежих порций растворителя. Влияние температуры на экстракцию. Изменение температуры влияет на константу распределения экстрагируемого вещества. Это объясняется тем, что при изменении температуры изменяется растворимость экстрагируемых веществ в каждой фазе, а также изменяется взаимная растворимость органической и водной фаз. Причем с изменением температуры растворимость вещества в каждой фазе изменяется неодинаково. При изменении температуры может изменяться диссоциация и ассоциация вещества в соответствующей фазе. Поэтому при изменении температуры изменяется гидратация (сольватация) и экстрагируемость химических соединений. Влияние электролитов на экстракцию. Понижение растворимости веществ в водных растворах под влиянием электролитов называется высаливанием, а повышение растворимости – всаливанием. Высаливание является фактором, понижающим растворимость веществ в воде и повышающим их экстрагируемость органическими растворителями из водных растворов.
1. Изолирование подкисленным этанолом. 2. Изолирование водой, подкисленной щавелевой кислотой. Первые два метода вначале были разработаны для алкалоидов, а затем применены и к другим веществам. 3. Изолирование нейтральным ацетоном. 1) первый этап изолирования лекарственных веществ подкисленной водой (спиртом) из внутренних органов, когда токсикант из куска потроха переходит в воду... вторым этапом будет обычная жидкость-жидкостная экстракция - из воды в органический растворитель; 2) так называемая твердофазная экстракция, когда жидкая проба биоматериала (кислотный гидролизат биоматериала, разбавленная моча, плазма крови...) пропускается через патрон, содержащий специальный сорбент (например, пришитую углеводородную "щетку" С18); вначале создаются условия, при которых необходимый токсикант "садится" на этот сорбент, затем вымывается все лищнее, затем проводится десорбция в небольой объем подходящего растворителя. Достаточно много реимуществ перед обычной ЖЖЭ.
Изолирование подкисленным этанолом Самый первый метод изолирования подкисленным спиртом, названный по имени авторов методом Стаса – Отто, применялся только для алкалоидов. В дальнейшем это метод претерпел серьёзные изменения и стал использоваться не только для алкалоидов, но и для многих других ядовитых и сильнодействующих веществ, имеющих токсикологическое значение. Современная модификация метода состоит из этапов: • Настаивание измельчённого объекта с этиловым спиртом, подкисленным щавелевой кислотой до рН 2 – 3, в течение суток. Спирт берётся в количестве, необходимом для покрытия объекта до «зеркала». Спиртовое извлечение сливается и вся операция повторяется трехкратно. • Упаривание объединённых спиртовых извлечений при температуре 40 – 50 0С до густого остатка, в который по каплям добавляют абсолютный этанол для коагуляции белков. Осадок отфильтровывают и всю операцию осаждения повторяют по мере необходимости до полного удаления белковых соединений. • Упаривание фильтрата при той же температуре до густого остатка и разбавление горячей водой для удаления смолистых веществ, жиров и пигментов. Осадок отфильтровывают. • Экстрагирование веществ кислого, нейтрального и слабоосновного характера из водного фильтрата хлороформом при рН = 2 (трёхкратная экстракция), отделение органической фазы и концентрирование полученного извлечения упариванием (фракция А, «кислое» извлечение). • Подщелачивание оставшегося после разделения фаз водного слоя до рН 9 – 10, экстрагирование веществ сильноосновного характера (трёхкратная экстракция) хлороформом, отделение органической фазы и концентрирование упариванием (фракция Б, «щелочное» извлечение). Достоинства метода заключаются в следующем: 1. Метод универсален, т.к. этанол является хорошим растворителем для многих веществ этой группы (как ионизированных, так и молекулярных форм). 2. Метод предусматривает очистку извлечения от балластных веществ, в результате чего получаются чистые хлороформные извлечения, не дающие эмульсий при экстрагировании веществ из водной фазы хлороформом. Метод даёт возможность изолировать до 30 % барбитуратов и 20 – 25 % алкалоидов. К недостаткам метода следует отнести: 1. Длительность (8 – 10 рабочих дней) и многостадийность. Большое количество операций, связанных с осаждением белков и фильтрованием, ведёт к значительным потерям искомых веществ (алкалоиды теряются на 25 – 50 %). 2. Сравнительная дороговизна метода (на 1 исследование тратится до 500 мл этанола). Все это приводит к тому, что классический метод Стаса – Отто теряет своё былое значение и постепенно заменяется более быстрыми, эффективными и экономными методами извлечения подкисленной водой. В настоящее время метод применяется, главным образом, для исследования гнилостно изменённого биологического материала.
Схема изолирования по методу Васильевой заключается в следующем:
• Подщелачивание оставшегося после разделения фаз водного слоя раствором аммиака до рН 9 – 10, экстрагирование веществ основного характера трёхкратной экстракцией хлороформом, отделение органической фазы и концентрирование упариванием (фракция Б, «щелочное» извлечение). По сравнению с изолированием подкисленным спиртом извлечение водой, подкисленной щавелевой кислотой, обладает рядом преимуществ: 1. Быстрота (анализ можно провести в течение одного рабочего дня). 2. Меньшее количество операций, меньшие потери искомых веществ (алкалоиды извлекаются на 30 – 40 %). 3. Экономичность и дешевизна, т.к. дорогой спирт заменён водой. Недостатком метода является образование стойких эмульсий при экстрагировании веществ из водной фазы хлороформом, особенно при исследовании гнилостного биоматериала, т.к. метод не предусматривает очистки извлечений. 9. 9.Метод изолирования веществ амфифильным ацетоном (метод В.А. Карташова): методика, преимущества и недостатки метода Является общим методом изолирования веществ. Изолирование нейтральным ацетоном. Методика. Измельченную навеску биологического материала массой 5 г экстрагируют 10 мл ацетона в течение 10 минут, центрифугируют. Полученное извлечение сливают, операцию экстрагирования ацетоном повторяют ещё 2 раза по 5 мл. Извлечения объединяют. К объединенному извлечению добавляют 20 мл 0,5 н раствора хлористоводородной кислоты, перемешивают и экстрагируют гексаном дважды. Гексановые извлечения, содержащие примеси, отбрасывают. Из очищенного вводно-ацетонового извлечения (рН=1) эфиром экстрагируют вещества кислотного характера. Далее вводно-ацетоновую фазу подщелачивают гидроксидом аммония до Рн=9, добавляют 5 г хлорида натрия (высаливающий агент) и экстрагируют вещества основного характера эфиром. Преимущество метода: 1. Высокий выход ядовитых веществ (до 60-70%). Это достигается за счет использования в качестве экстрагента амфифильного растворителя – нейтрального ацетона, который извлекает вещества кислотного и основного характера как в ионизированной, так и в молекулярной формах. Высокий выход веществ позволяет уменьшить массу навески до 5 граммов, что упрощает операции и снижает расход реактивов и времени пробоподготовки. Недостатки метода: Ацетон, являясь амфифильным растворителем, извлекает из биоматериала большое количество примесей, что требует дополнительной очистки извлечения. К недостаткам метода относится и его многостадийность. |
