Вещества кислотного характера
 Скачать 0.5 Mb. Скачать 0.5 Mb.
|
|
10.Частные методы изолирования веществ (П. Валова, Грусц-Харди, В.Ф. Крамаренко): применение, преимущества, недостатки методов. Изолирование барбитуратов подщелоченной водой (метод П. Валова) Изолирование барбитуратов подщелоченной водой схематично можно представить следующим образом: • Настаивание измельчённого объекта с водой, подщелоченной 20% раствором натрия гидроксида до рН = 12 и более в течение 30 мин. • Очистка водного извлечения путём насыщения натрия вольфраматом, фильтрование раствора. • В кислой среде (серной кислотой до рН=2), экстрагирование эфиром, концентрирование эфирного извлечения упариванием. Выход составляет 50% и даже до 90%, в зависимости от вида барбитурата.  Преимущества: Метод даётдостаточно чистые извлечения, т.к. включает стадию очистки (осаждение белков натрия вольфраматом), что повышает качество последующего анализа. Недостатком метода является соосаждение барбитуратов с белками при обработке натрия вольфраматом. В последней модификации метода серная кислота заменена на натрия гидросульфат, что увеличивает выход искомых веществ. Метод Е. Грусц-Харди - изолирование смесью спирта и хлороформа Измельченный биологический материал растирают с сульфатом аммония, подкисляют раствором хлористоводородной кислоты до рН=2, экстрагируют смесью этилового спирта и хлороформа Экстракт отделяют, выпаривают, сухой остаток растворяют в горячей воде и фильтруют. Из фильтрата экстрагируют вещества кислотного характера эфиром. Частный метод изолирования алкалоидов водой, подкисленной серной кислотой (по В.Ф. Крамаренко) Схематично метод можно представить из следующих этапов: • Настаивание измельчённого объекта с водой, подкисленной 20% раствором кислоты серной до рН =2– 3, в течение двух часов. Вода берётся в количестве 1 : 2 по отношению к навеске объекта. Водное извлечение фильтруется. Операция повторяется двукратно. • Очистка водного извлечения от белковых соединений путём насыщения его аммония сульфатом, настаивания в течение часа и фильтрования образовавшегося осадка. • Очистка фильтрата от жиров, смол, пигментов путём экстракции эфиром. Эфирное извлечение отбрасывают. • Подщелачивание водного извлечения 20% раствором натрия гидроксида и экстрагирование веществ основного характера хлороформом при рН =9–10 (трёхкратная экстракция), отделение органической фазы и концентрирование полученного извлечения упариванием. 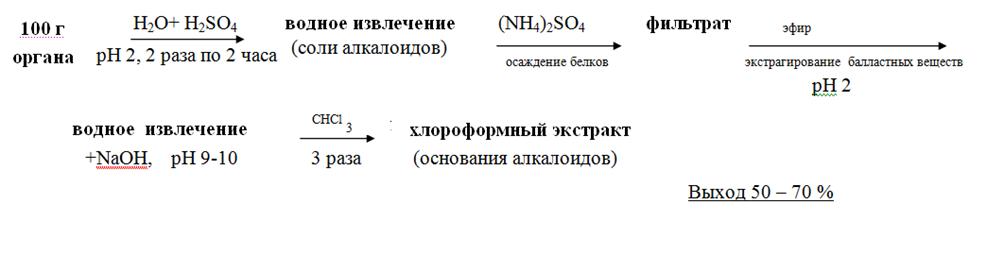 Разработанный вначале для алкалоидов, метод применим и для изолирования других азотсодержащих веществ основного характера (синтетических лекарственных средств). Метод достаточно быстрый. Преимуществом является хорошая очистка извлечений от соэкстрактивных веществ. 11. 11. Способы детектирования веществ кислого характера (ВКХ) и веществ основного характера (ВОХ) на хроматограммах (общие и частные). Идентификация исследуемых веществ на хроматограммах. Варианты ТСХ-скрининга. 12. Схема химико-токсикологического исследования по ТСХ-скринингу на наличие веществ кислотного и основного характера.
Проведение ТСХ-скрининга веществ кислотного характера Сухой остаток эфирного экстракта из кислого раствора (с предыдущего занятия) растворяют в небольшом объеме хлороформа (3 мл) и наносят в 2 зоны (А, В) на стартовую линию хроматографической пластинки «Сорбфил». На стартовую линию также наносят хлороформный раствор смеси метчиков и хроматографируют пластинку в системе хлороформ:ацетон (9:1) либо ацетон:н-гексан:диэтиламин (10:10:1). Камеру предварительно насыщают парами растворителя в течение 0,5-1 часа. После высушивания зону А пластинки обрабатывают 5% раствор ртути сульфата в 5% растворе серной кислоты до полного увлажнения слоя сорбента. Производные барбитуровой кислоты проявляются в виде пятен (полос) белого цвета на просвечивающем фоне (не проявляются этим способом этосуксимид и мепробамат). Затем после подсушивания зону А пластинки обрабатывают 0,5% раствором дифенилкарбазона в хлороформе: барбитураты проявляются в виде пятен сине-фиолетового цвета. После подсушивания пластинки зону А пластинки проявляют 10% раствором окисного железа хлорида (Ш): производные салициловой кислоты, п-аминофенола (фенацетин), пиразолона (амидопирин, антипирин) проявляются в виде синих пятен. После подсушивания пластинки зону А пластинки проявляют реактивом Драгендорфа и 0,5 н раствором серной кислоты: производные ксантина (кофеин, теобромин, теофиллин), производные 1,4-бензодиазепина (диазепам) проявляются в виде желто-коричневых пятен. В результате изучения хроматографического поведения лекарственных веществ кислого, нейтрального и слабоосновного характера в системе 1 и основного и слабоосновного характера в системе 2 исследуемые вещества были распределены на хроматографические зоны (табл. 9.3). Критерием разделения анализируемых веществ на зоны являлось различие в величинах значений Rf не более 0,05 при наличии специфического реагента для граничащих веществ. Распределение веществ кислотного характера по хроматографическим группам
Проведение ТСХ-скрининга веществ основного характера Сухой остаток растворить в небольшом объеме хлороформа (3 мл), насыщенного аммиаком (для нейтрализации хлористоводородной кислоты и переведения оснований в молекулярную форму) и нанести в 3 зоны на стартовую линию хроматографической пластинки «Сорбфил». На линию старта наносят смесь метчиков, в качестве которых используются новокаин, амидопирин, димедрол. Хроматографирование проводят, используя в качестве подвижной фазы систему растворителей ацетон:хлороформ:25% раствор аммиака (24:12:1), до продвижения фронта растворителя на 10 см (40-45 мин). Камеру предварительно насыщают парами растворителя в течение 0,5- 1 часа. После высушивания хроматографическую пластинку рассматривзют в УФ-свете (светофильтр с максимумами пропускания 254 и 360 нм), отмечают зоны флюоресценции. Зону А последовательно обрабатывают 10% раствором окисного железа (III) хлорида, 57% раствором хлорной кислоты, содержащим 3% 0,5% раствора натрия азотистокислого, реактивом Драгендорфа и 0,5 н раствором серной кислоты (рис. 9.2). Разделившиеся метчики должны образовать на хроматограмме несколько зон. Определяют, в какую зону попадает анализируемое вещество (проявляется в виде горизонтальной полосы), и в зависимости от этого относят его к одной из хроматографических групп (табл. 9.4). МЕТЧИКИ ГРУППЫ 1 2 3 4 5 6 димедрол амидопирин новокаин дикаин кодеин В Б А Рис.9.2. Хроматограмма при исследовании веществ основного характера. Таблица 9.4 Распределение веществ основного характера по хроматографическим группам
Участок силикагеля (зона В) исследуют на наличие эфедрина – проявляют частным реагентом -0,2% раствором нингидрина в н-бутаноле. После проведения всех реакций сделать вывод об обнаружении веществ основного характера в исследуемом объекте, записать все данные в рабочую тетрадь. Если ни в одной из хроматографических групп не обнаруживается окрашенных пятен, совпадающих по цвету и значению Rf с метчиками, дают заключение о необнаружении веществ основного характера. 13. ТСХ-исследование «кислого» извлечения: а) производные барбитуровой кислоты (барбитал-натрия, фенобарбитал, барбамил), б) алкалоиды - производные пурина (кофеин, теобромин). Реакции идентификации. Реакции идентификации неизвестного вещества в исследуемом экстракте необходимо проводить параллельно с растворами веществ сравнения. 1. Реакции обнаружения производных барбитуровой кислоты. 1.1. Общие реакции обнаружения барбитуратов 1.1.1. Реакция выделения кислотной формы барбитуратов На предметное стекло наслаивают несколько капель исследуемого раствора (каждая последующая капля наносится после испарения хлороформа). Сухой остаток растворяют в капле концентрированной серной кислоты. Через 3-5 минут рядом помещают каплю дистиллированной воды, осторожно соединяют обе капли. Через 30-60 минут наблюдают появление кристаллического осадка, характерного для каждого отдельного барбитурата: Предел обнаружения барбитала – 80 мкг/мл, фенобарбитала, барбамила – 20 мкг, этаминала-натрия – 50 мкг. 1.2. Частные реакции. 1.2.1. Реакция с хлорцинкйодом. К сухому остатку на предметном стекле после удаления хлороформа прибавляют каплю раствора хлорцинкйода, помещают стекло во влажную камеру и через 15-30 минут рассматривают форму кристаллов под микроскопом. При наличии барбитала наблюдаются прямоугольные пластинки темно-красного или фиолетового цвета. Предел обнаружения – 4 мкг в пробе. При наличии этаминала-натрия наблюдаются сростки из окрашенных в коричневый цвет призматических кристаллов. Предел обнаружения - 4 мкг в пробе. При наличии барбамила наблюдаются кристаллы в виде прямоугольных плактинок или сростков из них, окрашенных в темно-красный и золотистый цвет. Предел обнаружения - 7 мкг в пробе. Другие барбитураты либо не дают кристаллических осадков с этим реактивом, либо образуют кристаллы нехарактерной формы. 1.2.2. Реакция с железойодидной комплексной солью. К сухому остатку на предметном стекле добавляют каплю раствора железойодидного комплекса, помещают стекло во влажную камеру и через 15 минут рассматривают форму кристаллов под микроскопом. При наличии фенобарбитала наблюдаются призматические кристаллы и сростки из них оранжево-коричневого цвета. Предел обнаружения - 4 мкг в пробе. При наличии барбамила наблюдаются крупные призматические кристаллы и сростки из них розово-оранжевого цвета в виде бабочек. Предел обнаружения - 2 мкг в пробе. При наличии этаминала-натрия наблюдаются мелкие пластинчатые призматические кристаллы и сростки из них коричневого цвета. Предел обнаружения – 0,5 мкг в пробе. Другие барбитураты либо не дают кристаллических осадков с этим реактивом, либо образуют кристаллы нехарактерной формы. 1.2.3. Реакция с меднойодидной комплексной солью. Меднойодидная комплексная соль дает с барбамилом и этаминалом кристаллические осадки, аналогичные тем, какие образует железойодидная соль. Условия выполнения реакций такие же, как и с железойодидной комплексной солью. 1.2.4. Цветной тест. На фильтровальную бумагу в одну точку нанести 2-3 капли раствора барбитурата в органическом растворителе или кислого извлечения, подсушить, затем наслоить 1-3 капли 1% спиртового раствора кобальта нитрата Со(NO3)2, подсушить и внести бумагу в пары 25% раствора аммиака – пятно приобретает красно-фиолетовое окрашивание. 1.2.5. Мурексидная реакция. В фарфоровую чашку к сухому остатку, полученному после выпаривания части извлечения, добавить по 3 капли 3% раствора перекиси водорода и реактива, содержащего соль Мора и хлорид аммония. Содержимое чашки выпарить, сухой остаток нагреть до появления белых паров. После охлаждения добавить 3 капли 6 н. раствора аммиака. При наличии некоторых барбитуратов и тиобарбитуратов появляется розовая окраска. Мурексидную реакцию дают барбамил, барбитал, фенобарбитал, этаминал-натрий и тиопентал. Не дают этой реакции гексенал, гексобарбитал и циклобарбитал. Реакции идентификации кофеина; 1)Мурексидная реакция 5-6 капель хлороформного раствора исследуемого вещества помещают в фарфоровую чашку, и растворитель испаряет без нагревания. К сухому остатку прибавляют 0,5-1 мл насыщенного раствора бромной воды, и выпаривают на водяной бане досуха. К окрашенному в буроватый цвет остатку подносят на стеклянной палочке 1 каплю 25% раствора аммиака, Остаток в чащке при наличии кофеина приобретает пурпурно фиолетово окрашивание 2).Кофеин дает осадки с реактивом Драгендорфа,Зонненшейна,Шейблера. 3) Реакция с реактивом Несслера: При нагревании раствора с реактивом Несслера на кипящей водяной бане в течении 1-2 минуты, появляется красно бурый осадок. 4) Реакция с ртутью (II) хлоридом. На предметное стекло наливают 2-3 капли исследуемого хлороформного раствора на сухой остаток после удаления хлороформа наносят каплю 0,1 моль/л раствора хлористоводородной кислоты и каплю 5% раствора ртути(II) хлорида. Через 10-15 минут образуются крупные шелковистые, бесцветные игольчатые кристаллы. Реакции идентификации Теобромина 1)Мурексидная проба (см. кофеин) 2) Реакция с реактивом Несслера В отличие от кофеина появляется слабо коричневая окраска 3) Реакция с аммиачным раствором с кобальта (II) нитрата Данная реакция используется для отличия теобромина от кофеина. 4)Микрокристаллическая реакция с реактивом Драгендорфа. Раствор исследуемого вещества в хлороформе наносят на предметное стекло. И при комнатной температуре выпаривают досуха. К сухому остатку прибавляют каплю 10% раствора хлористоводородной кислоты и каплю реактива Драгендорфа. Через 10-15 минут проявляются темно красные игольчатые кристаллы собранные в пучки параллельно проводят реакцию с фармакопейным препаратом. Кофеин в таких же условиях дает более мелкие кристаллы. 14. ТСХ-исследование «щелочного» хлороформного извлечения: а) алкалоиды - производные изохинолина (морфин, кодеин, папаверин) и синтетический анальгетик – промедол. Реакции идентификации. Реакции обнаружения морфина. 1. Реакция с реактивом Марки. Несколько капель хлороформного раствора испаряют в фарфоровой чашке, добавляют 2 капли реактива Марки: при наличии морфина наблюдается сине-фиолетовое окрашивание. Предел обнаружения – 0,05 мкг морфина в пробе. Реакция чувствительна, но не специфична, положительный результат дают и другие вещества, имеющие в своей структуре фенольный гидроксил. В химико–токсикологическом анализе реакции с реактивом Марки придается отрицательное значение. Подтверждающие реакции на опийные алкалоиды выполняют только при положительном результате этой реакции. 2. Реакция с раствором молибдата аммония в концентрированной серной кислоте (реактив Фреде). Реакцию проводят так же, как и с реактивом Марки: при наличии морфина наблюдается фиолетовое окрашивание, переходящее в розовое. Предел обнаружения – 0,05 мкг в пробе. Реакция неспецифична, положительный результат дают другие алкалоиды опия. 3. Реакция с раствором ванадата аммония в концентрированной серной кислоте (реактив Манделина). Реакцию проводят так же, как и с реактивом Марки: при наличии морфина наблюдается фиолетовое окрашивание, переходящее в бледно-розовое. Предел обнаружения – 2,5 мкг в пробе. Реакции обнаружения морфина изучаются теоретически! Реакции обнаружения кодеина. (реакции выполняются аналогично реакциям на морфин) 1.Реакция с реактивом Марки. 2. Реакция с реактивом Фреде. 3. Реакция с реактивом Манделина. Во всех случаях наблюдается сине-зеленое окрашивание, быстро переходящее в синее. Реакции обнаружения папаверина. 1. Реакции окрашивания с цветными реактивами: • с реактивом Марки реакцию можно проводить двумя способами: 1) сухой остаток папаверина с реактивом Марки на холоду даёт розовую окраску при нагревании переходящую в фиолетово–красную или пурпурно–красную. 2) от прибавления реактива Марки к сухому остатку папаверина появляется розовая окраска. Если к раствору прибавить кристаллик калия перманганата, то окраска переходит в голубую. • с реактивом Эрдмана образуется красное окрашивание; • с реактивом Фреде образуется зелёное окрашивание; • с реактивом Манделина образуется сине–фиолетовое окрашивание. 2. Реакция с железа (Ш) хлоридом и серной кислотой Сухой остаток растворяют в 1 – 2 каплях концентрированной серной кислоты, добавляют 1 каплю 0,1% раствора железа (III) хлорида, нагревают. В присутствии папаверина появляется фиолетовая окраска. Реакции обнаружения промидола Реакции обнаружения • .Реакции с реактивами группового осаждения алкалоидов. • Реакции окрашивания с цветными реактивами. • Микрокристаллическая реакция образования ализарината промедола 15. Судебно-химическое доказательство отравления опием и героином (идентификация компонентов этих веществ, их метаболитов), интерпретация результатов количественного определения опиатов. Реакции окрашивания опийных алкалоидов с различными реактивами
Одурманивающие средства основного характера дают сравнительно низкие концентрации в крови, а отношение концентраций в печени и в крови часто выше 10. соединения кислого характера дают умеренно высокие концентрации в крови, и это отношение находится в пределах от 2 до 5. для веществ нейтрального характера наблюдаются высокие концентрации в крови и почти одинаковое содержание в других тканях. Для корректной интерпретации полученных данных такого биообъекта, как моча, необходимо также знание дозы, времени, способа и периодичности введения вещества, кинетики распределения, однако в случае наркотиков подобная информация редко доступна и не всегда полна. Однако можно отметить некоторые закономерности: 1. чем выше введенная доза, тем больше вероятность их обнаружения. Высокие дозы обычно дают более высокие концентрации в плазме и моче. 2. концентрация вещества в плазме зависит от его распределения в организме, метаболизма и выведения. Для каждого вещества его фармакокинетика индивидуальна. Концентрация наркотических веществ в моче варьирует по сравнению с плазмой и зависит от объема и рН мочи 3. каждое вещество сохраняется в организме в разное время и зависит от химического строения и частоты употребления. 4. поскольку концентрация большинства веществ в моче (за исключением этанола) не коррелирует с их концентрацией в крови и степенью наркотического воздействия, время употребления наркотического вещества по концентрации в моче не может быть установлена. 16. Химико-токсикологический анализ алкалоидов группы тропана (кокаин, атропин). Атропин (сложный эфир троповой кислоты и тропина) содержится в красавке и скополии карниолийской и в некоторых др. растениях. Экстрагируется органическими растворителями из щелочных растворов. 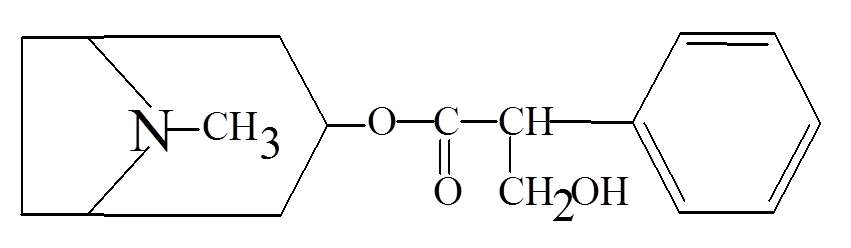 Реакции обнаружения 1. Реакции с реактивами группового осаждения алкалоидов. 1.2. Реакция переведения атропина в полинитропроизводное и доказательство последнего (реакция Витали – Морена) В фарфоровую чашку вносят несколько капель хлороформного раствора исследуемого вещества и при комнатной температуре выпаривают досуха. К сухому остатку прибавляют 1 мл концентрированной азотной кислоты, жидкость на кипящей водяной бане выпаривают досуха. При этом сухой остаток приобретает жёлтую окраску. К сухому остатку с одной стороны прибавляют 3 – 5 капель ацетона, а с другой 1 – 2 капли 10% спиртового раствора калия гидроксида. При соприкосновении указанных растворов с сухим остатком появляется быстроисчезающая фиолетовая окраска. Реакция неспецифична. Открываемый минимум 1 мкг.    тропин троповая кислота  1.3. Гидроксамовая проба К сухому остатку (после испарения хлороформа) добавляют едкий натр до рН = 11, затем добавляют гидроксиламин и доводят рН до 1, с помощью концентрированной хлороводородной кислоты, и прибавляют 2 – 3 капли раствора железа (III) хлорида. Наблюдают красное окрашивание.Реакция неспецифична. - 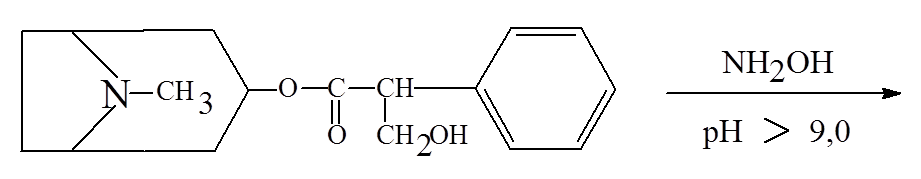 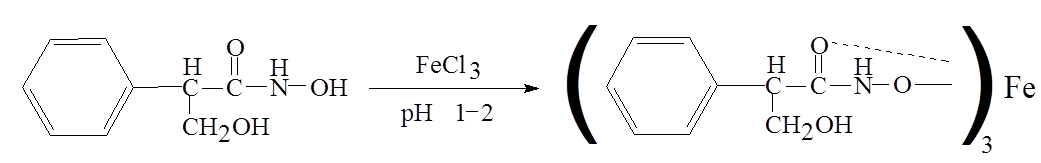 1.4. Реакция с п–диметиламинобензальдегидом и серной кислотой К 2 –3 каплям исследуемого раствора прибавляют 3 – 5 капель 0,5% раствора п–диметиламинобензальдегида в концентрированной серной кислоте. Жидкость взбалтывают, а затем нагревают на кипящей водяной бане 5 – 10 мин. При наличии атропина появляется красная окраска, переходящая в вишнёво–красную, а затем и фиолетовую. Реакция неспецифична. МИКРОКРИСТАЛЛИЧЕСКИЕ РЕАКЦИИ 1. Реакция с солью Рейнеке Открываемый минимум 0,1 мкг. Аморфный сиреневый осадок 2. Реакция с пикриновой кислотой Открываемый минимум 5 мкг. Тонкие пластинки пикрата атропина светло-желтого цвета 3. Реакция с бромной водой Открываемый минимум 0,016 мкг. Осадок из желтых и красно-бурых кристаллов ФАРМАКОЛОГИЧЕСКИЕ ИСПЫТАНИЯ При нанесении исследуемого раствора на конъюнктиву глаза кошки (мыши) наблюдают расширение зрачка. Кокаин Кокаин получают из различных видов эритроксилона. Кокаин – дважды сложный эфир спиртокислоты экгонина, метилового спирта и бензойной кислоты. Экстрагируется из щелочных растворов. 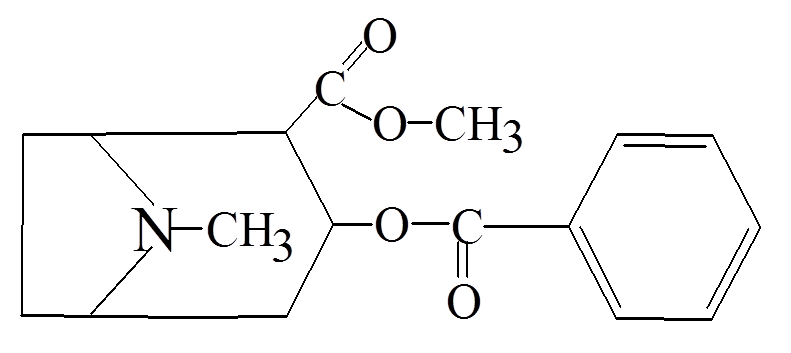 Реакции обнаружения 1. Реакции с реактивами группового осаждения алкалоидов. 2. Реакции образования бензойно–этилового эфира: К сухому остатку прибавляют 2 мл концентрированной серной кислоты и 2 мл этилового спирта. Смесь нагревают на водяной бане в течение 5 мин – ощущается характерный запах бензойно–этилового эфира, запах ощущается лучше, если к смеси прибавить 5 – 10 кратный объём холодной воды. Реакция малочувствительна, её можно применять при исследовании порошков и т.п. (см. ниже). 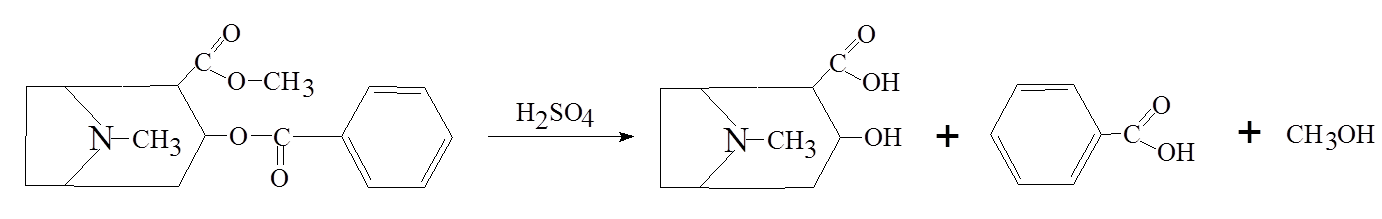 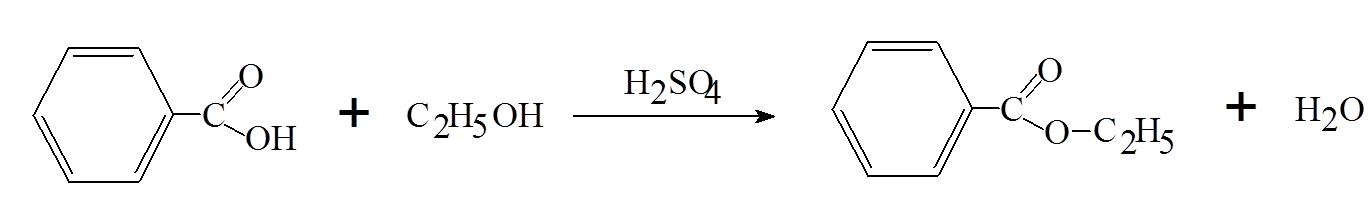 Микрокристаллические реакции 1. Реакции с калия перманганатом Открываемый минимум 4 мкг. Красно-фиолетовые кристаллы 2. Реакция образования хлорплатината кокаина. Открываемый минимум 3 мкг. Светло-желтые кристаллы Фармакологические испытания В присутствии кокаина наблюдается расширение зрачка, при нанесении на язык (если исследуется остаток порошка, пилюли, но не внутренние органы трупа и рвотные массы) появляется характерное онемение, потеря чувствительности. 17. Химико-токсикологический анализ производных пиридина и пиперидина (никотин, анабазин, пахикарпин). Никотин Алкалоид, содержащийся в некоторых видах табака. Представляет собой бесцветную маслянистую жидкость, быстро темнеющую на воздухе. Экстрагируется из щелочных растворов и путем перегонки с водяным паром. 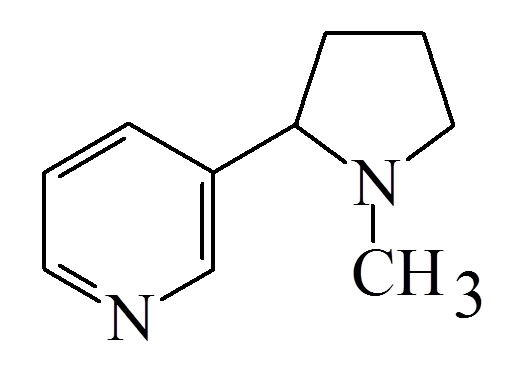 Реакции обнаружения 1. Реакции с реактивами группового осаждения алкалоидов 2. Реакция с формальдегидом На часовое стекло наносят 1 – 2 капли исследуемого раствора и 2 капли 4% водного раствора формальдегида. Смесь нагревают, затем прибавляют каплю концентрированной азотной кислоты. В присутствии никотина раствор приобретает красную или розовую окраску. 3. Реакция с п–диметиламинобензальдегидом На часовое стекло наносят каплю концентрированной хлороводородной кислоты, в которую вносят кристаллик п–диметиламинобензальдегида. Рядом с этой каплей помещают каплю исследуемого раствора, затем капли соединяют с помощью стеклянной палочки. При наличии никотина в месте соприкосновения капель наблюдается розовое окрашивание, которое переходит в фиолетовое. Окраска сохраняется около суток.    4. Реакция с реактивом Бушарда К 2 – 3 каплям исследуемого раствора прибавляют каплю реактива Бушарда, выпадает осадок красного, буроватого цвета. 5. Реакция с пергидролем В пробирку вносят 1 мл исследуемого раствора, 1 мл водорода пероксида 30% и 2 – 3 капли концентрированной серной кислоты. Появление красной или шоколадно–коричневой окраски указывает на присутствие никотина (cм. ниже).  Микрокристаллические реакции 1. Реакция с реактивом Драгендорфа (Методику выполнения см. кокаин). При наличии никотина наблюдаются сростки кристаллов в виде летящих птиц, буквы «К» или буквы «Х». Открываемый минимум 1 мкг. 2. Реакция с солью Рейнеке Открываемый минимум 1,2 мкг. Образуются сферические сростки, состоящие из призматических кристаллов 3. Реакция образования пикрата никотина Открываемый минимум 3,3 мкг. 4. Реакция с раствором йода в этиловом эфире В пробирку вносят 1 мл раствора исследуемого вещества в этиловом эфире и прибавляют 1 мл 1% раствора йода в этиловом эфире. Через несколько минут смесь мутнеет, а затем выпадает смолистый осадок, из которого выделяются игольчатые рубиново–красные кристаллы с тёмно–синим оттенком. Фармакологическое испытание При отравлении никотином лягушка принимает характерную позу (сидячее положение, расставив верхние и нижние лапки). Анабазин Это алкалоид, который содержится в ежовнике безлистном. Представляет собой бесцветную маслянистую жидкость, хорошо растворимую в воде и ряде органических растворителей. Экстрагируется также как никотин.  Реакции обнаружения 1. Реакции с реактивами группового осаждения алкалоидов 2. Реакция с реактивом Бушарда 3. Реакция с пергидролем 4. Реакция с ванилином 5. Реакция образования полиметинового красителя (Выполнение реакций 2 – 5 см. никотин) Микрокристаллические реакции 1. Реакция с реактивом Драгендорфа Открываемый минимум 1 мкг.Появление отростков, состоящих из оранжево-красных кристаллов, имеющих форму пик 2. Реакция с солью Рейнеке Открываемый минимум 0,7 мкг.сростки из мелких игольчатых кристаллов 3. Реакция с пикриновой кислотой Открываемый минимум 4 мкг.желтый кристаллический осадок Пахикарпин Реакции обнаружения пахикарпина. Реакция с раствором йода в калия йодиде. На предметное стекло наносят 2-3 капли хлороформного раствора исследуемого вещества. После испарения хлороформа остаток сразу же обрабатывают 1 каплей 0,1 н раствора хлористоводородной кислоты, добавляют 1 каплю раствора йода в растворе калия йодида. Стекло помещают во влажную камеру, через 20 минут под микроскопом наблюдают кристаллы в форме дубовых листьев золотисто-желтого (золотисто-зеленого) цвета. Предел обнаружения – 3,5 мкг в пробе. 18. Химико-токсикологический анализ эфедрина и хинина ХТА Эфедрина Реакции обнаружения 1. Реакции с реактивами группового осаждения алкалоидов 2. Реакция с солями меди и сероуглеродом В микропобирку вносят каплю раствора исследуемого вещества, подкисленного уксусной кислотой, прибавляют каплю 5% раствора меди сульфата, а затем раствор аммония гидроксида до щелочной реакции. К полученному раствору прибавляют 2 капли смеси сероуглерода и бензола (1:3) и взбалтывают. При наличии эфедрина бензольный слой приобретает коричневую или жёлтую окраску. Открываемый минимум 2 мкг 3. Реакция с 2, 4 – динитрохлорбензолом В микропобирку вносят каплю эфирного раствора исследуемого вещества, прибавляют каплю 5 моль/л раствора едкого натра и каплю 5% спиртового раствора 2, 4 – динитрохлорбензола. Жидкость нагревают на водяной бане в течение 5 мин. При наличии эфедрина в растворе появляется жёлто–коричневая окраска. Если к охлаждённому раствору прибавить 1 – 2 капли раствора хлороформа и несколько капель разведённой уксусной кислоты, а затем взболтать, то хлороформный слой приобретает жёлтую окраску. Открываемый минимум 5 мкг 4. Реакция с реактивом Либермана К сухому остатку на фарфоровой чашке после удаления растворителя добавляют 1 каплю реактива Либермана (натрия нитрит в концентрированной серной кислоте). Наблюдают появление жёлтого окрашивания. Микрокристаллические реакции 5. Реакция с реактивом Драгендорфа Сухой остаток на предметном стекле растворяют в 1 капле 0,1 моль/л раствора хлороводородной кислоты и добавляют 1 каплю реактива Драгендорфа. Через 10 – 15 мин под микроскопом наблюдают пучки из тонких игольчатых кристаллов и пластинки неправильной формы тёмно–коричневого цвета. Открываемый минимум 15,6 мкг. 6. Реакция с солью Рейнеке Сухой остаток на предметном стекле растворяют в 1 капле 0,1 моль/л раствора хлороводородной кислоты и добавляют 1 каплю свежеприготовленного 1% раствора соли Рейнеке. Быстро выделяется аморфный сиреневый осадок, кристаллизующийся при стоянии в сростки из прямоугольных пластинок. ХТА Хинина Реакции обнаружения 1. Реакции с реактивами группового осаждения алкалоидов 2. Обнаружение хинина по флуоресценции | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
