химия все. Выберите правильное утверждение (утверждения) Выберите один или несколько ответов
 Скачать 2.47 Mb. Скачать 2.47 Mb.
|
|
Сr2O72- +6 Cr0 +2jg Установите соответствие между соединениями и степенью окисления элемента: NO2 - +4; NO2(-) - +3; Cu(H2O)6(1+) - +1 Установите соответствие между соединием и степенью окисления элемента: PO4(3-) - +5; N2H2 - -1; As2S3 - +3 Установите соответствие между составом комплекса и его названием по IUPAC: 3KCl x CoCl3 - калий гексахлорокобальтиат(III); 2KOH x Zn(OH)2 - калий тетрагидроксоцинкат(II) Установите соответствие между составом комплекса и его названием по IUPAC: 3KOH x Al(OH)3 – Калий гексагидроксоалюминат (III); 4KCN x Fe(CN)2 – Калий гексацианоферрат (II) Установите соответствие между составом комплекса и его названием по IUPAC: 3KCN*Fe(CN)3 – калийгексацианоферрат 3 2KIxHgI2 калийтетройодомеркурат (II) Установите соответствие между составом комплекса и его названием по IUPAC: K2C2O4 x CaC2O4 – калий диоксалатокальцинат (II); 2NH3 x AgOH – диамминсеребро (I) гидроксид Установите соответствие между составом комплекса и его названием по IUPAC: 3KSCN x Fe(SCN)3 – калий гексацианоферрат (III); CuCl2 x 4NH3 – тетрамминмедь (II) дихлорид Установите соответствие между составом комплекса и его названием по IUPAC: PtCl2 x 2NH3 – диамминдихлорплатина (II); 3KI x BiCl3 – калий гексахлоровисмутат (III) Установите соответствие между электронной конфигурацией валентного уровня и элементом: 4s13d54p1 – атом марганца в возбужденном состоянии, атом марганца в основном состоянии, атом галия в степени окисления +2; 4s03d54p0 – атома марганца в степени окисления +2; атом марганца в основном состоянии Установите соответствие между центральным ионом комплекса и его типичным координационным числом Fe 2+6 Cu+ 2 Pb+ 4У Укажите частицы, которые находятся в растворе комплекса K3[PtCl4(NH3)2] при его вторичной диссоциации по 1 ступени: NH3, [PtCl4(NH3)]2-, [PtCl3(NH3)2]2- Укажите правильную последовательность, в соответствии с которой увеличивается концентрация Hg2+ в растворе, если известно: 1) Kн[Hg(SO3)3]4-=10^(-25); 2) Кн[HgI4]2-=10^(-30); 3) Кн[HgCitr]=10^(-10): 2<1<3 Установите соответствие между центральным ионом комплекса и его типичным координационным числом: Co3+ -- 6; Zn2+ -- 4; Pt4+ -- 6 Какое из перечисленным веществ может быть только восстановителем в водных растворах? Ca; NaF Установите соответствие между составом комплекса и его названием по IUPAC: K2C2O4*CaC2O4 калий диоксалатокальцинат II; 2NH3*AgOH диамминсеребро I гидроксид Укажите процесс (процессы) диспропорционирования: I2=I-+IO3-; NO2=NO2-+NO3-; Cl2=Cl-+ClO- Укажите частицы, которые находятся в растворе комплекса H[AuCl4] при его первичной диссоциации: [AuCl4]-; H+ Выберите самый сильный восстановитель из числа предложенных, если pH>7: K2SO3 (остаьные варианты: H2; Zn; KOH) Установите соответствие между гибридизацией комплексообразователя и названием комплекса: sp3 тетрагидроксоцинкат II; sp диамминмедь I; sp3d пентациноникелят II Укажите степень окисления комплексообразователя в соединении Ca[Cr(CN)6] +2 Установите соответствие между соединением и степенью окисления хлора:ClO- +1;NaCl -1;Cl2O7+7 Назовите комплекс[Fe(CO)5] пентакарбонилжелезо Укажите степень окисления атома кислорода в соединении BaO: -1 Выберите самый сильный окислитель при pH=0: O3 (остальные варианты H+, K2CrO4, Sn4+, KClO, KMnO4, H2O2, O2) Укажите процесс (процессы) восстановления: O3=Na2O2; H2O=O2; O2=2OH- Укажите самый сильный восстановитель при стандартных условиях: Li (остальные варианты Cr, K, Ag, Cu, Mn, Fe2+, Zn) Выберите комплекс, в котором центральный ион находится в sp-гибридном состоянии: K[Ag(CN)2] Выберите самый сильный окислитель из числа предложенных, если pH<7: KMnO4 В каком направлении протекает самопроизвольная окислительно- восстановительная реакция? KMnO4+H2O2+KOH K2MnO4+O2+H2O Вправо Определите факторы эквивалентности окислителя и восстановителя в реакции: NH4NO2=N2+H2O: окислитель 1/3; восстановитель 1/3 Укажите процесс (процессы) внутримолекулярной ОВР: I2=I-+IO3-; Cl2=Cl-+ClO-; MnO4=MnO2+O2; KClO3=KCl+O2; NO2=NO2-+NO3- Укажите дентантность лиганда в соединении (NH4)3[Fe(C2O4)3] Бидентантные Установите соответствие между соединением и степенью окисления элемента: NO3- +5; NH4+ -3; Cr(H2O)6 2+ +2 Укажите степень окисления атома бора в соединении Na2B4O7: +3 Назовите комплекс [Fe(CO)5]: Пентакарбонилжелезо Укажите степень окисления атома железа в соединении K3[Fe(CN)6]: +3 Выберите комплекс, в котором центральный ион находится в sp-гибридном состоянии: K[Ag(CN)2] Укажите частицы, которые находятся в растворе комплекса Na2[Cd(NO2)4] при его вторичной диссоциации по 3 ступени: [CdNO2]+; NO2- Укажите правильную последовательность, в соответствии с которой увеличивается концентрация комплексообразователя в растворе, если известно: Кн[Fe(CN)6]4-=10^(-21); Кн[Fe(CN)6]3-=10^(-33); Кн[Fe(SCN)6]3-=10^(-4): 2<1<3 Укажите возможный продукт восстановления HNO3: NH4NO3 Укажите частицы, которые находятся в растворе комплекса Sr[Ca(C2O4)2] при его первичной диссоциации: Sr2+; [Ca(C2O4)2]2- Установите соответствие между составом комплекса и его названием по IUPAC: 3KCl*CoCl3 Калий гексахлорокобальтиат III; 2KOH*Zn(OH)2 калий тетрагидроксоцинкат II Укажите самый слабый восстановитель при стандартных условиях: O2 (остальные варианты Cr3+; I2; Cr2+; Fe3+; Fe2+; NO; H2O2) Выберите самый слабый окислитель при pH=14: SO4 2- (остальные варианты H+; K2Cr2O7; H2O2; Sn2+; KMnO4; K2CrO4; KClO) Укажите самый сильный окислитель при стандартных условиях: SO3 2- (остальные варианты S2-; Cl-; MnO2; I2; I-; F-; Br-) Установите соответствие между составом комплекса и его названием по IUPAC: 3KSCN*Fe(SCN)3 – калий гексатиоцианоферрат (III) CuCl2*4NH3 – тетрамминмедь (II) хлорид Установите соответствие между комплексообразователем и его типичным координационным числом: Pt 2+ - 4 Fe 3+ - 6 Fe 0 – 5 В каком направлении протекает самопроизвольная окислительно-восстановительная реакция? KIO3 + KI + H2O <= ? =>I2 + KOH Вправо (=>) Определите факторы эквивалентности окислителя и восстановителя в реакции: NO2 + O2 + H2O => HNO3 Окислитель – ¼ Восстановитель – 1 Какое координационное число имеет комплексообразователь, если он находится в sp3d-гибридном состоянии? 5 Назовите комплекс K2[HgI4] Калий тетраиодмеркурат (II) Установите соответствие между гибридизацией комплексообразователя и названием комплекса: sp3d2 – гексакваникель (II) sp – дифенилкадмий (0) sp2d – диамминохлорплатина (II) Укажите самый сильный восстановитель при стандартных условиях: I2 Какое из перечисленных веществ может быть только окислителем в водных растворах? Na2CrO4 Укажите правильную последовательность, в соответствии с которой изменится концентрация лигандов в растворе, если известно: 1) Kн [HgЭДТА]2- = 10^-22 2) Kн [HgЭДТА]2- = 10^-10 3) Kн [HgЭДТА]2- = 10^-19 1<2<3 Укажите координационное число центрального атома (иона) в соединении K2[Zn(C2O4)2] 4 Укажите возможный продукт восстановления HNO3 NH4NO3 Укажите процесс(процессы) межмолекулярной ОВР H2SO4 = S + H2O NO2 + O3 = NO3- + O2 NO3- = NO + O2 Укажите процесс(процессы) кислотно-основные: 02 = 2OH- H2O = O2 H2O2 = O2 NA2O2 = BaO2 O3 = Na2O2 Укажите частицы, которые находятся в растворе комплекса K3[Fe(C2O4)3] при его вторичной диссоциации по второй ступени C2O4 2- [Fe(C2O4)2] – Укажите частицы, которые находятся в растворе комплекса Cs[CuCl3] при его первичной диссоциации [CuCl3]- Cs+ Укажите степень окисления атома кислорода в соединении Bao2: -1 Выберете самый сильный окислитель при pH=0 Sn 2+ Установите соответствие между соединением и степенью окисления кислорода Na2O -2 BaO2 -1 Fe2o +2 Сборник говна из экзаменационных тестов 2019 2017 Выберите комплекс, в котором центральный ион находится в sp3d2 – гибридном состоянии K[Al(OH)4(H2O)2] [Fe(CO)5] K[Cu(CN)2] [Ca(ЭДТА)]SO4 Выберите амфолит из числа предложенных, который при указанных условиях обладает буферным действием: Глюкоза Ацетат аммония Белок pH>7,5 Жир Какая молярная концентрация ионов К+ в плазме крови, если известно, что 0,1г катионов калия содержится в 10 л плазмы? 0,00026 моль/л 0,26 моль/л 2,6 моль/л 0,026 моль/л Какая молярная концентрация ионов Ca2+ в плазме крови, если известно, что 0,1г катионов калия содержится в 10 л плазмы? 0,00025 моль/л 0,103 моль/л 0,05 моль/л 0,0153 моль/л Укажите буферную систему, в которой буферная емкость по основанию равна буферной емкости по кислоте: 100 мл 0,1 моль/л NaH2PO4 + 100 мл 0,2 моль/л Na2HPO4 200 мл 0,2 моль/л NaH2PO4 + 100 мл 0,5 моль/л Na2HPO4 200 мл 0,2 моль/л NaH2PO4 + 100 мл 0,3 моль/л Na2HPO4 200 мл 0,2 моль/л NaH2PO4 + 200 мл 0,2 моль/л Na2HPO4 Укажите буферную систему, в которой буферная емкость по основанию больше, чем по кислоте: 100 мл 0,1 моль/л NaH2PO4 + 100 мл 0,2 моль/л Na2HPO4 200 мл 0,2 моль/л NaH2PO4 + 100 мл 0,5 моль/л Na2HPO4 200 мл 0,2 моль/л NaH2PO4 + 100 мл 0,3 моль/л Na2HPO4 200 мл 0,2 моль/л NaH2PO4 + 200 мл 0,2 моль/л Na2HPO4 Первоначальное значение pH составляет 0,5 для раствора хлороводородной кислоты HCl. Укажите значение pH после разбавления в 100 раз 5.0 0.5 2.5 0.15 Первоначальное значение pH составляет 0,5 для раствора хлороводородной кислоты HCl. Укажите значение pH после разбавления в 10 раз 5.0 0.5 1.5 0.15 Какой цвет имеет индикатор метилрот в растворе, pH которого 4,5 бесцветный жёлтый красный оранжевый Выберите комплекс, в котором центральный ион находится в sp-гибридном состоянии K[Al(C2O4)2] [Cr(H2O)5Cl]Br K[BrF4] K[Ag(CN)2] Первоначальное значение pH составляет 10,0 для раствора водного аммиака NH3. Укажите значение pH после разбавления в 100 раз 4.0 8.0 5.0 8.5 Укажите, какую реакцию среды имеет раствор, pH которого равен 9,99 Слабощелочная Слабокислая Сильнокислая Нейтральная Укажите уравнение вторичной диссоциации комплекса Na2[Sn(OH)6] по первой ступени Na2[Sn(OH)6] 2Na+ + [Sn(OH)6]2- [Sn(OH)6]2- [Sn(OH)5]- + OH- Na2[Sn(OH)6] Na+ + Na[Sn(OH)6]- [Sn(OH)1]3+ Sn4+ + OH- Укажите буферную систему, в которой кислотная буферная емкость меньше, чем основная: 200 мл 0,2 моль/л CH3COOH + 50 мл 0.4 моль/л CH3COONa 100 мл 0,2 моль/л CH3COOH + 50 мл 0.5 моль/л CH3COONa 100 мл 0,1 моль/л CH3COOH + 50 мл 0.3 моль/л CH3COONa 50 мл 0,1 моль/л CH3COOH + 50 мл 0.2 моль/л CH3COONa Выберите самый сильный восстановитель из числа предложенных, если pH>7 Cl2 Br2 F2 I2 Какие из предложенных систем обладают буферными свойствами? 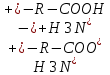 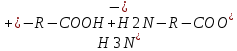 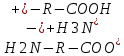 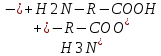 Укажите концентрацию разбавленного раствор, если к 100 мл 0,5 моль/л раствора добавили 100 мл воды: 0,5 моль/л 0,25 моль/л 0,0025 моль/л 0,00025 моль/л Выберите комплекс, в котором центральный ион находится в sp2d-гибридном состоянии Ca[CdI4] В каком реагенте находится минимальное количество молей эквивалентов, если количество вещества всех реагентов 1 моль? HCl H3PO4 H2SO4 H4SiO4 Укажите наиболее сильное основание, используя значение pKb: Пиридин pKb=9,5 Гуанидин pKb=0,6 Пиримидин pKb=13,4 Цинка гидроксид pKb=6,3 Укажите компонент физиологической жидкости (крови), который обладает свойствами буфера: холестерин соли калия белки плазмы соли натрия Первоначальное значение pH составляет 10,0 для раствора водного аммиака NH3. Укажите значение pH после разбавления в 10 раз 4.0 9.0 5.0 8.5 Укажите вещество, в водном растворе которого pH>7 NaI NaF Na2SO4 NaCl Вычислите pH гидрокарбонатной буферной системы (pKa=6,35), если соотношение акцептор Н+ : донор Н+ равно 1:10 Какая из предложенных систем обладает буферными свойствами? NH4Cl+HCl NH4OH+NH4NO3 NH4OH+NaOH NH4OH+NH4NO2 Укажите, как изменяется степень окисления кислорода в живых организмах в процессе аэробного дыхания: До -3 До -2 До +2 До 0 Укажите вещество, водный раствор которого имеет значение pH<7 CaCl2 ZnCl2 NaOH KI Укажите буферную систему, в которой буферная емкость по кислоте равна буферной емкости по основанию: 200 мл 0,2 моль/л CH3COOH + 50 мл 0.4 моль/л CH3COONa 100 мл 0,2 моль/л CH3COOH + 50 мл 0.4 моль/л CH3COONa 100 мл 0,1 моль/л CH3COOH + 50 мл 0.3 моль/л CH3COONa 50 мл 0,1 моль/л CH3COOH + 50 мл 0.2 моль/л CH3COONa Укажите вещество, водный раствор которого именнт значение pH<7 CaCl2 BaCl2 NaOH HI Укажите полное уравнение вторичной диссоциации комплекса Na[Al(H2O)4(OH)2] Na[Al(H2O)4(OH)2] ↔ Na+ + [Al(H2O)4(OH)2]- [Al(H2O)4(OH)2]- ↔2H2O + 2OH- + [Al(H2O)2]3+ [Al(H2O)4(OH)2]- ↔ 4H2O + 2OH- + Al3+ Na[Al(H2O)4(OH)2] Na+ + [Al(H2O)4(OH)2]- Первоначальное значение pH составляет 13,0 для водного раствора NaOH. Укажите значение pH после разбавления в 100 раз. 11.0 5.0 14.0 11.5 Выберите комплекс, в котором центральный ион находится в sp3d2 – гибридном состоянии: K[Al(OH)4(H2O)2] Первоначальное значение pH составляет 3,0 для раствора хлороводородной кислоты HCl. Укажите значение pH после разбавления в 100 раз 5.0 0,15 4,0 0,5 Первоначальное значение pH составляет 13,0 для водного раствора NaOH. Укажите значение pH после разбавления в 10 раз. 8,5 12,0 5,0 14,0 Укажите компонент физиологической жидкости (крови), который обладает свойствами буфера Соли натрия Соли калия Вода плазмы Гемоглобин в эритроцитах Какой цвет имеет индикатор фенолфталеин в растворе, pH которого 8,5? Бесцветный Малиновый Розовый Красный Первоначальное значение pH составляет 3,0 для раствора хлороводородной кислоты HCl. Укажите значение pH после разбавления в 10 раз 5.0 0,15 4,0 0,5 Укажите донор иона водорода H+ в живом организме из числа предложенных: Белок 2< pH < 5 Белок pH=14 Белок 10 Какие из предложенных систем обладают буферными свойствами? HNO2+KNO2 HCL+KCl HNO3+KNO3 K2CO3+H2CO3 Укажите акцептор иона водорода Н+ в живом организме из числа предложенных KH2PO4 анион гемоглобина HHbO2 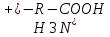 Действие НАД+ как природного окислителя объясняется: Присутствием амидной группы Отщеплением от субстрата гидрид-иона Н- Отщеплением от субстрата протона Н+ П-недостаточностью гетероциклического кольца Укажите наиболее сильное основание, используя значение Kb: Диметиламин Kb=10 в -4 Анилин Kb=10 в -10 Гидразин Kb=10 в -6 Аммиак Kb=10 в -5 Вычислите pH буферной системы NH4OH+NH4Cl (значение 14-pKb=9.25), если соотношение акцептор Н+ : донор Н+ равно 1:1 3,75 8,75 10,75 9,25 Укажите акцептор иона водорода Н+ в живом организме из числа предложенных: Пептид 2 Пептид 8 < pH < 10 Какую массу глюкозы (C6H12O6) необходимо взвесить на весах для того, чтобы приготовить 50 мл физиологического раствора (W%=5,0%, плотность 1 г/мл) - 2,5 г 5. Укажите молекулярную концентрацию эквивалентов раствора NaOH, если молярная концентрация 0,5 моль/л: - 0,5 моль экв./ л 6. Укажите металл, который входит в состав живых существ: - медь, железо, сера, кальций, натрий, калий, магний 7. Укажите вещество, представляющее угрозу для благополучия человека: - Ацетон, соли висмута, цианид калия, формальдегид, окись серы, нитрозамин, фенол, соли кадмия 8. Выберите самый сильный окислитель из числа предложенных, если pH <7: - KMnO4 , H2O2 9. Укажите степень окисления атома железа в соединении K3[Fe(CN)6] - +3 11. Укажите комплексообразователь в соединении K3[Fe(CNS)6] - Fe 14. Назовите комплекс [PtCl2(NH3)2] -диамминдихлороплатина (II) 15. Укажите соль, которая гидролизуется по аниону HCOOLi, KIO, CH3COONa, KCN, NaNO2 16. Какой катион является окислителем для металлического Zn? -Au 3+ 17. Выберите реакцию, в которой при увеличении общего давления НЕ происходит сдвига химического равновесия: - H2 + S=H2S 19. Укажите роль азота в живых организмах: - Акцептор протонов 20. Укажите возможный продукт восстановления KMnO4 при pH=0: -MnSO4 22. Какой металл является восстановителем для солей Ni? -Fe 23. Укажите фактор, абсолютно необходимый для того, чтобы система достигла состояния равновесия: -Закрытая система, изолированная система, отсутствие обмена веществ 24. Выберите реакцию в которой при нагривании происходит сдвиг равновесия влево: -2SO2 + O2 =2SO3 ∆H < 0 25. Выберите амфолит из числа предложенных, который при указанных условиях обладает буферным действием - Белок 3< ph 26. Какое из перечисленных веществ может быть как окислителем, так и восстановителем в водных растворах? – Fe(NO3)2 , Cl2 27. Выберите комплекс, в котором центральный ион находится в sp3 d- гибридном состоянии - [Fe(CO)5] 28. Вычислите ph буферной системы NH4OH + NH4Cl (значение 14- pKb= 9.25) , если соотношение акцептор H+ : донор Н+ равно 1:1 -9,25 29. Раствор какого вещества надо добавить к водному раствору HCOOK, чтобы получить буферную систему - HCOOH 30. Какую массу NaCl необходимо взвесить на весах для того, чтоб приготовить 50 мл физиологического раствора (W= 0.9%, плотность 1 г/мл) - 0, 45 г 31. Укажите молярную концентрацию эквивалентов раствора NH4OH, если молярная концентрация 0,25 моль/л -0,25 моль/экв Какой pH может иметь раствор, если метилоранж в этом растворе окрашен в оранжевый цвет, а метилрот - в красный? -3.6 37. Укажите, какую реакцию среды имеет раствор, pH которого равен 13,99 -сильнощелочная 38. Назовите комплекс K3[Al(OH)4(H2O)2] - Калий диакватетрагидроксоалюминат (III) 39. Какой металл является восстановителем для солей Na? -Ca 40. Укажите причину, по которой состояние живого организма не является равновесным -выделение продуктов жизнедеятельности в окружающую среду Поглощение питательных веществ из окружающей среды 41. Укажите донор иона водорода H+ в живом организме из числа предложенных -H2CO3 Белок2 Какие из предложенных систем обладают 44. свойствами? -HNO2 +KNO2, H3PO4 + KH2PO4 , K2HPO4 + KH2PO4 45. Какой массой Ca(OH)2 можно заменить 0.2 г. NaOH, необходимого для нейтрализации любой кислоты? -0,185 г 46. Укажите химический элемент, который является токсичным для живых существ -Кадмий , свинец , талий, висмут, радий , ртуть, мышьяк 47. Какое из перечисленных веществ может быть только окислителем в водных растворах -Na2CrO4 48. Укажите координационное число центрального атома (иона) в соединении K2[Ca(ЭДТА)] -4 49. Укажите донтатность лигандов в соединении (NH4)3[Fe(C2O4)3] -Бидентатные 50. Первоначальное значение pH составляет 13,0 для раствора водного NaOH. Укажите значение pH после разбавления в 10 раз. -12.0 Какой метал является восстановителем для солей Al: К 73. Укажите условия, соотвествующие состоянию истинного равновесия: t=25˚C, 298 по Кельвину 74. Выберите реакцию, в которой при нагревании происходит сдвиг равновесия влево: 2SO2+O2=2SO3 ΔH<0 Укажите фактор, который влияет на величину константы равновессия в жидкофазной реакции: ΔG (изменение энергии Гиббса в реакции) 79. Назовите комплекс [Ca(C2N2H4)2](NO3)2: Бисэтилендиамминкальций (II) нитрат Выберите амфолит из числа предложенных, который при указанных условиях обладает буферным действием: Белок pH>7.5 82. Укажите дентатность лигандов в соединении (NH4)3[Fe(NH3)6]: монодентатные 83. Укажите выражение для константы равновесия для реакции H2(газ)+J2 (газ)= 2HI (газ): K=[[𝐻𝐼] 2 / [H2][I2] 84. Назовите комплекс [Cu(H2O)2(NH3)4]Cl2: тетрамминдиаквамедь(II) хлорид 85 В каком направлении протекает самопроизвольная окислительно-восстановительная реакция ? KMnO4 + H2O2 + KOH ? K2MnO4 + O2 + H2O Вправо () 90 Укажите фактор , который влияет на величину константы равновесия в жидкофазной реакции: ^G(изменение энергии Гиббса в реакции ) 96. Какой цвет имеет индикатор фенолфталеин в растворе, pH которого 8,5 ? Розовый 97 Выберите реакцию , в которой при нагревании происходит сдвиг равновесия 2SO2+O2=2SO3 ^H<0 Укажите степень окисления комплексообразователя в соединении [Co(CO)4] Ответ: 0, +1 Укажите степень окисления комплексообразователя в соединении Ca[Cr(CN)6] Ответ: +2 112. Укажите вещество, в водном растворе которого pH>7 Ответ: NaF, NaNO2 Укажите вещество, в водном растворе которого рН больше 7: NaNO2 113. Назовите комплекс K3[Fe(SCN)6]? Ответ: Калий гексатиоцианоферрат (III) 114. Укажите соль, которая гидролизуется по катиону? Ответ: CuSO4, AlCl3, BeCl2, NH4Cl b. ZnSO4 115. Какой металл вытеснит Cu из ее солей? Ответ: Fe 116. Укажите условия соответствующие состоянию истинного равновесия? Ответ: S=max, ˄G=0 Выберите процесс, в котором одновременное охлождение и повышение общего давления приводят к увеличению выхода продуктов? Ответ: 2SO2(газ) + O2(газ) = 2SO3(газ) H<0 Укажите какой элемент меняет степень окисления в живых организмах в процессе анаэробного дыхания? Ответ: Углерод Укажите наиболее сильное основание используя значение Kb? Ответ Диметиламин Kb= 10^-4 Назовите комплекс K[Co(CN)4(H2O2)] Ответ: Калий диакватетрацианокобальтат Выберите процесс, в котором сдвиг равновесия влево происходит как при нагревании, так и при увеличении общего давления? Ответ: 2NOCl(газ)= 2NO(газ) + Cl2(газ) ΔH<0 Выберите самый сильный восстановитель из числа предложенных, если pH>7? Ответ: K2SO3, I2 146. Выберите кислотную буферную систему из числа предложенных? Ответ: H2SO4 + KHSO4 147. Назовите комплекс K2[HgI4] Ответ: Калий тетраиодамерткурат (II) 148. Укажите возможный продукт восстановления HNO3- Ответ: NH4NO3 149. Назовите комплекс [Ni(CO)4] Ответ: Тетракарбонилникель Выберите реакцию, в которой при нагревании увеличивается концентрация продуктов? Ответ: NH4Cl = NH3 + HCl H>0, N 2 + 2O 2 = 2NO 2 ΔH>0 Укажите причину, по которой состояние живого организма не является равновесным? Ответ: Обмен веществ с окружающей средой 154. Укажите соль, которая гидролизуется как по катиону, так и по аниону? Ответ: Al2(SO3)3, Cu(NO2)2 b. NH4ClO , Be(ClO2)2 Укажите роль кислорода в живых организмах? Ответ: Окислитель Как называется состояние живого организма: Ответ: Стационарное 161. Какой катион является окислителем для металлической Cu? Ответ: Ag+ 162. Укажите какую реакцию среды имеет раствор, pH которого равен 7? Ответ: Нейтральная Укажите степень окисления атома кислорода в соединении BaO2? Ответ: -1 Первоначальное значение pH составляет 0.5 для раствора хлороводородной кислоты HCl. Укажите значение pH после образования в 10 раз? Ответ: 1.5 169. Укажите полное уравнение вторичной диссоциации комплекса [Al(H2O)6]2(SO4)3 ? Ответ: [Al(H2O)6]3+ ↔ Al3+ + 6H2O Укажите буферную систему, в которой кислотная буферная емкость меньше, чем основная? Ответ: 200 мл 0,2 моль\л CH3COOH + 50 мл 0,4 моль\л CH3COONa 173. Какой катион является окислителем для металлической Hg? Ответ: Au3+ 174 Первоначальное значение pH составляет 3,0 для раствора хлороводородной кислоты HCl. Укажите значение pH после разбавления в 10 раз? Ответ: 4,0 Выберите полярные адсорбенты из перечисленных: Выбирите полярный адсорбент Ответ: силикагель, алюмогель, целлюлоза, цеолиты 179. Укажите ионы, которые способны селективно адсорбироваться на минеральном компоненте кости Са5(РО4)3ОН: Ответ: Ca2+, Sr2+, PO4 3-, OH180. Каких ионов в пище следует избегать, если у пациента происходит накопление нерастворимых кальциевых солей в почках? Ответ: C2O4 2-, PO4 3-, Ca2+ Выберите ионы, которые будут селективно адсорбироваться из речной воды на поверхности известняка CaCO3: Ответ: CO3 2-, Ca 2+, Mg 2+ 182. Какой заряд положительный, как у катионов, или отрицательный, как у анионов, будет накапливаться на поверхности зубной эмали (CaF2) при использовании фторированной зубной пасты (содержащей NaF)? Ответ: отрицательный 183. Ионы каких веществ, находящихся в растворе, могут селективно адсорбироваться на осадке PbS? Ответ: Pb(CH3COO)2, H2S 184. Ионы каких веществ, находящихся в растворе, могут селективно адсорбироваться на осадке AgI? Ответ: AgF, KI, NaBr 185. Какие ионы (какой ион), находящиеся в растворе, могут селективно адсорбироваться на осадке, который получается при указанных условиях: CaCl2(избыток) + K3PO4 = Ca3(PO4)2 + KCl Ответ: Ca2+ Какие ионы (какой ион), находящиeся в растворе, могут селективно адсорбироваться на осадке, который получается при указанных: Mg(NO3)2 + NaOH(избыток) = Mg(OН)2 + NaNO3 Ответ: OH187. Укажите в какой последовательности уменьшается адсорбция ионов раствора на силикагеле: Ответ: Ba 2+ > Sr 2+ > Ca 2+ > Mg 2+ 188. Укажите, в какой последовательности уменьшается адсорбция ионов из раствора на алюмогеле: Ответ: I- > Br- > Cl- > F189. Выберите неполярные адсорбенты из перечисленных: Выберите неполярный адсорбент из перечисленных: Ответ: фторопласт, аморфный углерод, тефлон 190. Укажите, в какой последовательности уменьшается адсорбция ионов из раствора на адсорбенте цеолите: Ответ: H+ > Al3+ > Mg2+ > Na+ 191. Какие факторы (какой фактор) существенно влияют на физическую адсорбцию паров веществ на твердом адсорбенте: Ответ: Tкипения 192. Пары какого вещества будут больше всех адсорбированы на активированном угле? Ответ: SO3 (Tкипения = +450С) 193. От паров какого вещества хуже всего защищает противогаз, содержащий в качестве адсорбента активированный уголь? Ответ: CO (Tкипения = -1910С) 194. Выберите поверхностно активное вещество (вещества) из числа предложенных: Ответ: C17H35COOLi, (CH3)3N-C17H35 Br 195. Выберите вещество (вещества), которое обладает свойствами ПАВ в водном растворе из числа предложенных: Ответ: мыло, фосфолипид, белок 196. Выберите вещество (вещества), которые существенно понижают поверхностное натяжение водного раствора: Ответ: C17H35COOK, Cl (CH3)3NC15H31 197. Какая частица (частицы) будет значительно адсорбироваться на поверхности угля из водного раствора? Ответ: C17H35SO3- 198. Какими свойствами должен обладать адсорбент, чтобы эффективно удалить примеси органических веществ при подготовке питьевой воды? Ответ: водонерастворимый, гидрофобный, пористый, неполярный 199. Выберите наиболее эффективный адсорбент для очистки питьевой воды от ионов тяжелых металлов: Ответ: катионит 200. Выберите гидрофильные адсорбенты из перечисленных: Ответ: пористый SiO2, обезвоженный Al(OH)3, прокаленный CaCO3 Выберите гидрофильный адсорбент из перечисленных: d. Пористый SiO2 201. Какой адсорбент (адсорбенты) можно использовать для удаления следов воды из органического растворителя – бензола? Ответ: прогретый мел, силикагель 202. Выберите наиболее эффективный адсорбент для очистки питьевой воды от остаточного хлора Cl2: Ответ: пористый углерод 203. Выберите гидрофобные адсорбенты из перечисленных: Выберите гидрофобный адсорбент из перечисленных : Ответ: вспененный фторопласт, графит 204. Укажите единицы, в которых измеряется адсорбция на твердых адсорбентах: Ответ: моль/м^2, моль/г 205. Укажите единицы, в которых измеряется адсорбция: Ответ: моль/л 206. Физическая сорбция в отличие от хемосорбции: Ответ: обратима, экзотермична, универсальна 207. Для хемосорбции, в отличие от физической сорбции, характерно: Ответ: наличие оптимальной температуры процесса, соответствие химическим закономерностям 208. Укажите факторы, от которых зависит удельная адсорбция ионов из морской воды на силикагеле: Ответ: заряд иона, концентрация иона, дегидратация иона В каком направлении протекает самопроизвольная окислительно-восстановительная реакция? KMnO4 + HF ← ? → F2 + MnF2 + KF + H2O Правильный ответ: Влево (←) Укажите, как изменяется степень окисления углерода в живых организмах в процессе аэробного дыхания: Правильный ответ: До +4 Укажите координационное число центрального атома (иона) в соединении K2[Zn(C2O4)2] Ответ: 4 353. Укажите возможный продукт (продукты) восстановления хлора при pH=0 Ответ: HCl 354. Укажите вещество, водный раствор которого имеет значение pH<7 Укажите вещество, в водном растворе которого рН<7 ZnCl2, CuSO4, NH4NO2, BeCl2 Какая из предложенных систем обладает буферными свойствами в живом организме? HHb + HbУкажите объект, который следует назвать суспензией: Выберите один ответ: a. Твердые частицы размером 10-6 и крупнее в газе b. Твердые частицы размером 10-6 и крупнее в другом твердом теле c. Твердые частицы размером 10-6 и крупнее в жидкости d. Порошкообразная смесь твердых частиц размером 10-6 и крупнее 200 При нагревании эндотермической реакции Ответ: константа равновесия увеличивается Какая молярная концентрация ионов Na+ в плазме крови, если известно, что 0,1 г катионов натрия содержится в 10 л плазмы? 0.00043 моль\л Укажите, как изменяется степень окисления кислорода в живых организмах в процессе аэробного дыхания Ответ: до -2 Укажите, какой элемент меняет степень окисления в живых организмах в процессе аэробного дыхания: углерод Чему равен рН раствора HCl с концентрацией 0.01 моль/л (ν=1) ? 2 Чему равен рН раствора уксусной кислоты с концентрацией 0.1 моль/л (степень диссоциации 0.001) ? 4 Чему равен рН раствора амиака в воде с концентрацией 0.1 моль/л (константа диссоциации 2·10-5 ) ? 11.2 Чему равен рН раствора азотистой кислоты в воде с концентрацией 0.04 моль/л (константа диссоциации 4·10-4 ) ? 2.4 Чему равна концентрация гидроксид - ионов ОН- в растворе водного аммиака с концентрацией 1 моль/л (константа диссоциации 2·10-5 ) ? 0. 0.0044 моль/л Выберите амфолиты из числа предложенных, которые при указанных условиях обладают буферным действием: Гемоглобин + оксигемоглобин, Белок pH = pI, Белок 3 Выберите вещество (вещества), которое может быть окислено натрий нитритом (NaNO2) в кислой среде: Na2S, NaI Выберите вещество (вещества), которое может быть восстановлено сероводородом (H2S) в кислой среде CuSO4, KMnO4, K2Cr2O7 Какое количество HСl можно добавить к буферному раствору, приготовленному из 100 мл 0.5 моль/л CH3COOH + 200 мл 0.3 моль/л CH3COONa так, чтобы рН практически не изменился? 0,05 моль, 0,05 моль Укажите степень окисления атома углерода в соединении (NH4)2C2O4: +3 Укажите окислительно-восстановительные реакции: C6H5NO2 + H2 = C6H5NH2 + H2O, Na2O2 + CO2 = Na2CO3 + O2 Какие процессы являются полуреакциями восстановления? AsO43- → AsO2 - , P → PH3 Какие из перечисленных веществ могут быть только восстановителями в водных растворах? Na2S, H2 Какие из перечисленных веществ могут быть как окислителями, так и восстановителями в Ф Выберите металл (металлы), который будет катодом по отношению к стандартному водородному электроду: Cu (+0.34V) Выберите электрод (электроды), который будет анодом по отношению к стандартному в Вычислите потенциал водородного электрода, если рН раствора 7 (t=250C) -0.42 V Вычислите ЭДС гальванической цепи Zn | ZnSO4 || CuSO4 | Cu при стандартных условиях +1.10 V Какие типы электродов используются в рН-метре? Электроды сравнения, Электроды ион-селективные Укажите формулу хлор-серебряного электрода сравнения: Ag | AgCl, KCl (насыщенный) Выберите правильное утверждение (утверждения): В гальванической цепи электрический ток образуется за счет окислительно-восстановительной реакции, В гальванической цепи потенциал катода больше потенциала анода Насколько изменится потенциал медного электрода, если раствор CuSO4 разбавить в 10 раз по сравнению с раствором при стандартных условиях (1 моль/л)? -0.03 V Укажите степень окисления комплексообразователя в соединении K[HgCl2I2] Ответ: +2 Какое координационное число имеет комплексообразователь, если он находится в sp3dгибридном состоянии? 5 Укажите биологические объекты, которые относятся к гидрофильным коллоидным растворам: Система седиментационно устойчива, рассеивает свет, имеет малое осмотическое давление, неполностью проходит через полупроницаемые мембраны Укажите объекты, которые следует назвать аэрозолями: Твердые частицы размером 10-5 м в газе, Жидкие частицы размером 10-4 м в газе Какая молярная концентрация ионов Mg2+ в плазме крови, если известно, что 0,1 г катионов магния содержится в 10 л плазмы: 0,00042 моль/л Укажите условия, необходимые для получения и существования гидрофобных коллоидных растворов: Диспергирование частиц твердой фазы до размера 10-7 м и меньше, Присутствие электролита – стабилизатора, Смешивание исходных растворов с концентрацией 0,001 моль/л с большим избытком одного из реагентов Укажите бинарную систему, которая может существовать в виде гидрофильного к Дана формула мицеллы гидрофобного коллоида Укажите дисперсную фазу: CaCO3 Д Выберите возможный электролит – стабилизатор, который был использован для получения этого коллойда: CaCl2 Д Выберите возможный электролит – коагулянт, который был бы наиболее эффективным: K3PO4 Коллоидный раствор Ag2CrO4 получен реакцией между AgNO3(избыток) и K2CrO4. Какой заряд имеет гранула (1) и диффузионный слой (2) соответственно? Положительный (1), отрицательный (2) Укажите противоионы диффузионного слоя: CH3COO- Выберите правильное утверждение (утверждения): Коагуляция – это потеря устойчивости и выпадение осадка, Коагуляция – это следствие нейтрализации заряда гранул коллоида Выберите правильное утверждение (утверждения): Равновесие – это состояние обратимой системы, в котором не происходит никаких изменений втечение бесконечно большого времени., Равновесие – это состояние обратимой системы, в котором скорость прямой реакции равна скорости обратной. Укажите факторы, которые определяют величину константы равновесия в газофазной реакции: Температура, Давление реагента Укажите область значений для константы диссоциации слабого электролита: 0 При нагревании экзотермической реакции: Константа равновесия уменьшается, Происходит сдвиг равновесия влево Выберите реакцию (реакции), в которой при увеличении общего давления происходит увеличение концентрации продуктов: C + 2H2 = CH4, 2CO + O2 = 2CO2 Каким способом можно увеличить величину константы равновесия реакции Какими способами можно увеличить величину константы равновесия реакции O3(газ) + NO(газ) = O2(газ) + NO2(газ) ΔH>0 Нагревание Назовите комплекс K3[Fe(CN)6] __ Калий гексацианоферрат (III) Назовите комплекс Na2[CaЭДТФ]_Натрий этилендиамминтетраацетаткальцинат (II) Назовите комплекс Na[Ag(CN)2]: Натрий дицианосеребро (I) Выберите процесс, в котором одновременное охлаждение и повышение общего давления приводят к увеличению выхода продуктов: d. 2SO2(газ) + O2(газ) = 2SO3(газ) ∆H<0 Какой металл является восстановителем для солей Zn?_ Na Какая ЭДС образуется, если составить источник электричества из литиевого и алюминиевого электродов?_1,38 В Выберите реакцию, в которой при нагревании увеличивает увеличивается концентрация продуктов: NH4Cl↔ NH3 + HCl ∆H>0 Укажите электрокинетическое явление, если коллоидный раствор продавливаетс через капиллярную систему: Потенциал течения Одним из окисляющих агентов в природных системах является…….. . НАД+ Укажите выражение для константы равновесия, соответствующей реакции СаСО3 (тв)=СаО(тв)+СО2(газ): К=[CO2] 1. Укажите условия, при которых возможно существование гидрофильных коллоидных растворов: рН < pI или pH > pI , Возможно разбавление до концентраций 10-3 моль/л и меньше, Возможно концентрирование до пастообразного состояния, Подбор подходящей дисперсионной среды 2. Укажите систему, которая при определенных условиях может существовать в виде гидрофобного коллоида: Fe + H2O Fe(OH)3 + H2O 3. Дана формула мицеллы гидрофобного коллоида {[mCaCO3 ·nCa2+] ·(2n-x) Cl- } + ·xClУкажите дисперсную фазу: CaCO3 4. Дана формула мицеллы гидрофобного коллоида {[mCaCO3 ·nCa2+] ·(2n-x) Cl- } + ·xClВыберите возможный электролит – стабилизатор, который был использован для получения этого коллойда: CaCl2 5. Дана формула мицеллы гидрофобного коллоида {[mCaCO3 ·nCa2+] ·(2n-x) Cl- } + ·xClВыберите возможный электролит – коагулянт, который был бы наиболее эффективным: K3PO4 6. Коллоидный раствор AgI получен реакцией между AgNO3 и KI(избыток). Какой заряд имеет гранула? Положительный (1) , Отрицательный (2) 7. Коллоидный раствор Ag2CrO4 получен реакцией между AgNO3(избыток) и K2CrO4. Какой заряд имеет гранула (1) и диффузионный слой (2) соответственно? Положительный (1), отрицательный (2) 8. Коллоидный раствор Fe(OH)3 получен реакцией гидролиза FeCl3 в кипящей воде. Какой заряд имеет гранула (1) и диффузионный слой (2) соответственно? Положительный (1), отрицательный (2) 9. Дана формула мицеллы гидрофобного коллойда {[mFe4[Fe(CN)6]3 ·nFe3+] ·(3n-x) Cl- }+ ·xCl- Укажите потенциалопределяющие ионы: Fe3+ 10.Укажите биологические объекты, которые относятся к гидрофобным коллоидным растворам: Система термодинамически неустойчива, рассеивает свет, имеет малое осмотическое давление, неполностью проходит через полупроницаемые мембраны 11.Коллоидный раствор Fe(OH)3 получен реакцией гидролиза FeCl3 в кипящей воде, заряд гранулы положителен. Укажите потенциалопределяющие ионы: FeO+ 12.Коллоидный раствор получен с использованием следующей реакции: AgNO3 + KI (избыток) = AgI + KNO3 Выберите правильную формулу мицеллы {[mAgI ·nI- ] (n-x)K+} - xK+ 13.Коллоидный раствор получен с использованием следующей реакции AgNO3 (избыток) + KI= AgI + KNO3 Выберите правильную формулу мицеллы {[mAgI ·nAg+ ] (n-x)NO3 -} + xNO3 - 14.Коллоидный раствор получен с использованием следующей реакции: 100 мл 0.2% AgNO3 + 1 мл 0,2% K2CrO4 Укажите дисперсионную среду H2O 15.Коллоидный раствор получен с использованием следующей реакции: 100 мл 0.2% Al(NO3)3 + 1 мл 0,2% KOH Укажите дисперсионную среду H2O 16.Дана формула мицеллы гидрофобного коллоида {[mPbCO3 ·nPb2+] ·(2n-x) CH3COO- } + ·xCH3COO - Укажите противоионы диффузионного слоя: CH3COO17.Коллоидный раствор получен с использованием реакции: 100 мл 0,5% Ba(NO3)2 + 1 мл 0,5% (NH4)2SO4 Укажите противоионы диффузионного слоя: NO3 - 18.Укажите, от каких ионов можно очистить методом диализа коллоидный раствор, полученный при смешивании 100 мл 0,1% AlCl3 и 1 мл 0,1% K3PO4 Cl- Al3+ K+ 19.Какими способами можно ускорить процесс диализа? Обновление омывающей жидкости Наложение постоянного электрического поля Перемешивание коллоида 20.Что такое пептизация? Переведение осадка в коллоидное состояние 21.Укажите объекты, которые находятся в коллоидном состоянии: Твердые частицы размером 10-8 м в жидкости 22.Укажите электрокинетическое явление (явления), если заряженные частицы проходят через мембрану под воздействием постоянного электрического поля: Электрофорез 23.Укажите электрокинетическое явление (явления), если коллоидные частицы оседают при центрифугировании: Потенциал седиментации 24.Укажите электрокинетическое явление (явления), если коллоидный раствор продавливается через капиллярную систему: Потенциал течения 25.Укажите электрокинетическое явление (явления), если коллоидные частицы не могут проходить сквозь мембрану при наложении постоянного электрического поля: Электроосмос 26.Укажите электрокинетическое явление (явления), если аэрозольные частицы движутся и оседают на холодной поверхности объекта: Термофорез 27.Выберите правильное утверждение (утверждения): Коагуляция – это потеря устойчивости и выпадение осадка Коагуляция – это следствие нейтрализации заряда гранул коллоида 28.Золь золота в водной системе изменил окраску с красной на синюю (лиловую). Какими причинами это могло быть вызвано? Ассоциация коллоидных частиц Ультразвук Добавление коагулянта Концентрирование 29.При смешивании сточных вод происходит коагуляция коллоидных частиц. Выберите возможные причины этого: Сжатие диффузионного слоя частиц Агрегация противоположно заряженных частиц Нейтрализация заряда на дисперсной фазе 30.При добавлении коагулянта произошла мгновенная коагуляция золя Fe(OH)3, полученного методом гидролиза. Укажите формулу мицеллы в изоэлектрическом состоянии: {[mFe(OH)3 ·nFeO+] ·nCl-} 31.Укажите возможные нерастворимые соединения (соединение), которые появляются при коагуляции золя AgI, стабилизированного солями серебра, при прибавлении коагулянта Na2S: Ag2S AgI 33.При каких условиях (из предложенных) мыло в воде образует коллоидный раствор? Сильнощелочной раствор, очень мягкая вода, холодная вода, Концентрация больше ККМ, горячая вода 34.Укажите условия, необходимые для получения и существования гидрофобных коллоидных растворов: Диспергирование частиц твердой фазы до размера 10-7 м и меньше Присутствие электролита – стабилизатора Смешивание исходных растворов с концентрацией 0,001 моль/л с большим избытком одного из реагентов .Укажите объекты, которые следует назвать суспензиями: Твердые частицы размером 10-6 и крупнее в жидкости 38.Укажите объекты, которые следует назвать эмульсиями: Жидкие частицы размером 10-6 и крупнее в жидкости 39.Гидрофильные коллоидные растворы, в отличие от гидрофобных: Электрофорез может отсутствовать Самопроизвольно получаются при смешивании веществ Устойчивы и не требуют стабилизатор 40.У гидрофобных коллоидных растворов, в отличие от гидрофильных: Коагуляция зависит от заряда иона – коагулянта Изоэлектрическое состояние означает быструю коагуляцию Заряд на грануле зависит от метода приготовления 5. Какая масса иона НСО3- содержится в 10 мл крови в тканях, если известно, что концентрация этого иона 25 ммоль/л? 15,25 мг Какие растворы имеют одинаковую молярную концентрацию? 2,5г CuSO4×5H2O в 100 мл раствора, 1,6г CuSO4 в 100 мл раствора 8. В растворах каких веществ молярная концентрация эквивалентов будет одинаковой, если молярность этих растворов равна 0,1 моль/л? CuSO4, H2SO4 9. Укажите растворы, которые содержат одинаковую массу растворенного вещества, если для их приготовления растворили 1 моль вещества в 1000 мл воды. H3PO4, H2SO4 10. В расторе какого вещества молярная концентрация эквивалентов имеет наибольшее значение, если массовая доля одинакова и равна 10%, плотность 1 г/мл? H3PO4 В каком направлении протекает самопроизвольная окислительно-восстановительная реакция? KMnO4 + HF ← → F2 + MnF2 + KF + H2O Влево (←) ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ, АДСОРБИЯ, АБСОРБЦИЯ 1. Выберите полярные адсорбенты из перечисленных: Силикагель Целлюлоза Алюмогель 2. Физическая сорбция в отличие от хемосорбции: Обратима Экзотермична Универсальна 3. Укажите факторы, от которых зависит удельная адсорбция ионов из морской воды на силикагеле: Концентрация иона Заряд иона Дегидратация иона 4. Каких ионов в пище следует избегать, если у пациента происходит накопление нерастворимых кальциевых солей в почках? 5. Какие ионы (какой ион), находящиeся в растворе, могут селективно адсорбироваться на осадке, который получается при указанных условиях: CaCl2(избыток) + K3PO4 = ↓Ca3(PO4)2 + KCl Ca2+ 6. Укажите, в какой последовательности уменьшается адсорбция ионов из раствора на алюмогелe: 7. Пары какого вещества будут больше всех адсорбированы на активированном угле? SO3 (Tкипения = +45С) 9. Какими свойствами должен обладать адсорбент, чтобы эффективно удалить примеси органических веществ при подготовке питьевой воды? Неполярный Гидрофобный Пористый Водонерастворимый 10. Какой адсорбент (адсорбенты) можно использовать для удаления следов воды из органического растворителя – бензола? Прогретый мел Силикагель 1. Выберите правильное утверждение (утверждения): Равновесие – это состояние обратимой системы, в котором не происходит никаких изменений в течение бесконечно большого времени Равновесие – это состояние обратимой системы, в котором скорость прямой реакции равна скорости обратной. 2. Укажите условия, соответствующие состоянию истинного равновесия: G = min, S = max t = 250C 3. Укажите выражение для константы равновесия для реакции H2(газ) + I2(газ) = 2HI(газ) 4. Укажите факторы, которые определяют величину константы равновесия в газофазной реакции: Температура Давление реагента 5. Укажите область значений для константы диссоциации слабого электролита: 0 6. При нагревании экзотермической реакции: Константа равновесия уменьшается Происходит сдвиг равновесия влево 7 8. Выберите реакцию (реакции), в которой при увеличении общего давления происходит увеличение концентрации продуктов: C + 2H2 = CH4, 2CO + O2 = 2CO2 9. Выберите процесс (процессы), в котором сдвиг равновесия влево происходит как при нагревании, так и при увеличении общего давления: 2NOCl(газ) = 2NO(газ) + Cl2(газ) ΔH<0 10. Какими способами можно увеличить величину константы равновесия реакции O3(газ) + NO(газ) = O2(газ) + NO2(газ) ΔH>0 Нагревание Какой цвет имеет индикатор фенолфталеин в растворе, рН которого 8.5 ? Розовый 17. Укажите соль, которая гидролизуется по аниону NaNO2 NaF 18. Укажите соль, которая гидролизуется как по катиону, так и по аниону Al2(SO3)3 19. Выберите гидрофобный адсорбент из перечисленных: Графит 20. Укажите фактор, абсолютно необходимый для того, чтобы система достигла состояния равновесия: Отсутствие обмена веществ? 69. Выберите ион, который будет селективно адсорбироваться из речной воды на поверхности известняка CaCO3 Cа 70. Коллоидный раствор AgI получен реакцией между AgNO3 и KI(избыток). Какой заряд имеет гранула(1) и диффузный слой (2) Отрицательный (1), положительный (2) 71. Укажите гидрофильный адсорбент из перечисленных Пористый SiO2 |
