ФИЗХИМ ЭКЗАМЕН. Виды медицинских лабораторий. Организация работы
 Скачать 0.68 Mb. Скачать 0.68 Mb.
|
|
Правила хранения и применения различных химических реактивов. Химреактивы размещают согласно определенным схемам. Сухие неорганические и органические химреактивы хранят в разных шкафах. Кислоты хранят отдельно от других химических реактивов в нижней части вытяжного шкафа. Вещества ядовитые, огнеопасные и токсичные хранят в сейфе. Химреактивы, самовозгорающиеся при контакте с водой, следует хранить в шкафу под замком. На каждой таре с химическим реактивом должна быть наклеена этикетка с полным названием и химической формулой препарата, кроме того, на склянке с огнеопасными веществами должно быть указано: «Огнеопасно» на этикетке. Хранение химических веществ без этикеток не разрешается. ПРАВИЛА ПРИМЕНЕНИЯ Существуют установленные требования к использованию химических реактивов. Чтобы исключить вероятность несчастных случаев в лаборатории, необходимо следовать рекомендациям и соблюдать технику безопасности. В контейнере с химическими веществами должны размещаться колбы с этикетками, на которых продемонстрирована такая информация: название; химическая формула; масса; квалификация; дата производства и срок годности; номер партии вещества. При работе с опасными, ядовитыми соединениями необходимо надевать нитриловые перчатки. Нужно также внимательно следить за расположением колб с реактивами на столе при совершении исследовательской деятельности. Необходимо остерегаться попадания грязи и других частиц в реактивы. Также не рекомендуется помещать оставшиеся соединения обратно в колбу для хранения. После проведения анализов или химических опытов необходимо провести утилизационные меры. Неиспользованные элементы помещаются в специальную тару. Она разрабатывается предприятиями, которые занимаются утилизацией токсичных веществ. Даже зная все нюансы взаимодействия соединений, не стоит выливать или высыпать реагенты в мусорные контейнеры. Виды лабораторных весов и техника взвешивания. Аналитические весы. Это оборудование отвечает 1-2 классу точности и определяет массу объектов с точностью до 5 знака после запятой, а погрешность таких приборов не превышает 0,0002 гр. Лабораторные весы класса 3,4. Эти приборы определяют массу с точностью до третьего знака после запятой. Современные электронные лабораторные весы – очень точные и практичные приборы, они не требуют использования дополнительных громоздких механических гирь и других деталей. Устройство лабораторных весов сложное в техническом плане, одновременно приборы простые в использовании. Они оборудованы электрическими датчиками, передающими информацию о массе взвешиваемых объектов или веществ на информативный дисплей. Технические весы, соответствующие среднему классу точности. Они позволяют взвешивать образцы с точностью до 1/10 гр. ПРАВИЛА ПОЛЬЗОВАНИЯ АНАЛИТИЧЕСКИМИ ВЕСАМИ 1. Нагрузка на чашках весов не должна превышать наибольшей для данного типа весов. Взвешивают только сидя против весов, опираясь руками на крышку стола. Взвешиваемый предмет берут пинцетом, щипцами или чистой бумагой и помещают на середину левой чашки. Химические вещества взвешивают в стеклянной посуде (бюкс, ампула). Нельзя помещать химические вещества непосредственно на чашку весов или производить взвешивание на листочке бумаги. 2. Взвешиваемый предмет должен иметь ту же температуру, что и весы. Поэтому перед взвешиванием следует вещество выдерживать в эксикаторе вблизи весов в течение 20-30 мин. Если при взвешивании над весами включают лампу, то сделать это надо за 10-15 мин до начала работы. 3. Прибавлять или убавлять взвешиваемое вещество следует только вне шкафа весов. Если взвешиваемое вещество просыпано на чашку весов или на дно шкафчика, надо немедленно вымести его кисточкой. 4. Гири следует помещать на правую чашку весов таким образом, чтобы они находились в центре чашки. Брать гири следует пинцетом с костяными (пластмассовыми) наконечниками. 5. Когда взвешиваемое вещество или гирьки кладут на чашку весов или, снимают с них, весы должны быть арретированы. 6. Перед каждым взвешиванием следует проверять, а если нужно, то и устанавливать их нулевую точку. Во время наблюдения за отклонением стрелки весов дверцы шкафа должны быть закрыты. 7. При уравновешивании взвешиваемого предмета начинают с больших разновесок и затем переходят к более мелким. Следует всегда пользоваться наименьшим числом разновесок, например, брать разновеску в 2 г, а не две разновески по 1 г. На чашке весов разновески должны лежать в определенном порядке; мелкие разновески не следует класть друг на друга. Большие разновески надо помещать в центре чашки, чтобы она не качалась. К 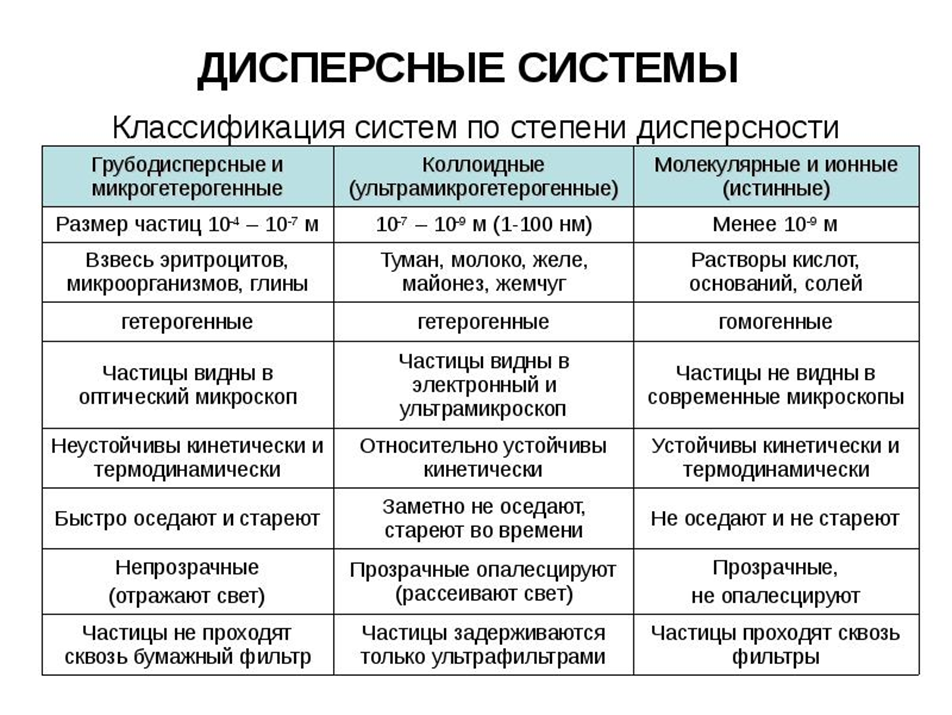 лассификация растворов по степени дисперсности. лассификация растворов по степени дисперсности.Приготовление растворов различной концентрации. Техника приготовления для растворителя необходима дистиллированная вода ёмкости предварительно подготавливают если водный раствор может взаимодействовать с материалом посуды, то её изнутри покрывают парафином или другими химически стойкими веществами по возможности готовят 2 одинаковых сосуда (1 – для растворения, 2 – для хранения) для растворения следует применять чистые вещества готовые растворы обязательно проверяют на содержание нужного вещества работа проводится в вытяжном шкафу во время приготовления и хранения растворов посуда должна быть закрыта пробками при особо точных анализах следует принимать во внимание возможность выщелачивания стекла и применять кварцевую посуду Приготовление растворов солей. На технохимических весах отвешивают необходимое количество соли. Аккуратно переносят навеску в колбу или стакан, где будут готовить раствор. Отмеривают нужное количество воды мерным цилиндром и выливают в колбу с навеской соли примерно 1/2 отмеренного количества. Энергичным помешиванием добиваются полного растворения взятой навески, иногда необходимо нагревание. После растворения взятой навески добавляют остальное количество воды. Если раствор мутный, его надо отфильтровать. Приготовление растворов щелочей. Кусочки щелочи брать пинцетом или в резиновых перчатках. Гранулированную щелочь насыпают фарфоровой ложкой. Отвешивают щелочь в стеклянной или фарфоровой посуде, отвешивать на бумаге нельзя! Щелочь растворяют только в тонкостенных бутылях, так как при растворении происходит сильное разогревание. Отвешенное на технохимических весах количество щелочи помещают в большую фарфоровую чашку или стакан. В эту посуду наливают такое количество воды, чтобы раствор имел концентрацию 35-40%. Перемешивают раствор стеклянной палочкой, пока вся щелочь не растворится. Затем раствор оставляют стоять до остывания и выпадения осадка. Оставшуюся щелочь сливают в другой сосуд, куда доливают нужное количество воды. Раствор щелочи не всегда удается приготовить заданной концентрации, поэтому, приготовив раствор, следует определить при помощи ареометра его плотность и по таблице найти процентное содержание щелочи. Приготовление растворов кислот. В лаборатории обычно применяют соляную, серную, уксусную и азотную кислоты. Так как концентрация растворов кислот не равна 100% из-за содержания воды, то расчеты для приготовления кислот другие – иные чем при приготовлении растворов солей и щелочей. Правила приготовления растворов кислот: Раствор готовят в колбах из термически устойчивого стекла. При разбавлении нельзя наливать воду в кислоту! В колбу наливают рассчитанное количество воды, а затем тонкой струёй, постепенно, при перемешивании добавляют нужное количество кислоты. После остывания раствора его переливают в бутыль и наклеивают этикетку, сделанную особой краской прямо на бутылях. Если концентрированная кислота, из которой будут готовить разбавленный раствор, хранится долгое время, то необходимо уточнить её концентрацию. Для этого измеряют её плотность и по таблице находят точное содержание кислоты в растворе. Приготовление растворов аналитической концентрации. При приготовлении точных растворов вычисление количеств нужных веществ проводят с точностью до 0,001 г. Атомные массы элементов берут по таблице, в которой приведены их точные значения. Необходимые количества вещества взвешивают только на аналитических весах. Как правило, при приготовлении точных растворов и переведении растворяемого вещества в мерную колбу растворитель (например, вода) должен занимать не более половины емкости колбы. Закрыв пробкой мерную колбу, встряхивают ее до полного растворения твердого вещества. После этого полученный раствор дополняют водой до метки и тщательно перемешивают. Для быстрого приготовления точных растворов различных веществ (кислот, щелочей и солей) удобно применять фиксаналы – заранее приготовленные и запаянные в стеклянных ампулах точно отвешенные количества реактива в количестве 0,1 или 0,01 г/экв. Использование фиксаналов Тёплой водой смывают надпись на ампуле и хорошо обтирают её. В мерную колбу ёмкостью 1 л вставляют специальную (или обычную коническую) воронку с вложенным в неё стеклянным бойком, острый конец которого должен быть обращён вверх. Ампуле с фиксаналом дают свободно падать так, чтобы тонкое дно ампулы разбилось при ударе об острый конец бойка. Пробивают боковое углубление ампулы и дают содержимому вытечь, затем, не изменяя положения ампулы, её тщательно промывают дистиллированной водой из промывалки (в 6 раз больше V3 ампулы). Ампулу удаляют, а раствор доводят дистиллированной водой до метки, закрывают колбу пробкой и встряхивают. P.S. При приготовлении растворов из сухих фиксаналов важно чтобы воронка была также сухой. Когда ампула будет разбита, её содержимое осторожно вытряхивают в колбу, ампулу промывают дистиллированной водой. Основы качественного анализа. Методы качественного анализа. Характеристика и условия проведения аналитических реакций. Реактивы для аналитических реакций, Систематический и дробный ход анализа. Цель качественного анализа – обнаружение компонентов анализируемого образца, а также идентификация тех или иных соединений. Задачи качественного анализа: 1) обнаружение всех ХЭ, входящих в состав вещества [элементный анализ], 2) идентификация молекул в образце [молекулярный анализ], 3) определение простых и сложных веществ в составе смеси [вещественный анализ], 4) идентификация отдельных фаз гетерогенных смесей [фазовый анализ]. Методы качественного анализа делятся на химические, физико-химические и физические. Физические методы основаны на изучении физических свойств анализируемого вещества. К этим методам относят спектральный, рентгеноструктурный, масс-спектрометрический анализы и др. В физико-химических методах течение реакции фиксируется измерением определенного физического свойства исследуемого раствора. К этим методам относятся полярография, хроматография и др. К химическим методам относятся методы, основанные на использовании химических свойств исследуемых веществ. Аналитическими называют химические реакции, результат которых несёт определённую аналитическую информацию. Основные требования к аналитическим реакциям: Реакция должна сопровождаться заметным внешним видоизменением (газ, осадок, окраска и т.д.); Должны существовать условия, при которых аналитическая реакция является достоверной: pH, давление, С аналита и реактива, отсутствие мешающих веществ. Чувствительность – возможность получения достоверного аналитического сигнала при низком содержании аналита. Критерии: а) обнаруживаемый минимум; б) предельное разведение (V3 раствора) Селективность – тем выше, чем меньше число различных компонентов, дающих сходный результат. Специфика – высокоселективная реакция, позволяющая обнаружить конкретный компонент в присутствии многих других. Аналитическая реакция должна протекать достаточно быстро, необратимо и быть достаточно простой по выполнению. РЕАКТИВЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ВЫПОЛНЕНИЯ АНАЛИТИЧЕСКИХ РЕАКЦИЙ: Специфические реактивы образуют характерный осадок или окрашивание только с определенным ионом. Например, реактив К3[Fе(СN)6] образует темно-синий осадок только с ионами Fe2+. Групповые реактивы вступают в реакцию со всеми ионами данной группы. С помощью этого реактива ионы данной группы можно отделить от ионов других групп. Например, групповым реактивом второй аналитической группы катионов является соляная кислота, которая с катионами Pb2+, Ag+, Hg2+ образует белые трудно растворимые осадки. Избирательные, или селективные реактивы реагируют с двумя-тремя ионами, принадлежащими к одной или к разным группам. К числу требований, предъявляемых к реактивам, относится чистота. В химическом анализе используют реактивы «чистые» (ч), «чистые для анализа» (ч.д.а.), «химически чистые» (х.ч.). Для аналитических целей, как правило, достаточна чистота марки (ч.д.а.). Как правило, содержание примесей в реактивах существенно ниже их предела обнаружения для обычных качественных химических реакций. Для оценки чистоты реактива проводят «холостой» опыт без анализируемого вещества, но в присутствии всех прочих компонентов. При работе с достаточно чистыми реактивами в холостом опыте не должно наблюдаться никаких изменений. Обнаружение элементов при совместном присутствии можно проводить ДРОБНЫМ И СИСТЕМАТИЧЕСКИМ МЕТОДАМИ АНАЛИЗА. СИСТЕМАТИЧЕСКИМ называется метод качественного анализа, основанный на разделении смеси ионов с помощью групповых реагентов на группы и подгруппы и последующем обнаружении ионов в пределах этих подгрупп с помощью селективных реакций. Название систематических методов определяется применяемыми групповыми реагентами. Известны систематические методы анализа: • сероводородный, • кислотно-основный, • аммиачно-фосфатный. Каждый систематический метод анализа имеет свою групповую аналитическую классификацию. Недостатком всех систематических методов анализа является необходимость проведения большого числа операций, длительность, громоздкость, значительные потери обнаруживаемых ионов и т.д. ДРОБНЫМ называется метод качественного анализа, предполагающий обнаружение каждого иона в присутствии других с использованием специфических реакций либо проведение реакций в условиях, исключающих влияние других ионов. Обычно обнаружение ионов дробным методом проводят по следующей схеме – вначале устраняют влияние мешающих ионов, затем обнаруживают искомый ион с помощью селективной реакции. Оборудование и посуда, применяемые при качественном анализе. Способы выполнения качественных реакций. Помимо общего оборудования, имеющегося в лаборатории качественного анализа, на каждом рабочем месте должны быть: газовая горелка, металлический штатив, штатив для пробирок, асбестированная сетка, держатель для пробирок, ерши для мытья посуды. Кроме того, на рабочем месте должен находиться штатив с набором реактивов, маленькая коническая колба или химический стакан, стеклянная воронка, капиллярные пипетки со штативом, часовое стекло, фарфоровая пластинка, фарфоровая чашка или тигель, промывалка, стеклянная палочка, воронка для ускоренного микрофильтрования и т. п. При работе с большими количествами осадков их отфильтровывают от раствора через бумажный фильтр, вложенный в стеклянную воронку. Размеры фильтра определяют по величине осадка, а не по объему фильтруемой жидкости. Чаще всего в лаборатории качественного анализа применяют цилиндрические или конические пробирки. Нагревать растворы в цилиндрических пробирках можно на голом огне. Конические пробирки нагревать на голом огне нельзя; их применяют при полумикрохимическом методе анализа и нагревают на маленькой водяной бане. При работе с малыми количествами вещества лучше отделять осадки на центрифуге, а раствор над осадком удалять специальными пипетками. Чистые пицетки хранят в стеклянных штативах. Для проведения цветных капельных реакций пользуются специальными фарфоровыми пластинками с углублениями. Для перемешивания и сливания растворов на фильтр пользуются стеклянными палочками с оплавленными концами. Применяемая посуда должна быть чистой. Для этого ее моют водой, кислотами, щелочами или хромовой смесью. Однако следует помнить, что само стекло выщелачивается водой, сильно разрушается щелочами, а также подвержено действию других химически активных веществ. СПОСОБЫ ВЫПОЛНЕНИЯ АНАЛИТИЧЕСКИХ РЕАКЦИЙ В КАЧЕСТВЕННОМ АНАЛИЗЕ Сухой способ – взаимодействие с образцом сухих реактивов без добавления воды: пробы на окрашенное пламя, растирание вещества с сухим реактивом, получение цветных стекол. Мокрый способ – аналитическая реакция проводится в растворе при исследовании в лабораторных условиях. Деление ионов на аналитические группы. Качественный анализ неорганических объектов сводится к обнаружению катионов и анионов, присутствующих в данном растворе Для катионов практическое значение имеют две классификации: сероводородная и кислотно-основная. В основе сероводородной классификации и сульфидного (или сероводородного) метода систематического анализа лежит взаимодействие катионов с сульфидом аммония или сероводородом. Серьёзный недостаток данного метода – использование ядовитого сероводорода, следовательно, необходимость использования специального оборудования. Поэтому в учебных лабораториях предпочтительнее использование кислотно-основного метода систематического анализа. В основе этого метода лежит взаимодействие катионов с групповыми реактивами. По кислотно-основной классификации катионы делят на шесть аналитических групп. катионы калия, натрия, аммония [K+, Na+, NH4+], которые не осаждаются ни кислотами, ни щелочами. Эта группа не имеет общего реактива. катионы серебра, свинца и ртути [Ag+, Pb2+, Hg22+]. Групповым реактивом является раствор соляной кислоты, который осаждает их в виде малорастворимых хлоридов (AgCl, PbCl2, Hg2Cl2). катионы бария, стронция и кальция [Ва2+, Sr2+, Са2+]. Их групповым реактивом является раствор серной кислоты, который осаждает эти катионы в виде малорастворимых сульфатов (BaSO4, SrSO4, CaSO4). катионы алюминия, хрома, цинка и олова [Al3+, Cr3+, Zn2+, Sn2+, Sn4+]. Групповым реактивом является раствор щёлочи. При действии избытка NaOH образуются растворимые в воде соединения: тетрагидроксаты натрия. катионы магния, марганца, железа (II и III), висмута [Mg2+, Mn2+, Fe2+, Fe3+, Bi3+]. Их групповыми реактивами являются водные растворы аммиака или щелочи, которые осаждают их в виде гидроксидов, не растворимых в избытке реактива (гидроксидная группа). катионы меди, кадмия, никеля, кобальта, ртути (П) [Cu2+, Cd2+, Ni2+, Co2+, Hg2+]. Групповым реактивом является раствор аммиака, в избытке которого образуются растворимые в воде комплексные аммиакаты (аммиакатная группа). Общепринятой классификации анионов не существует. Наиболее часто применяема классификация, по которой все анионы делятся на три аналитические группы в зависимости от растворимости их бариевых и серебряных солей. В данном случае групповыми реагентами являются растворимые соли бария и серебра.
|
