ФИЗХИМ ЭКЗАМЕН. Виды медицинских лабораторий. Организация работы
 Скачать 0.68 Mb. Скачать 0.68 Mb.
|
|
Общая характеристика и качественные реакции на катионы 1 аналитической группы. Анализ смеси катионов 1 аналитической группы. К первой аналитической группе относятся катионы щелочных металлов: калия K+, натрия Na+, лития Li+ и катион аммония NH4+. Большинство солей катионов первой аналитической группы представляют собой белые кристаллические вещества, хорошо растворимые в воде. Вследствие этого катионы данной группы не имеют группового реагента, и открывают их только с помощью частных реакций. Перед проведением частных реакций на катионы первой группы ионы других групп удаляют методом осаждения (например, в виде карбонатов в нейтральной или щелочной среде). РЕАКЦИИ КАТИОНА ЛИТИЯ Окрашивание пламени. Летучие соединения лития окрашивают бесцветное пламя горелки в карминово-красный цвет. Реакция весьма чувствительна. Определению мешают ионы натрия. Желтую окраску ионов Na+ маскируют, используя индиговую призму или кобальтовое стекло, не пропускающее желтых лучей. Реакция с фторидом аммония NH4F. При нагревании смеси растворов соли лития и фторида аммония выделяется белый аморфный осадок фторида лития, растворимый в уксусной кислоте. Определению мешают ионы Mg2+, которые можно замаскировать, проводя реакцию в присутствии аммиака при рН 9-10. РЕАКЦИИ КАТИОНА АММОНИЯ Реакция с щелочами. При нагревании растворов солей аммония со щелочами образуется гидрат аммиака, который разлагается с выделением аммиака, имеющего характерный запах нашатырного спирта. Выделение аммиака можно зафиксировать с помощью лакмусовой или универсальной индикаторной бумаги, смоченной водой и внесенной в пары. При выделении аммиака лакмусовая бумага синеет. NH4+ + OH- ↔ NH3*Н2О ↔ NH3↑ + H2O. Реакция с реактивом Несслера (смесь тетраиодомеркурата (II) калия с гидроксидом калия) взаимодействует с ионом NH4+, образуя красно-бурый осадок иодида меркураммония, растворимый в кислотах и щелочах. Реакцию удобнее всего проводить на предметном стекле. 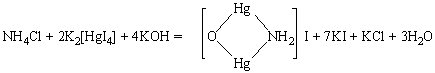 РЕАКЦИИ КАТИОНА НАТРИЯ Окрашивание пламени. Летучие соединения натрия окрашивают пламя горелки в желтый цвет. Нихромовую проволоку почистить наждачной бумагой, подержать в концентрированной соляной кислоте и прокалить в пламени горелки. При этом не должно получаться ярко-желтого окрашивания. Подготовленную проволоку опустить в раствор соли натрия (хлорида или нитрата) и снова прокалить в пламени горелки. Яркое желтое окрашивание пламени в течение нескольких секунд говорит о наличии натрия. Реакция с цинкуранилацетатом. Образуется мелкокристаллический осадок цинкуранилацетата натрия лимонно-желтого цвета, имеющий характерное строение. Осадок растворим в щелочах и кислотах. Методика проведения реакции: на предметное стекло наносят каплю раствора, содержащего ионы натрия, и высушивают на плитке. Охлаждают стекло и на место высохшей капли помещают каплю раствора цинкуранилацетата. Форму образовавшихся жёлто-зелёных кристаллов наблюдают в микроскоп. Проведению реакции мешают ионы лития. Na+ + ZnH(UO2)3(CH3COO)9 = NaZn(UO2)3(CH3COO)9 + Н+ РЕАКЦИИ КАТИОНА КАЛИЯ Окрашивание пламени. Соли калия окрашивают пламя горелки в фиолетовой цвет. Прокаливают платиновую проволоку в пламени горелки, смачивают ее раствором соли калия и вносят в пламя. Соединения калия окрашивают бесцветное пламя горелки в фиолетовой цвет. Реакция с гидротартратом натрия. Образуется белый мелкокристаллический осадок гидротартрата калия, растворимый в кислотах и щелочах. Кристаллы осадка имеют характерную форму. Методика проведения реакции. На предметное стекло наносят капилляром 1-2 капли анализируемого раствора, рядом наносят 1-2 капли гидротартрата натрия. Капли соединяют стеклянной палочкой и перемешивают. Стекло охлаждают, и через несколько минут наблюдают в микроскоп форму образовавшихся кристаллов. Определению мешают ионы аммония. K+ + HC4H4O6 - = KHC4H4O6(тв). АНАЛИЗ СМЕСИ КАТИОНОВ Обнаружение иона NH+4. В отдельных порциях исследуемого раствора определяют ионы аммония с помощью реактива Несслера/раствора щелочи. Если в исследуемом растворе присутствуют ионы аммония NH+4, то их необходимо удалить прокаливанием, так как они мешают определению ионов калия и натрия. В сухой остаток (ионы лития, натрия и калия) добавляют несколько капель HClконц. , который выпаривают и затем фильтруют и получают раствор лития и осадок с катионами натрия и калия. К раствору лития добавляют гидрофосфат натрия и получают белый осадок фосфата лития. К осадку с катионами натрия и калия добавляют воду и в растворе проводят дробную реакцию и цинкуранилацетатом и гидротартратом натрия определяя по цвету кристаллов катионы натрия и калия соответственно. Общая характеристика и качественные реакции на катионы 3 аналитической группы. Анализ смеси катионов 3 аналитической группы. К третьей аналитической группе относят катионы бария, стронция и кальция. Они не имеют цвета, и их гидроксиды являются сильными электролитами. Их групповым реактивом является разбавленная серная кислота H2SO4, которая осаждает эти катионы в виде белых кристаллических малорастворимых в кислотах и щелочах сульфатов (BaSO4, SrSO4, CaSO4). РЕАКЦИИ КАТИОНА БАРИЯ Реакция с хроматом калия. Образуется желтый кристаллический осадок хромата бария, растворимый в азотной и соляной кислотах. Реакцию ведут в присутствии уксусной кислоты, которая растворяет хромат стронция SrCrO4 и препятствует его осаждению вместе с хроматом бария. Реакция с гипсовой водой [CaSO4]. Образуется белый осадок сульфата бария. РЕАКЦИИ КАТИОНА КАЛЬЦИЯ Реакция с оксалатом аммония (NH4)2C2O4. Оксалат аммония образует с ионами кальция кристаллический осадок оксалата кальция CaC2O4. Осадок растворяется в сильных кислотах, но нерастворим в уксусной кислоте (в отличие от оксалатов стронция и бария). Растворимость осадка проверяют в уксусной, а затем в соляной кислотах. Реакция с гексацианоферратом (II) калия K4[Fe(CN)6]. В слабощелочной среде (рН≈9) образуется белый кристаллический осадок смешанной кальций-аммонийной соли, растворимой в минеральных кислотах, но нерастворимой в уксусной кислоте. Реакцию проводят в присутствии аммиачной буферной смеси. Ионы Sr2+ этим реактивом не осаждаются. Ионы Ba2+ должны быть предварительно удалены. РЕАКЦИИ КАТИОНА СТРОНЦИЯ Реакция с родизонатом натрия Na2C6O6. При проведении этой реакции на фильтровальной бумаге образуется красно-бурое окрашивание осадка родизоната стронция, исчезающее в присутствии соляной кислоты. Если в растворе присутствуют ионы бария, то реакцию проводят, предварительно добавляя хромат-ионы. Методика проведения: На фильтровальную бумагу наносят каплю раствора хромата калия, затем каплю исследуемого раствора, содержащего ионы стронция. Выдерживают бумагу в течение 2-3 минут и добавляют каплю раствора родизоната натрия. В присутствии ионов стронция бумага окрашивается в буро-красный цвет, при их отсутствии остается желтой. АНАЛИЗ СМЕСИ КАТИОНОВ К исследуемому раствору добавляют хромат калия в присутствии уксусной кислоты и осаждаются катионы бария. В растворе, содержащим катионы кальция и стронция, добавляют гипсовую воду, осаждая катионы стронция в виде белого осадка сульфата стронция. Для выделения катионов кальция в присутствии аммиачного буфера добавляют гексацианоферрат (II) калия в результате чего выпадает белый осадок кристаллический осадок смешанной кальций-аммонийной соли, нерастворимой в уксусной кислоте. Общая характеристика и качественные реакции на катионы 5 аналитической группы. Анализ смеси катионов V аналитической группы. К пятой (гидроксидной группе) аналитической группе относятся катионы Bi3+, Fe2+, Fe3+, Mn2+, Mg2+, Sb3+, Sb5+. Групповыми реагентами являются водные растворы аммиака или щелочи, которые осаждают их в виде гидроксидов, не растворимых в избытке реактива. Гидроксиды элементов пятой аналитической группы растворяются в минеральных кислотах с образованием солей соответствующих катионов. РЕАКЦИИ КАТИОНА ЖЕЛЕЗА(II) Реакция с красной кровяной солью. Образуется синий осадок "турнбулевый синий". Осадок нерастворим в кислотах, но разлагается щелочами с выделением смешанных гидроксидов Fe (II, III). Реакция с диметилглиоксимом (реактивом Чугаева). в аммиачной среде образует с Fe(II) карминово-красный комплекс - диметилглиоксимат железа (II), хорошо растворимый в воде. Определению мешают ионы никеля, образующие нерастворимый комплекс красного цвета и ионы Fe3+, образующие окрашенные гидроксиды. Влияние Fe3+ устраняют добавлением в раствор лимонной, щавелевой или винной кислот. РЕАКЦИИ КАТИОНА ЖЕЛЕЗА(III) Реакция с желтой кровяной солью. В слабокислой среде образуется темно-синий осадок «берлинской лазури» - комплексного соединения гексацианоферрата(II) железа(III). Осадок растворим в сильных кислотах и в избытке реагента. Мешают определению большие количества ионов металлов, дающие окрашенные комплексы с гексацианоферратом. Реакция с роданидом аммония NH4SCN. Образуется роданид железа (III), имеющий кроваво-красную окраску. РЕАКЦИИ КАТИОНА МАРГАНЦА (II) Реакция окисления висмутатом натрия NaBiO3: Висмутат натрия окисляет ионы Mn2+ до MnO4- фиолетово-красного цвета. Определению мешают восстановители (в том числе и хлорид-ионы) и большие количества Mn2+, поэтому перед выполнением реакции исследуемый раствор разбавляют водой. Реакция окисления пероксодисульфатом аммония (NH4)2S2O8. Окисление пероксодисульфатом аммония проводят в кислой среде в присутствии катализатора AgNO3. Наблюдают появление фиолетовой окраски раствора. РЕАКЦИИ КАТИОНА МАГНИЯ Реакция с гидрофосфатом натрия Na2HPO4. Реакцию проводят в присутствии NH4Cl, который препятствует образованию аморфного осадка Mg(OH)2, растворяющегося в присутствии NH4Cl. В результате реакции образуется белый кристаллический осадок двойной соли фосфата магния-аммония. Осадок имеет характерное строение. Реакцию можно проводить на предметном стекле и наблюдать в микроскоп форму образовавшихся кристаллов. РЕАКЦИИ КАТИОНА ВИСМУТА (III) Реакция с иодидом калия KI. При смешивании реактивов образуется черный осадок иодида висмута, который растворим в избытке реактива и образует комплексную соль тетраиодовисмутат(III) калия. Реакция восстановления Bi3+ до металлического. Хлорид олова в щелочной среде восстанавливает ионы Bi3+ до металлического висмута. Висмут при этом осаждается в виде мелкодисперсного осадка черного цвета. Проведению реакции мешают катионы Ag+ и Hg2+. РЕАКЦИИ КАТИОНА СУРЬМЫ (III) Реакция с тиосульфатом натрия Na2S2O3. Образуется красный осадок дисульфида оксида сурьмы(III). Реакция идет в кислой среде при нагревании. Мешают проведению реакции ионы Bi3+. Реакция восстановления ионов сурьмы Sb3+ до металлической сурьмы. В присутствии металлов, стоящих в ряду напряжений до сурьмы, катион Sb3+ восстанавливается до металлической сурьмы. Реакцию проводят на металлической пластинке в кислой среде. Пластинка чернеет вследствие выделения металлической сурьмы. РЕАКЦИИ КАТИОНА СУРЬМЫ (V) Реакция восстановления ионов Sb5+ до металлической сурьмы. Реакция с родамином С. Родамин С и другие основные трифенилметановые красители в солянокислом растворе образуют с хлоридным комплексом сурьмы (V) малорастворимый в воде, окрашенный в фиолетовый цвет ионный ассоциат. АНАЛИЗ СМЕСИ КАТИОНОВ Предварительное обнаружение катионов Fe2+ и Fe3+. Обнаружению катионов Fe2+ и Fe3+ не мешают ионы марганца Мn2+ и ионы магния Mg2+, поэтому в отдельных пробах исследуемого раствора определяют присутствие катионов Fe2+ и Fe3+. Обнаружение катиона Fe2+ проводят с помощью реагента гексацианоферрата (III) калия K3[Fe(CN)6]. Выпадение осадка темно-синего цвета указывает на присутствие в растворе ионов железа Fe2+. Катионы железа Fe3+ обнаруживают с помощью роданида калия KSCN в подкисленном растворе. (По кроваво-красному окрашиванию.) Катионы железа Fe3+ можно обнаружить также с помощью гексацианоферрата (II) калия K4[Fe(CN)6]. Осаждение катионов пятой группы. К исследуемому раствору добавляют раствор гидроксида натрия до полного выпадения осадка, приливают несколько капель пероксида водорода, перемешивают и нагревают на кипящей водяной бане до прекращения выделения пузырьков газа. Осадок от раствора отделяют путем центрифугирования и промывают горячей водой, в которую добавлено несколько капель хлорида аммония. Осадок содержит Fe(OH)3, MnO(OH)2 и Mg(OH)2. Отделение и определение катионов магния. К осадку добавляют раствор хлорида аммония и перемешивают стеклянной палочкой. Гидроксид магния переходит в раствор. Осадок отделяют центрифугированием и в прозрачном центрифугате определяют ионы магния Mg2+ с помощью раствора гидрофосфата натрия. Выпадение белого кристаллического осадка свидетельствует о присутствии ионов магния Mg2+ в растворе. И 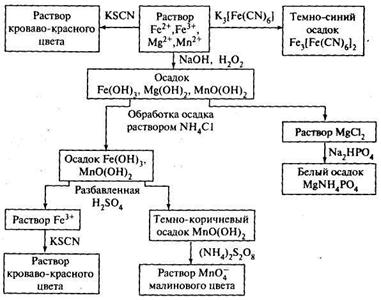 сследование осадка. К осадку, состоящему из Fe(OH)3 и МnО(ОН)2, добавляют разбавленную серную кислоту. Гидроксид железа (III) растворяется, а осадок МnО(ОН)2 отделяют от раствора центрифугированием. Темно-коричневый цвет осадка свидетельствует о присутствии марганца. Для подтверждения присутствия ионов марганца в исходном исследуемом растворе к осадку МnО(ОН)2 добавляют пероксид водорода в серной кислоте. В результате осадок растворяется и образуются ионы марганца (II). Ионы марганца (II) обнаруживают в растворе с помощью персульфата аммония. сследование осадка. К осадку, состоящему из Fe(OH)3 и МnО(ОН)2, добавляют разбавленную серную кислоту. Гидроксид железа (III) растворяется, а осадок МnО(ОН)2 отделяют от раствора центрифугированием. Темно-коричневый цвет осадка свидетельствует о присутствии марганца. Для подтверждения присутствия ионов марганца в исходном исследуемом растворе к осадку МnО(ОН)2 добавляют пероксид водорода в серной кислоте. В результате осадок растворяется и образуются ионы марганца (II). Ионы марганца (II) обнаруживают в растворе с помощью персульфата аммония.Задачи и методы количественного анализа. Классическими методами количественного анализа являются гравиметрический (основанный на точном измерении массы вещества. Использует закон сохранения массы веществ при химических превращениях) и титриметрический (основанный на измерении объёма раствора реактива точно известной концентрации, расходуемого для реакции с определяемым веществом). Задачи количественного анализа: 1. получение количественной информации о содержании ионов/молекул/групп/соединений/фаз в исследуемом объекте, 2) разработка более совершенных методов получения количественной информации, 3) усовершенствование методик. Общие положения гравиметрического анализа. Гравиметрический анализ состоит в том, что «навеску» анализируемого материала переводят в раствор, осаждают нужный компонент в виде малорастворимого соединения определенного состава, отделяют осадок, освобождают его от примесей (прокаливают) и взвешивают. Зная массу осадка, вычисляют процентное содержание данного компонента в веществе. Например, при определении хлора в хлоридах анион Сl- осаждают из раствора катионом Ag+ и по массе полученного осадка хлорида серебра делают необходимые вычисления. Весовое определение связано с длительным отстаиванием осадков, прокаливанием или высушиванием их и почти обязательным отделением мешающих компонентов. Все эти обстоятельства ограничивают применение весовых методов для сложных многокомпонентных объектов. Однако, когда требуется особо точно определить состав с высокой точностью, эти методы оказываются незаменимыми. Аналитическим сигналом в гравиметрии является масса вещества стехиометрического состава. Поэтому гравиметрия – это абсолютный (безэталонный) метод. Предел обнаружения г.а. ограничивается растворимостью осадка и чувствительностью аналитических весов. Важнейшие операции гравиметрическою анализа. Все многочисленные гравиметрические определения можно разделить на три большие группы: В методах выделения определяемый компонент выделяют в свободном состоянии из анализируемого образца и взвешивают на аналитических весах. Так, например, определяют массовую долю золы в продуктах или массовую долю сухих веществ (сухого остатка). В методах отгонки определяемый компонент количественно отгоняют в виде летучего соединения путем нагревания анализируемого образца или действием соответствующих реагентов. Наиболее разнообразное применение из гравиметрических методов получили методы осаждения. Они основаны на том, что определяемый компонент количественно осаждают химическими способами (т.е. при взаимодействии с подходящим реактивом-осадителем) в виде малорастворимого соединения. Выделившийся осадок отделяют, промывают, высушивают, прокаливают (если нужно) и взвешивают. Важнейшие операции весового анализа — осаждение, фильтрование, взвешивание. Методом осаждения проводят в следующей последовательности: 1) отбирают среднюю пробу анализируемого образца; 2) взвешивают навеску для анализа; 3) растворяют навеску; 4) осаждают определяемый компонент; 5) отделяют осадок фильтрованием; 6) промывают осадок; 7) высушивают осадок; 8) прокаливают осадок; 9) взвешивают осадок; 10) вычисляют результат анализа. Поскольку многие осадки при прокаливании изменяют свой состав, то различают осаждаемую и гравиметрическую (весовую) формы осадка. Осаждаемая форма осадка (форма осаждения) – соединение, которое осаждается из раствора при взаимодействии определяемого компонента с соответствующим реагентом (или соединение, в виде которого осаждают анализируемое вещество). Гравиметрическая (весовая) форма – соединение, которое взвешивают для получения окончательного результата анализа (или соединение, в виде которого взвешивают определяемый компонент). Требования к осаждаемой форме: 1. Осадок должен быть практически нерастворим. 2. Желательно, чтобы структура осадка давала возможность с достаточной скоростью выполнить операции фильтрования и промывания осадка. 3. Необходимо, чтобы осаждаемая форма достаточно легко и полностью превращалась в гравиметрическую форму. Требования к гравиметрической форме: 1. Состав гравиметрической формы должен соответствовать определенной химической формуле. 2. Гравиметрическая форма должна обладать достаточной химической устойчивостью. Например, осадок СаО, легко поглощающий Н2О и СО2 из воздуха (что затрудняет его точное взвешивание), иногда превращают в CaSO4, обработав серной кислотой. 3. Гравиметрическая форма, получаемая путем прокаливания, должна обладать устойчивостью при высоких температурах (термоустойчивостью). 4. Молекулярная масса гравиметрической формы должна быть по возможности большей. Иными словами, содержание определяемого элемента в гравиметрической форме должно быть как можно меньшим. Благодаря этому, относительная погрешность определения в меньшей мере влияет на результат анализа. |
