Вопросы к зачету Основы биохимии и молекулярной биологии
 Скачать 5.89 Mb. Скачать 5.89 Mb.
|
1 2
Вопросы к зачету Основы биохимии и молекулярной биологии 1. Сходство и отличия про- и эукариотических клеток. Особенности растительной Клетки  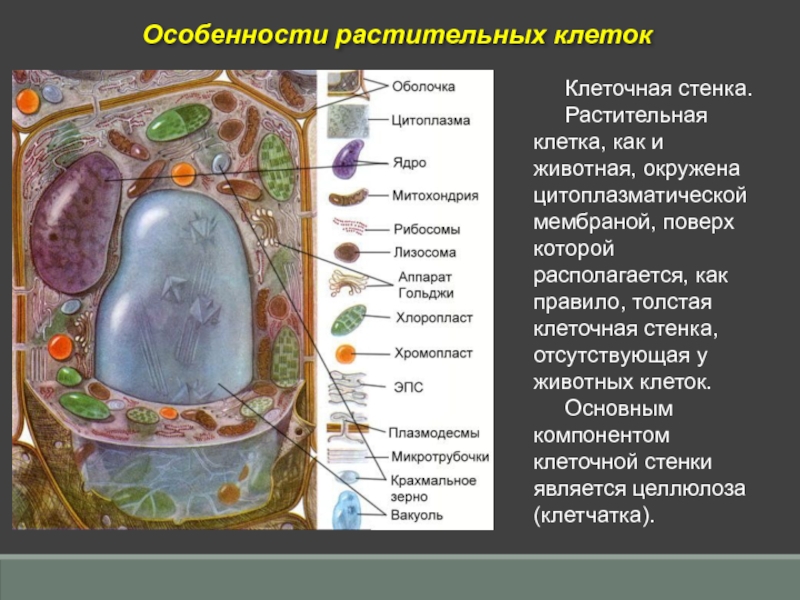 У растений присутствует толстая клеточная стенка основным компонентом является целлюлоза(клетчатка) 2  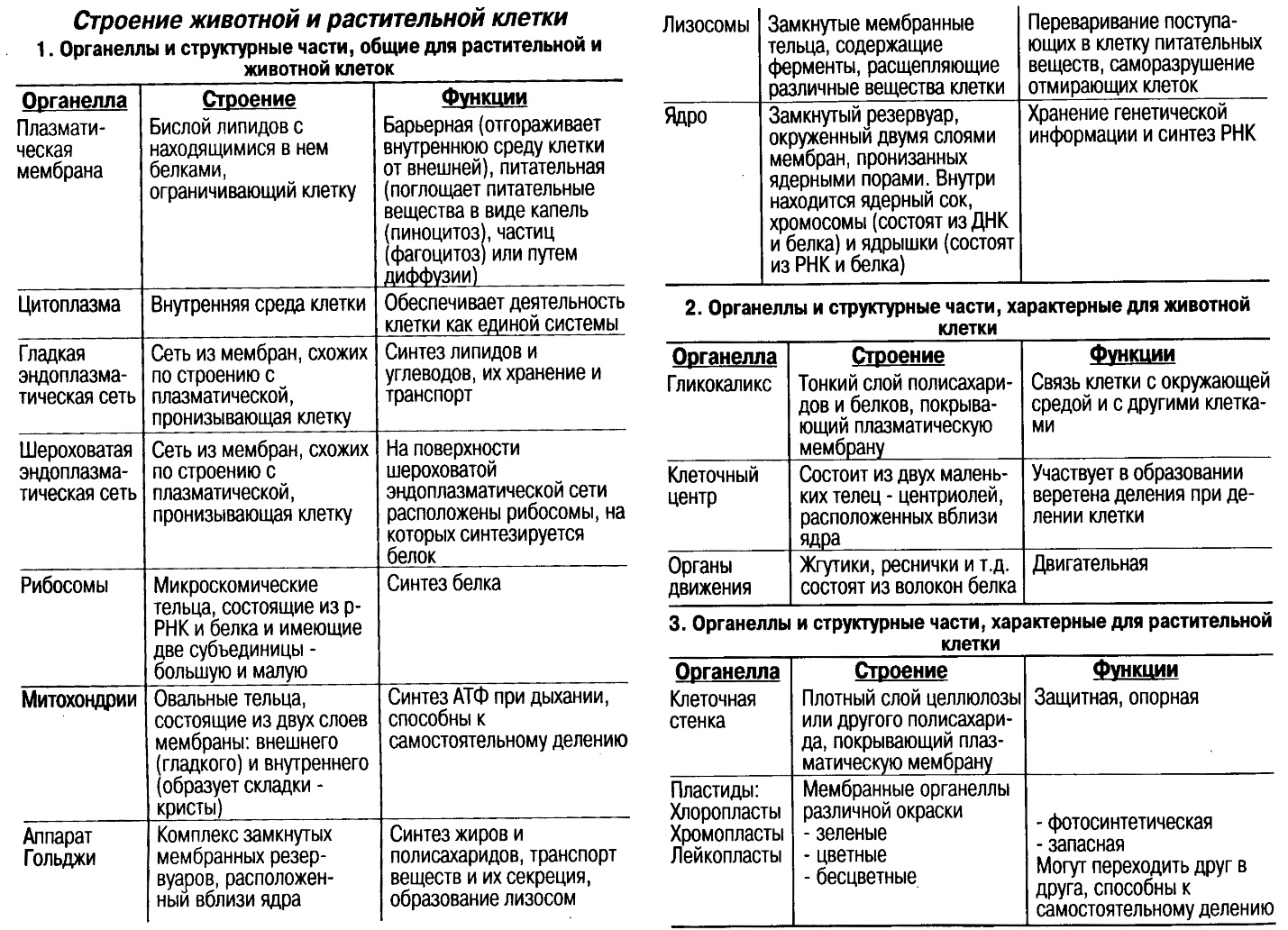 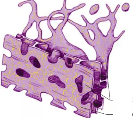    3. Классификация протеиногенных аминокислот, их свойства, понятие об изоэлектрической точке. 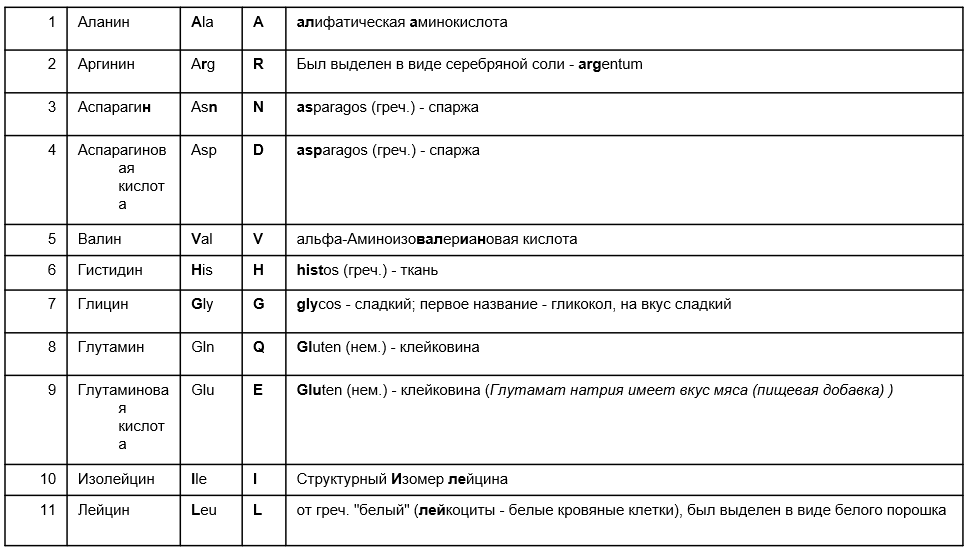 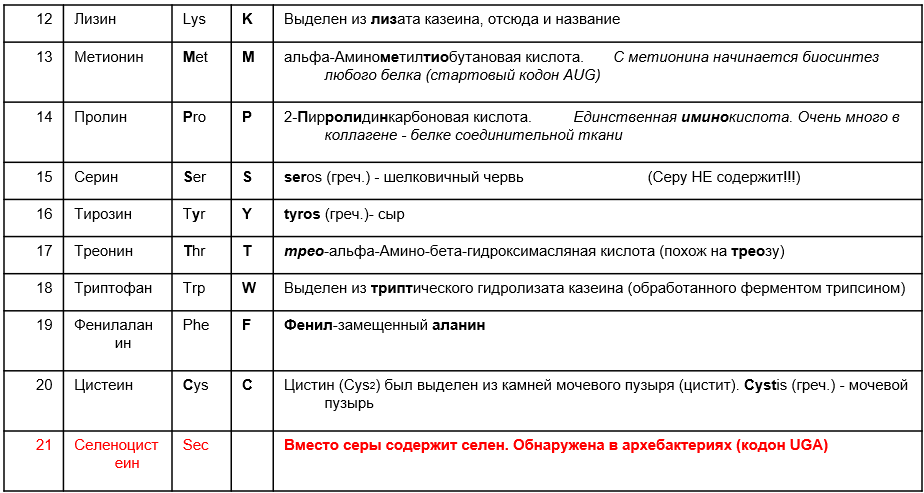 В настоящее время единой классификации аминокислот не существует. Аминокислоты делят на природные (содержатся в растительных и животных организмах) и синтетические – получены искусственным путем. В основу классификации могут быть положены и другие критерии: а) По способности боковых радикалов к взаимодействию с Н2О: - неполярные (гидрофобные) – плохо растворимые в воде (глицин, аланин, валин, изолейцин, лейцин, пролин); - полярные (гидрофильные) незаряженные – хорошо растворимые в воде (серин, треонин, цистеин, метионин, аспарагин, глутамин); - полярные отрицательно заряженные при pH=7 (аспартат, глутамат); - полярные положительно заряженные при pH=7 (лизин, аргинин, гистидин). б) По функциональной принадлежности заместителей: - алифатические монокарбоновые кислоты: глицин, аланин, валин, лейцин, изолейцин; - алифатические оксиаминокислоты: серин, треонин; - серосодержащие: цистеин, метионин; - моноаминодикарбоновые: аспарагиновая и глутаминовая кислоты; - амиды моноаминодикарбоновых: аспарагин, глутамин. - диаминомонокарбоновые: лизин, аргинин; - ароматические: фенилаланин, тирозин; - гетероциклические: гистидин, триптофан; - иминокислота: пролин. в) По биологическому и физиологическому значению: - незаменимые – не могут синтезироваться организмом из других соединений и целиком поступают с пищей (валин, лейцин, изолейцин, треонин, метионин, лизин, фенилаланин, триптофан); - полузаменимые – образуются в недостаточном количестве в организме, частично поступают с пищей (аргинин, тирозин, гистидин); - заменимые – синтезируются в организме (все остальные) 1) Амфотерность аминокислот  2) Реакции карбоксильной группы Образование внутрикомплексных солей с катионами тяжелых 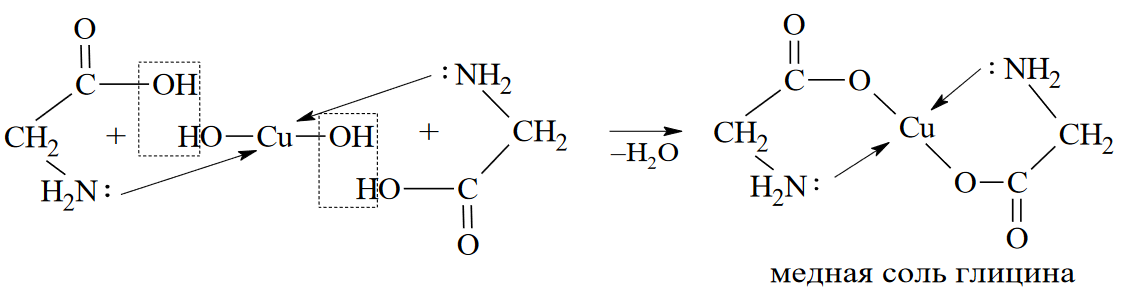 Образование сложных эфиров Образование хлорангидридов 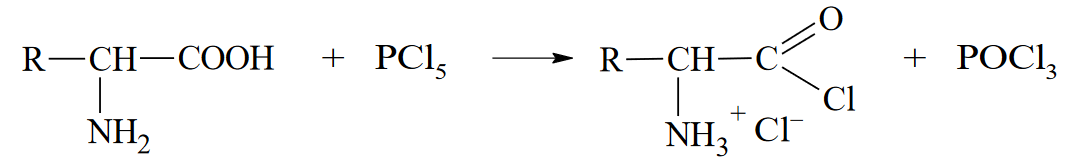 Образование амидов аминокислот 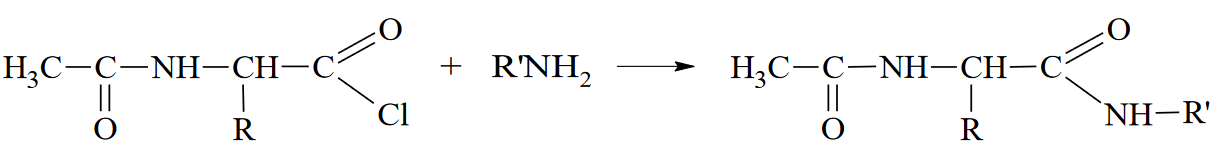 Декарбоксилирование аминокислот 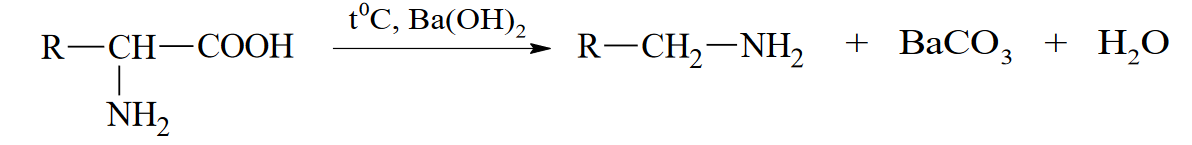 3) Реакции аминогруппы Реакция ацилирования. Образование N-замещённых амидов 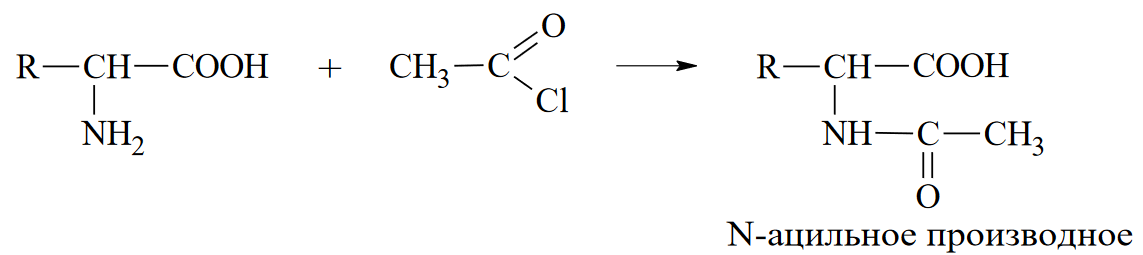 Алкилирование аминокислот 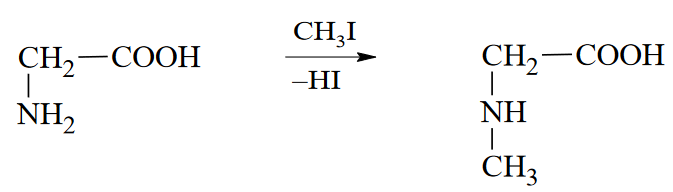 Действие азотистой кислоты (дезаминирование) 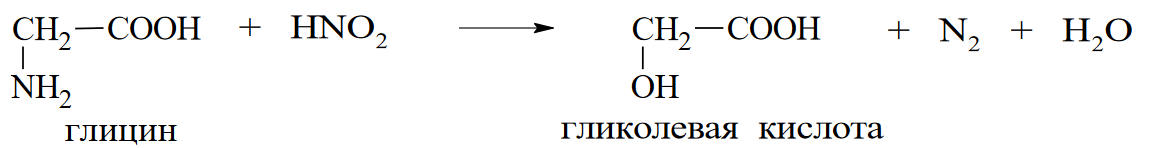 Взаимодействие с альдегидами 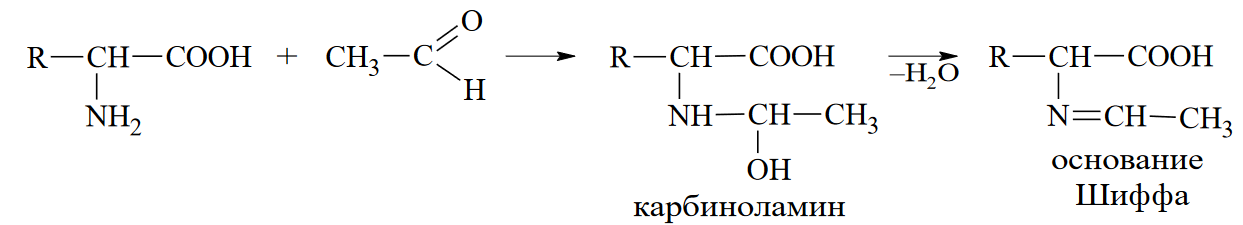 Взаимодейстивие с динитрофторбензолом (ДНФБ) 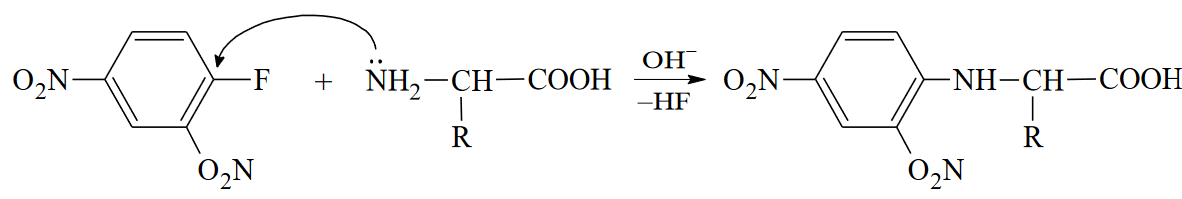 Реакция Руэманна (нингидриновая реакция): 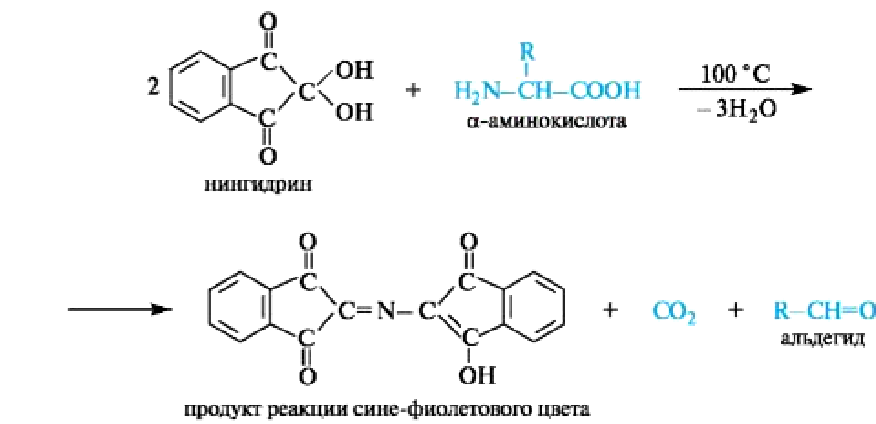 Значение рН, при котором концентрация биполярных ионов максимальна, а катионная и анионная формы находятся в равных и минимальных концентрациях, называется изоэлектрической точкой (рI). 4. Методы разделение и определения аминокислот. Методы идентификации и разделения аминокислот Электрофорез основан на различии в скорости движения белков в электрическом поле, которая определяется величиной заряда белка при определенных значениях рН и ионной силы раствора. Применяется в клинической медицине для анализа белковых и пептидных смесей, сыворотки крови. В последнее время более широкое распространение получили методы зонального электрофореза белков на различных носителях, в частности на твердых поддерживающих средах: гелях крахмала и полиакриламида, целлюлозе. Хроматография - физико-химический метод разделения и анализа смесей веществ, основанный на распределении их компонентов между двумя несмешивающимися фазами – неподвижной и подвижной. Различают следующие разновидности хроматографии: - адсорбционная- разделение компонентов смеси основано на их различной сорбируемости на твердом адсорбенте; - распределительная - твердая фаза служит опорой для стационарной жидкой фазы. Разновидностью является хроматография на бумаге; - ионообменная - используют подходящую ионообменную смолу, с функциональными группами которой обменивается и задерживается на колонке часть белков, в то время как другие белки беспрепятственно элюируются с колонки; - гель-хроматография, или метод молекулярных сит, основан на способности небольших молекул проникать в поры геля, тогда как большие молекулы остаются снаружи, двигаясь вместе с подвижной фазой вниз вдоль колонки. Позволяет разделить белки с разной молекулярной массой. Перспективными видами хроматографии являются высокоэффективная жидкостная хроматография (ВЭЖХ) и газовая хроматография. 5. Первичная структура белка. Пептиды, особенности пептидной связи. Пептидная связь – это вид амидной связи, возникающей при образовании пептидов и белков в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты. Особенности пептидной связи 1) Пептидная связь имеет частично характер двойной связи. 2) Копланарность пептидной связи все атомы, входящие в пептидную группу, находятся в одной плоскости, при этом атомы Н и О расположены по разные стороны от пептидной связи 3) Транс-расположение заместителей: в природных белках пептидная связь имеет транс-конфигурацию, т.е. является транспланарной 4) Способность к образованию водородных связей. Белки – это высокомолекулярные соединения (биополимеры), состоящие из мономерных звеньев α-аминокислот, соединенных между собой пептидными (амидными) связями. Первичная структура белка – это аминокислотная последовательность белка, т.е., состав и расположение а.к. в полипептидной цепи. Эту структуру формируют ковалентные связи: пептидные связи между α-амино- и α- карбоксильными группами аминокислот и дисульфидные мостики между остатками цистеина. 6. Вторичная структура белков. Вторичной структурой белка называют некоторые наиболее часто встречающиеся способы укладки а.к. цепи, формирующие характерные структурные элементы. При этом образуются водородные связи между СО- и NH-группами пептидного остова одной цепи или смежных полипептидных цепей. Укладка полипептидного остова в каждом белке не является случайной, она определяется его первичной структурой и является неизменной и специфичной для конкретного белка. Наиболее известными типами регулярной упорядоченной вторичной структуры являются α-спираль и β-складчатый слой 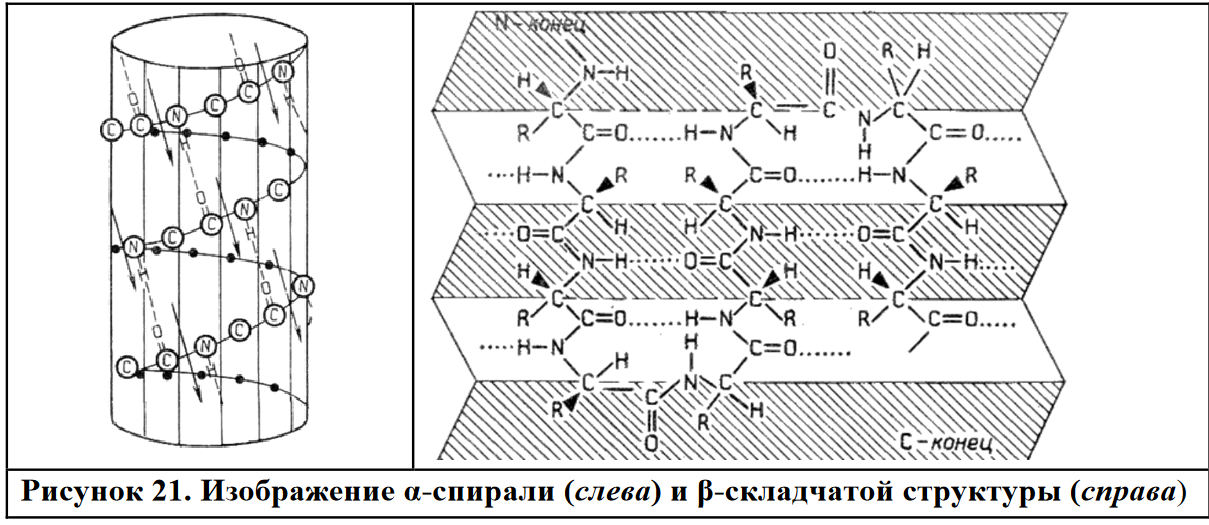 7. Третичная и четвертичная структура белков. Третичная структура белка – это распределение в пространстве всех атомов белковой молекулы, или иначе говоря, пространственная упаковка спирализованной полипептидной цепи. Полипептидная цепь, содержащая определенное число участков вторичной структуры, обычно свертывается в относительно компактную систему, в которой элементы вторичной структуры взаимодействуют между собой и с участками неупорядоченной структуры. Основную роль в образовании третичной структуры белка играют водородные, ионные, гидрофобные и дисульфидные связи, которые образуются в результате взаимодействия между радикалами аминокислот. Для многих белков третичная структура эквивалентна пространственной структуре белка. Каждый белок обладают своей уникальной пространственной структурой. По форме молекулы и особенностям формирования третичной структуры белки делят на глобулярные и фибриллярные. Глобулярные белки имеют сферическую или эллипсовидную форму молекулы (глобула). Фибриллярные белки имеют нитевидную форму (фибриллы), образуют волокна и пучки волокон. Четвертичная структура белка характерна только для белков, состоящих из нескольких полипептидных цепей, она возникает в результате ассоциации нескольких субъединиц в компактную глобулу. Другими словами, четвертичная структура - это взаимное расположение субъединиц белка в пространстве. Белки, обладающие четвертичной структурой, называют также олигомерными белками, а полипептидные цепи, входящие в их состав, субъединицами или протомерами. 8. Классификация и функции белков. Классификация белков. Белки разделяются на протеины (простые белки), состоящие только из аминокислот и при гидролизе почти не образующие других продуктов, и протеиды (сложные белки), состоящие из собственно белковой части, построенной из α-аминокислот, и из соединенной с ней небелковой части, иначе называемой простетической группой.
9. Глобулярные и фибриллярные белки, основные примеры. Глобулярные белки имеют сферическую или эллипсовидную форму молекулы (глобула). В процессе образования глобулы гидрофобные радикалы аминокислот погружаются во внутренние области, гидрофильные радикалы располагаются на поверхности молекулы. При взаимодействии с водной фазой полярные радикалы образуют многочисленные водородные связи. Белки удерживаются в растворённом состояния за счёт заряда и гидратной оболочки. В организме глобулярные белки выполняют динамические функции (транспортную, ферментативную, регуляторную, защитную). К глобулярным белкам относятся: Альбумин – белок плазмы крови; содержит много остатков глутамата и аспартата; осаждается при 100%-ном насыщении раствора сульфатом аммония. Глобулины – белки плазмы крови; по сравнению с альбумином обладают большей молекулярной массой и содержат меньше остатков глутамата и аспартата, осаждаются при 50%-ном насыщении раствора сульфатом аммония. Гистоны – входят в состав ядер клеток, где образуют комплекс с ДНК. Содержат много остатков аргинина и лизина. Фибриллярные белки имеют нитевидную форму (фибриллы), образуют волокна и пучки волокон. Между соседними полипептидными цепями имеется много поперечных ковалентных сшивок, они нерастворимы в воде. Переходу в раствор препятствуют неполярные радикалы аминокислот и сшивки между пептидными цепями. Фибриллярные белки в организме выполняют главным образом структурную функцию, обеспечивают механическую прочность тканей. К таки белкам относятся: Коллаген – белок соединительной ткани. В его составе преобладают аминокислоты глицин, пролин, гидроксипролин. Эластин – более эластичен, чем коллаген, входит в состав стенок артерий, лёгочной ткани, в его составе преобладают аминокислоты глицин, аланин, валин. Кератин – белок эпидермиса и производных кожи, в его структуре преобладает аминокислота цистеин 10. Понятие о ферментах. Строение ферментов. Международная классификация ферментов. Ф  ерменты – это белки, обладающие каталитической активностью. Это специфические и стереоспецифические высокоэффективные катализаторы биохимических реакций, протекающих в живой клетке (ферменты увеличивают скорость реакций в ерменты – это белки, обладающие каталитической активностью. Это специфические и стереоспецифические высокоэффективные катализаторы биохимических реакций, протекающих в живой клетке (ферменты увеличивают скорость реакций в  - -  раз. раз.В настоящее время принята классификация ферментов, в которой они сгруппированы в 6 классов в соответствии с типом катализируемых реакций: 1. Оксидоредуктазы - окислительно-восстановительные реакции (850 ферментов, обязательно наличие кофермента: НАД+, НАДФ+, ФАД+, гем Fe2+). 2. Трансферазы - реакции переноса функциональных групп ( 950 ферментов, иногда требуют кофактора – например, пиридоксальфосфат). 3. Гидролазы - реакции гидролиза (более 1000 ферментов: протеазы, липазы, эстеразы; кофакторов не требуют). 4. Лиазы - реакции отщепления групп негидролитических путем (более 300 ферментов; кофакторов не требуют). 5. Изомеразы - реакции изомеризации (140 ферментов; кофакторов не требуют). 6. Лигазы - реакции синтеза за счет энергии АТФ (117 ферментов; кофакторы: АТФ, КоА-H). 11. Основные характеристики работы фермента: единица активности, максимальная скорость, число оборотов. Е Уравнение связывает начальную скорость реакции v0 с концентрацией субстрата [S] и максимальной скоростью Vmax через константу Михаэлиса: Константой Михаэлиса (Км) называется концентрация субстрата, при которой достигается половина максимальной скорости реакции (1/2 Vmax), эта величина характеризует данный фермент по отношению к данному субстрату. Число оборотов фермента – число молекул субстрата, претерпевающих превращение за 1 мин в расчете на 1 активный центр или 1 активную молекулу фермента. 1 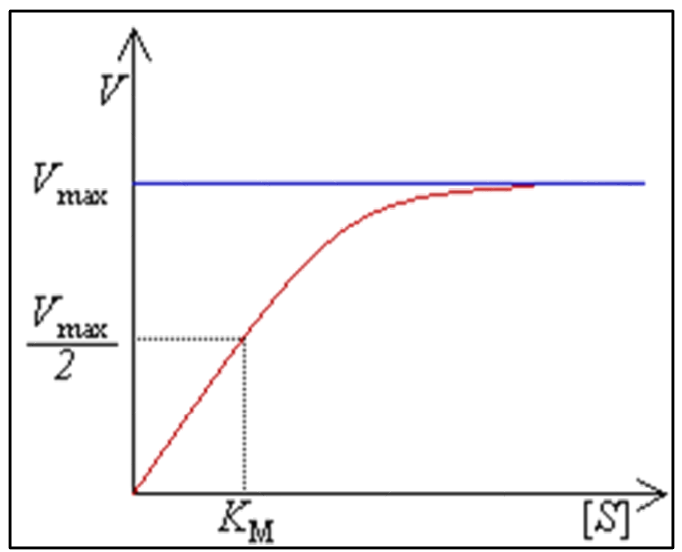 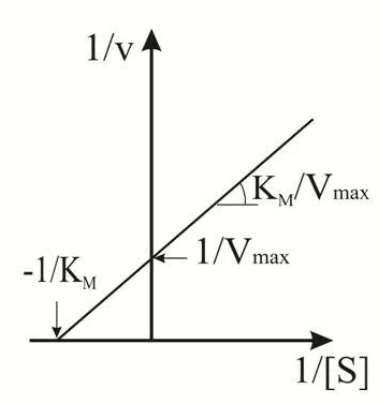 Константой Михаэлиса (Км) называется концентрация субстрата, при которой достигается половина максимальной скорости реакции (1/2 Vmax), эта величина характеризует данный фермент по отношению к данному субстрату. По характеру действия ингибиторы разделяют на необратимые и обратимые. Необратимые ингибиторы химически модифицируют важные для активности функциональные группы фермента, поэтому после удаления свободного ингибитора активность модифицированного фермент не восстанавливается. Обратимые ингибиторы взаимодействуют с ферментом без образования ковалентной связи – при удалении такого ингибитора активность фермент восстанавливается. Среди обратимых ингибиторов различают два вида - конкурентные и неконкурентные ингибиторы. Неконкурентные ингибиторы, как правило, не имеют сходства с субстратом. Он могут обратимо связываться как со свободным ферментом, так и с ES-комплексом и не конкурируют с субстратом, т. е. не вытесняют его из комплекса с ферментом. 13. Участие коферментов и кофакторов в ферментативных реакциях. Большинство ферментов для проявления ферментативной активности нуждается в низкомолекулярных органических соединениях небелковой природы (коферментах) и/или в ионах металлов (кофакторах). Термин «кофермент» обозначал часть некоторых ферментов, которая легко отделялась от белковой молекулы фермента и удалялась через полупроницаемую мембрану при диализе. Несколько позже было выяснено, что большинство ферментов состоит из термолабильной белковой части и термостабильного небелкового фактора — кофермента. Белковая часть получила название «апофермент», который в отсутствие кофермента не обладает каталитической активностью. Кофермент с белковой молекулой (апоферментом) формируют молекулу холофермента, обладающую каталитической активностью. 14. Моносахариды – линейные и циклические формы. Оптическая изомерия. Биологически важные альдозы и пентозы. В зависимости от этого моносахариды подразделяются на альдозы (в моносахариде содержится альдегидная группа) и кетозы (содержится кетогруппа). Например, глюкоза — это альдоза, а фруктоза — это кетоза. 1. Межклассовая изомерия Альдозы и кетозы являются межклассовыми изомерами. Так, изомерами являются альдоза глюкоза и кетоза фруктоза: 2. Оптическая изомерия Наличие нескольких асимметрических атомов углерода обусловливает существование большого числа оптических изомеров у моносахаридов. D–изомер, у которого на проекции гидроксильная группа у асимметрического атома расположена справа от основной цепи. L–изомер(Природный), у которого на проекции гидроксильная группа у асимметрического атома расположена слева от основной цепи. 3. Таутомерия (мутаротация) Для всех моносахаридов характерно явление мутаротации, т. е. существование в циклической и нециклической формах.  Альдозы  Кетозы  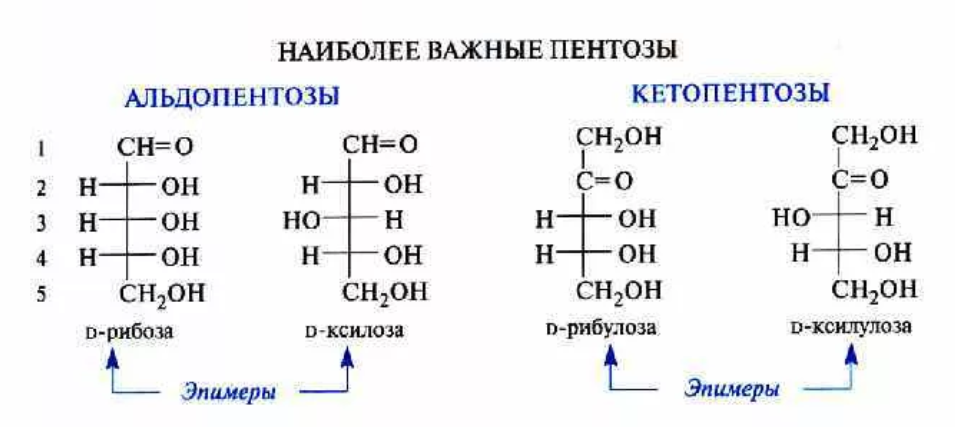 15. Олигосахариды. Важнейшие представители дисахаридов. В 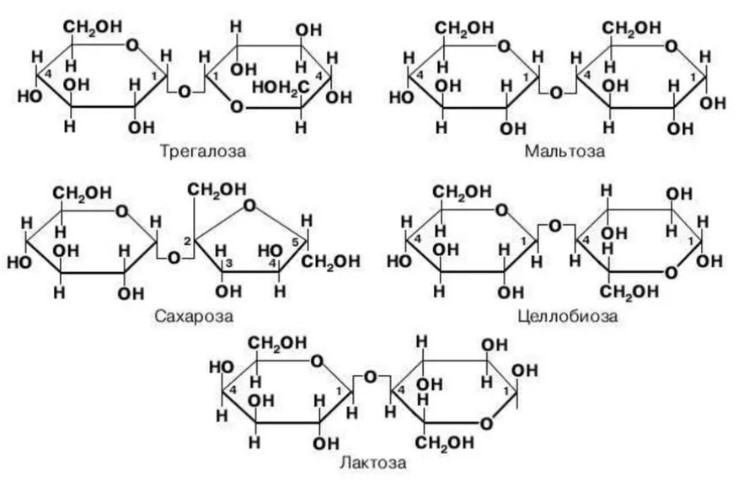 о всех дисахаридах о-гликозидная связь можеет разрушаться кислотным гидролизом о всех дисахаридах о-гликозидная связь можеет разрушаться кислотным гидролизом 16. Полисахариды. Структура и функции основных полисахаридов. Гликоген Крахмал Клетчатка (растительная целлюлоза) Гепарин Пектины Хитин 17. Липиды – классификация, структура и основные функции. Липиды – производные высших жирных кислот, спиртов и альдегидов. В состав молекул липидов входят гидрофобные и гидрофильные компоненты. По химическому строению липиды очень разнообразны. Физические свойства липидов – нерастворимые в воде маслянистые вещества; из клеток липиды экстрагируют неполярными растворителями (эфир, хлороформ). Гидрофобные и гидрофильные компоненты молекул липидов Гидрофобные компоненты, входящие в состав липидов: 1. Высшие жирные кислоты (RCOOH) 2. Высшие жирные спирты (RCH2OH) 3. Высшие альдегиды (RCOH) Высшие жирные кислоты (ж.к.) – это длинноцепочечные карбоновые кислоты, содержащие от 4 до 36 углеродных атомов (C4 - C36); они имеют одну карбоксильную группу и длинный неполярный углеводородный «хвост», из-за которого липиды нерастворимы в воде. Двойная связь в природных ж.к. всегда имеет цис-конфигурацию, это приводит в пространстве к сильному изгибу алифатической цепи ж.к. в составе мембраны. При температуре 37 °С насыщенные ж.к. С12 - С24 находятся в твердом воскоподобном состоянии, а ненасыщенные ж.к. представляют собой жидкости Химическая классификация и функции липидов Нейтральные липиды: Полярные липиды: 1) Глицеролипиды 1) Фосфолипиды 2) Диольные липиды 2) Сфинголипиды 3) Воска 3) Гликолипиды 4) Эфиры холестерина 4) Сульфолипиды 5) Фосфонолипиды Триацилглицериды (жиры, нейтральные жиры) – это сложные эфиры глицерина и 3-х молекул высших жирных кислот. Представляют собой неполярные, гидрофобные вещества, не растворяются в воде. В биологических мембранах почти отсутсвуют Для накопления энергии Д 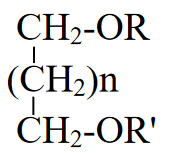 иольные липиды (простые эфиры) иольные липиды (простые эфиры)Запасающая функция Воска Воска – сложные эфиры длинноцепочечных ж.к. (С14 - С36) и жирных спиртов (С16 - С22). Сложноэфирные связи могут омыляться Стеролы Молекулы стеролов состоят из компактного, жесткого гидрофобного ядра из 4-х конденсированных колец, а полярной головкой является гидроксильная группа. Эти липиды присутствуют во многих мембранах растений, животных и микробов, их относят к неомыляемым липидам иологические функции холестерина: 1  ) Регулирует вязкость биологических мембран клетки (составляет 30% от всех ) Регулирует вязкость биологических мембран клетки (составляет 30% от всехлипидов цитоплазматической мембраны) 2) Предшественник всех стероидных гормонов 3) Предшественник желчных кислот и витамина Д2 Полярные липиды представляют собой ярко выраженные амфифильные молекулы, т.к. в их состав входят одновременно длинные гидрофобные остатки («хвосты») и гидрофильная полярная головка. Полярные липиды – это основные липидные компоненты биологических мембран клеток. 1) Фосфолипиды - наиболее важная группа липидов в составе мембран, они подразделяются на две группы: глицерофосфолипиды и сфингофосфолипиды. В состав глицерофосфолипидов входят два остатка высших жирных кислот, присоединенных к первой и второй гидроксильным группам глицерина с помощью сложноэфирных связей, а третий ОН-группа глицерина связана с замещенным остатком фосфорной кислоты. Второй углеродный атом (С2)-глицерина у природных фосфолипидов асимметричен и имеет L- конфигурацию. Фосфатидилхолин (ФХ) является основным мембранным компонентом клеток высших животных и растений, его содержание достигает более 50% от суммыфосфолипидов. В бактериальных клетках ФХ не содержится. Фосфатидилэтаноламин (ФЭА) содержится в тканях животных и растений в меньших количествах, чем ФХ (15 - 30% от общего количества фосфолипидов), но является одним из основных компонентом мембран бактериальных клеток. 2) Сфингофосфолипиды являются производными С18-аминоспирта сфингозина, имеющего транс-конфигурацию двойной связи. N-ацилированное производное сфингозина принято называть церамидом. Церамид (гидрофобная часть) может быть связан с различными полярными головками, поэтому сфинголипиды разделяют на фосфосфинголипиды и гликосфинголипиды. Сфинголипиды, также как и глицерофосфолипиды, являются важными мембранными компонентами. Фосфосфинголипиды имеют такие же полярные головки, как иглицерофосфолипиды, а их гидрофобная часть представлена церамидом. В плазматических мембранах животных клеток широко распространен сфингомиелин (церамид-1-фосфорилхолин). Основными жирнокислотными компонентами в миелине являются кислоты 24:1 и 24:0 3) Гликолипиды Гликоглицеролипиды – это нейтральные липиды, у которых в sn-3- положении глицерина находится углевод, присоединенный с помощью гликозидной связи, например, галактоза. Гликоглицеролипиды широкопредставлены в мембранах хлоропластов растений (моногалактозилдиглицерид составляет половину от всех липидов тилакоидной мембраны), они обнаружены также в заметных количествах в сине-зеленых водорослях и бактериях. Для мембран грамположительных бактерий характерны гликоглицеролипиды с большим разнообразием сахаров. В мембранах животных клеток гликоглицеролипиды встречаются редко. 18. Строение и функции биологических липидных мембран. Мембранный транспорт. Биологические мембраны – это полупроницаемые барьеры, которые отделяет содержимое любой клетки от внешней среды, обеспечивая её целостность, регулируют обмен между клеткой и внешней средой. Внутриклеточные мембраны разделяют клетку на специализированныезамкнутые отсеки - органеллы, в которых поддерживаются определённые условия среды. Возможность существования биологических мембран обусловлена уникальной способностью фосфолипидов формировать в воде стабильные бимолекулярные пленки. Основными компонентами биологических мембран являются липиды и белки. На долю углеводов может приходиться менее 10% массы мембран, при этом они всегда входят в состав гликолипидов или гликопротеинов. Соотношение между белками и липидами в мембранах значительно варьирует – от 20% белка в миелиновой оболочке нервных клеток до 80% в функционально активной внутренней мембране митохондрий. К 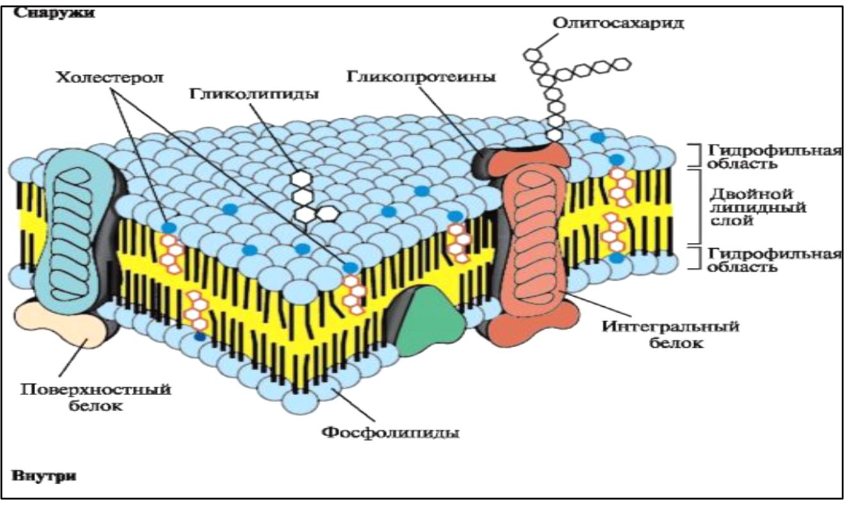 роме липидов биологическая мембрана включает и различные белки: 1) интегральные – пронизывающие мембрану насквозь и 2) периферические – расположенные на внешней или прилегающие к внутренней стороне мембраны. Некоторые белки являются точками контакта клеточной мембраны с цитоскелетом внутри клетки или клеточной стенкой снаружи. Интегральные белки выполняют функцию ионных каналов, различных транспортеров, роме липидов биологическая мембрана включает и различные белки: 1) интегральные – пронизывающие мембрану насквозь и 2) периферические – расположенные на внешней или прилегающие к внутренней стороне мембраны. Некоторые белки являются точками контакта клеточной мембраны с цитоскелетом внутри клетки или клеточной стенкой снаружи. Интегральные белки выполняют функцию ионных каналов, различных транспортеров,ферментов и рецепторов. Характерный признак липидов, которые образуют бислой – исключительно низкая критическая константа мицеллообразования – около 10-10М. Толщина липидного бислоя определяется длиной углеводородных цепей и составляет 4-5 нм, но зависит от плотности упаковки липидных молекул в бислое. Биологические функции клеточных мембран 1. Защитная функция для клеток и внутриклеточных органелл 2. Избирательный транспорт различных веществ 3. Передача информации посредством гормонов, медиаторов и нервного импульса 4. Преобразование энергии 5. Молекулярное узнавание 6. Ферментативная деятельность мембран 19. Основные компоненты нуклеиновых кислот: гетероциклические (нуклеиновые основания), нуклеозиды, нуклеотиды; номенклатура. Нуклеиновые кислоты (НК) – это важнейшие высокомолекулярные биополимеры, осуществляющие хранение и передачу генетической информации в живой клетке. Существуют два структурно различных типа нуклеиновых кислот – дезоксирибонуклеиновые кислоты (ДНК) и рибонуклеиновые кислоты (РНК). Нуклеиновые кислоты могут быть линейными и кольцевыми (ковалентно замкнутыми), состоять из одной или двух цепей. Нуклеиновые кислоты представляют собой полимеры, построенные из мономерных звеньев – нуклеотидов, соединенных между собой фосфодиэфирными связями. Нуклеотид состоит из 3-х составных частей: азотистого основания, моносахарида пентозы и одной или нескольких фосфатных групп. Нуклеозид – это нуклеотид без фосфатной группы. Моносахарид, входящий в состав нуклеотида, это пентоза, которая может присутствовать в одной из двух форм: β-D-рибозы и β-D-2-дезоксирибозы: Состав нуклеиновых кислот Г 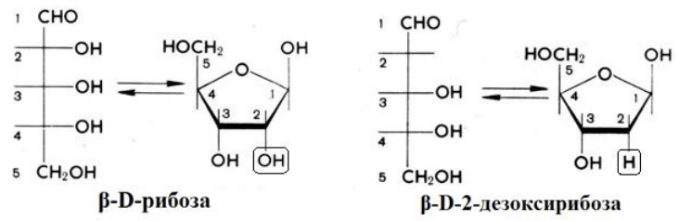 етероциклические (азотистые) основания, входящие в состав нуклеотидов, представляют собой производные одного из двух соединений – пурина или пиримидина. К пиримидинам относятся урацил (U), тимин (T) и цитозин (C), к пуринам – аденин (A) и гуанин (G). етероциклические (азотистые) основания, входящие в состав нуклеотидов, представляют собой производные одного из двух соединений – пурина или пиримидина. К пиримидинам относятся урацил (U), тимин (T) и цитозин (C), к пуринам – аденин (A) и гуанин (G). 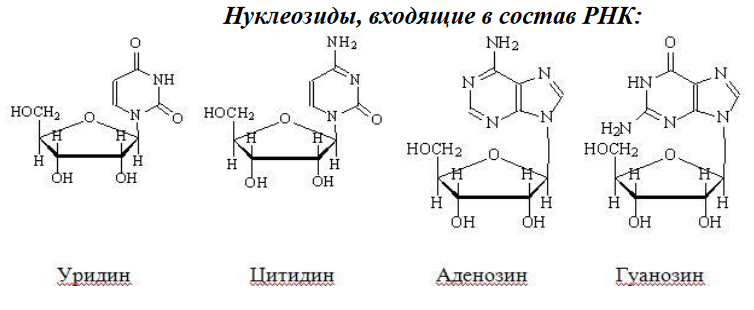 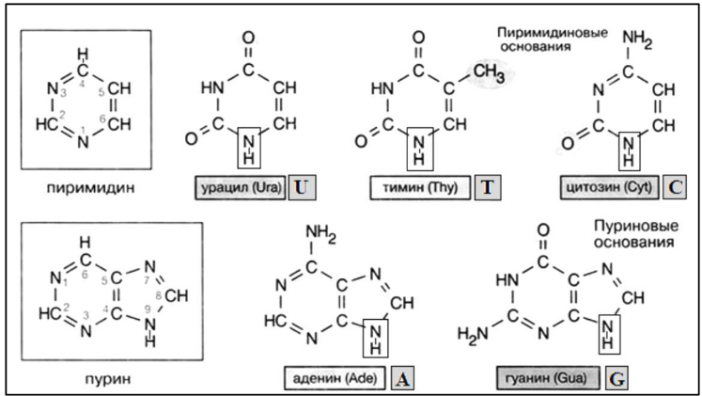 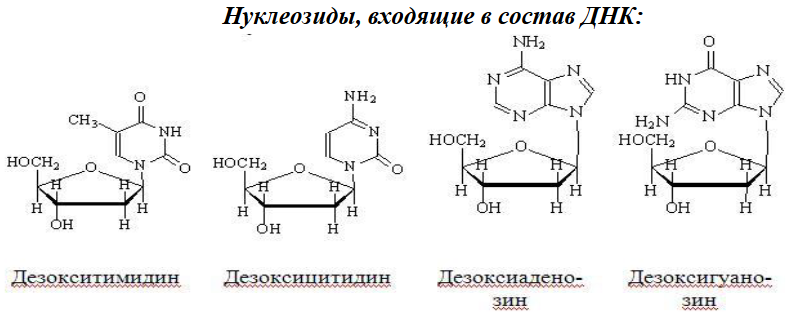 Нуклеозиды, входящие в состав ДНК: В нуклеозидах азотистое основание присоединяется к остатку сахара с помощью β-N-гликозидной связи, соединяющей С1'-атом пентозы с N1-атомом пиримидина или с N9-атомом пурина. В нуклеотидах ортофосфорная кислота образует сложноэфирные связи со спиртовыми группами рибозы или дезоксирибоз 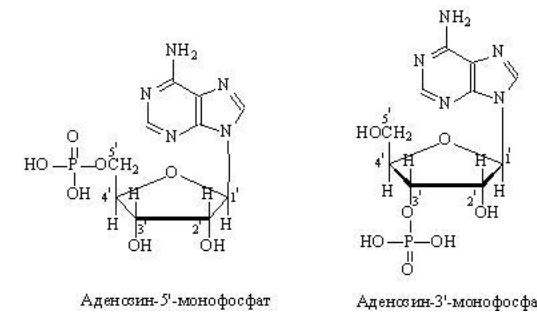 20. Пространственная структура ДНК. Принцип комплементарности. Цепи двойной спирали ДНК антипараллельны и комплементарны, т.е., образование поперечных водородных связей всегда происходит между основаниями C и G (2 связи) и А и Т (3 связи). Под термином комплементарность понимают взаимное соответствие последовательностей оснований в противоположных цепях ДНК. Геометрия двойной спирали ДНК такова, что соседние пары оснований находятся друг от друга на расстоянии 0.34 нм и повернуты на 36° вокруг оси спирали. На один виток спирали приходится, следовательно, 10 пар оснований (360°/36°=10), шаг спирали равен 3.4 нм (10 • 0.34 нм). Диаметр двойной спирали ДНК составляет примерно 2 нм. Стабильность двойной связи обусловлена следующими взаимодействиями: 1. Водородное связывание между комплементарными основаниями А-Т и G-C. 2.«Стэкинг»-взаимодействия между параллельно расположенными основаниями, перпендикулярно плоскости оснований: - Ван-дер-ваальсовы контакты между атомами; - перекрывание π-орбиталей атомов азотистых оснований. 3. Гидрофобный эффект – неполярные основания расположены внутри спирали и защищены от непосредственного контакта с водой. 21. Типы РНК. 1) Информационная (матричная, мРНК) является копией (транскриптом) соответствующей ДНК, которая служит матрицей для синтеза белка. Каждые три последовательно расположенных нуклеотида на мРНК (называемые кодоном) задают один аминокислотный остаток. 2) Транспортная (тРНК). Молекулы тРНК переносят специфические аминокислотные остатки к определенному участку мРНК в ходе биосинтеза белка. 3) Рибосомная (рРНК). Молекулы рРНК встречаются в различных формах и образуют в комплексе с белками рибосому - сложный надмолекулярный комплекс, при участии которого происходит биосинтез белка. 4) Гетерогенная ядерная РНК (гяРНК) содержится в ядре клеток эукариот. 5) Рибозимы – молекулы РНК с ферментативной активностью, встречаются в некоторых клетках. 6) У РНК-содержащих вирусов одноцепочечная молекула РНК служит носителем генетической информации. 22. Генетический код. Свойства генетического кода. Виды мутаций. Генетическая информация во всех клетках хранится в виде последовательности оснований в форме ДНК (у некоторых вирусов – в форме РНК). Большинство генов кодируют белки, т.е. содержат информацию о последовательности аминокислотных остатков в белке. Каждый а.к. остаток записан в ДНК в виде «кодового слова» - кодона, представляющего собой последовательность из 3-х нуклеотидов (триплет нуклеотидов). Кодоны являются фрагментами последовательности одной из 2-х цепей ДНК (смысловой), прочитанной в направлении 5' → 3'. Было показано, что три кодона, UAA, UAG и UGA, не кодируют никаких аминокислот и называются нонсенс-кодонами. Позднее исследования на мутантных бактериофагах показали, что эти кодоны определяют терминацию синтеза Геномные мутации – изменения, касающиеся числа целых хромосом в геноме. К геномным мутациям относится изменение числа хромосом: анеуплоидия; полиплоидия. Хромосомные мутации – изменения, касающиеся участков внутри одной хромосомы. делеция — выпадение участка хромосомы в средней её части; дупликация — двух- или многократное повторение генов, локализованных в определённом участке хромосомы; инверсия — поворот участка хромосомы на 180°, в результате чего в этом участке гены расположены в последовательности, обратной по сравнению с обычной; транслокация — изменение положения какого-либо участка хромосомы в хромосомном наборе. К наиболее распространённому типу транслокаций относится обмен участками между двумя негомологичными хромосомами. Участок хромосомы может изменить своё положение и без обмена, оставаясь в той же хромосоме или включаясь в какую-то другую. Генные мутации – изменения, происходящие внутри одного гена. дупликации — повторение участка гена, вставки — появление в последовательности лишней пары нуклеотидов, делеции -- выпадение одной или более пар нуклеотидов, замены нуклеотидных пар — AT -><- ГЦ; AT -><- ЦГ; или AT -><- ТА, инверсии — переворот участка гена на 180°. Молчащая мутация – такое изменение в нуклеотидной последовательностиДНК, которое приводит к образованию синонимичного кодона, и в результате аминокислотная последовательность кодируемого белка не изменяется. - замена (миссенс-мутация) ведет к замене в белке одной аминокислоты на другую в результате изменения последовательности оснований, которое не приводит к образованию синонимичного кодона. - мутация со сдвигом рамки считывания обусловлена вставкой или удалением (делецией) одного или большего числа оснований в последовательности ДНК, что приводит к изменению аминокислотной последовательности белка 23. Репликация ДНК. Репликация – копирование родительской ДНК с образованием дочерних ДНК, последовательность которых комплементарна родительской и определяется ею. Репликон – генетическая единица репликации, т.е. сегмент ДНК, который автономно воспроизводится (т.е. реплицируется) в процессе клеточного роста и деления. Репликация является полуконсервативным процессом, так как две цепи исходной родительской молекулы ДНК оказываются в разных дочерних молекулах ДНК. Репликация протекает в несколько стадий: 1  ) Инициация – начинается в сайте oriC (origion replication inducing), характерном для каждого конкретного вида живого организма, происходит узнавание и связывание инициаторного сегмента ДНК с белком хеликазой. Хеликаза расплетает цепи ДНК за счет энергии АТФ и формируется репликатиная вилка. ) Инициация – начинается в сайте oriC (origion replication inducing), характерном для каждого конкретного вида живого организма, происходит узнавание и связывание инициаторного сегмента ДНК с белком хеликазой. Хеликаза расплетает цепи ДНК за счет энергии АТФ и формируется репликатиная вилка.2) Элонгация – движение репликативной вилки. Репликативная вилка – это та часть молекулы ДНК, которая уже разъединилась на 2 цепи и в данной моментслужит матрицей для синтеза дочерней ДНК. В ходе репликации репликативная вилка перемещается вдоль молекулы (рис. 33), и при этом расплетаются все новые участки родительской ДНК – до тех пор, пока вилка не дойдет до точки окончания синтеза (точка терминации). Поскольку фермент ДНК-полимераза катализирует репликацию только в направлении от 5'-конца ДНК к 3'-концу, а цепи родительской ДНК антипараллельны, только одна из новых цепей синтезируется непрерывно и называется лидирующей. Вторая цепь, называемая отстающей, синтезируется в виде коротких фрагментов Оказаки, которые затем сшиваются (лигируются), и образуется непрерывная вторая цепь 3) Терминация – завершение биосинтеза ДНК в результате считывания всей последовательности ДНК. ДНК-гиразы закручивают спираль ДНК и восстанавливают ее структуру. 24. Транскрипция. Транскрипция – процесс переноса генетической информации от ДНК к РНК: мРНК синтезируется по принципу комплементарности в соответствии с последовательностью оснований в ДНК, которая служит для нее матрицей. Этапы транскрипции: 1) Инициация – начало синтеза, присоединение фермента ДНК-зависимой РНК- полимеразы к промотору – участку ДНК размером около 40 пар оснований, указывающему на начало транскрипции. Это фермент, катализирующий синтез РНК. Для инициации транскрипции необходимы холофермент, нуклеозидтрифосфат (всегда АТР или GTP) и промотор. Когда полимераза связывается с промотором, происходит локальное расплетание двойной спирали ДНК и образуется открытый промоторный комплекс. 2) Элонгация – рост олигонуклеотидной цепи мРНК, катализируемый кор- ферментом. Движущийся вдоль нити ДНК кор-фермент действует подобно застежке-молнии, «раскрывая» двойную спираль, которая замыкается позади фермента по мере того, как соответствующие основания РНК образуют комплементарные пары с основаниями ДНК. 3) Терминация – завершение синтеза мРНК на терминаторном сайте ДНК в результате считывания всей последовательности гена и разрушения нуклеиново- белкового комплекса за счет образования терминаторной «шпильки». 4) Посттранскрипционный процессинг мРНК у эукариот – это процесс созревания мРНК, при котором первичный РНК-транскрипт (называемый, строго говоря, гетерогенная или гяРНК) модифицируется и превращается в зрелую матричную РНК. У прокариот молекулы мРНК не подвергаются процессингу. 25. Биосинтез белка. Основные этапы трансляции. Т 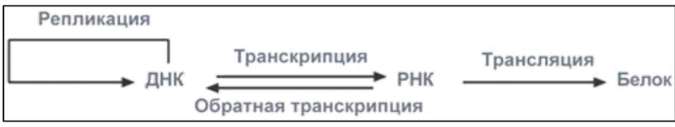 рансляция – это биосинтез белка. В ходе этого процесса генетическая информация, записанная в виде 4-х буквенного кода на мРНК, переводится на рибосомах в 20-ти буквенный код белковой структуры. рансляция – это биосинтез белка. В ходе этого процесса генетическая информация, записанная в виде 4-х буквенного кода на мРНК, переводится на рибосомах в 20-ти буквенный код белковой структуры.Зрелая мРНК транспортируется из клеточного ядра в цитоплазму и связывается с рибосомами, где происходит перевод записанной в РНК информации в полипептидную последовательность. Передача информации осуществляется в результате взаимодействия между кодонами мРНК и транспортной РНК (тРНК). Молекулы тРНК на 3'-конце доставляют к рибосоме именно те аминокислоты, которые соответствуют закодированной в мРНК информации. Стадии трансляции: 1) Активация аминокислот. Каждая из 20 а.к. ковалентно присоединяется к соответствующей ей тРНК при помощи ферментов аминоацил-тРНК-синтетаз. Стартовым сигналом к началу синтеза белка служит расположенный на мРНК 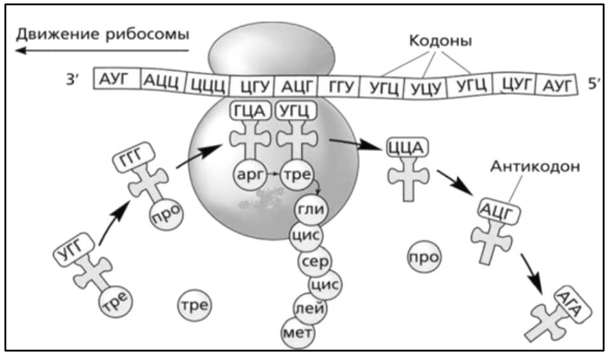 кодон AUG, кодирующий модифицированную форму метионина - формилметионин (fMet), с которой начинается синтез белка. Он присоединяется к молекулам тРНК определенного типа (тРНКf), отличающимся от тРНКМе, посредством которых Met включается в срединную часть полипептидной цепи. кодон AUG, кодирующий модифицированную форму метионина - формилметионин (fMet), с которой начинается синтез белка. Он присоединяется к молекулам тРНК определенного типа (тРНКf), отличающимся от тРНКМе, посредством которых Met включается в срединную часть полипептидной цепи.2) Инициация синтеза белка начинается с момента образования инициирующего комплекса, состоящего из мРНК, 30S-субчастицы рибосомы и молекулы аминоацил-тРНКf с присоединенным fMet. Следующим шагом является присоединение второй 50S-субчастицы рибосомы. Источником энергии для инициации синтеза белка служит реакция гидролиза ГТФ до ГДФ и Pi (неорганического фосфата). 3) Элонгация – это последовательное присоединение к растущей полипептидной цепи доставляемых к рибосоме а.к. остатков. Каждый шаг элонгации состоит из трех этапов: - узнавание кодона из 3-х нуклеотидов на мРНК заключается в комплементарном связывании с антикодоном на соответствующей молекуле аминоацил-тРНК; - образование пептидной связи; - транслокация – освобождение участка А и экспонирование очередного кодона, которые позволяют начаться следующему циклу элонгации. 4) Терминация – окончание синтеза, которое происходит по команде одного из 3-х терминирующих (бессмысленных – не кодирующих а.к.) кодонов UAA, UGA или UAG. Вместо продолжения синтеза цепи происходит терминация, катализируемая специальными белками. Вслед за этим происходит диссоциация комплекса мРНК-рибосома и высвобождение полипептидной цепи. Далее рибосома диссоциирует на 30S- и 50S-субчастицы 2 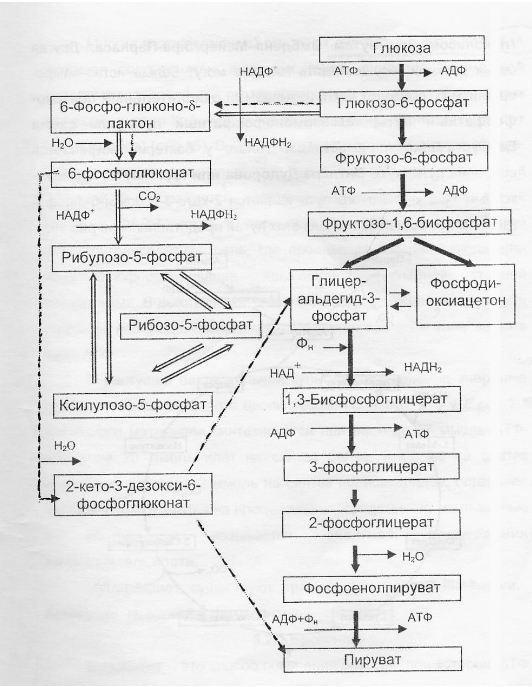 6. Общая схема катаболизма. Нуклеотидные коферменты. Макроэргические молекулы. 6. Общая схема катаболизма. Нуклеотидные коферменты. Макроэргические молекулы.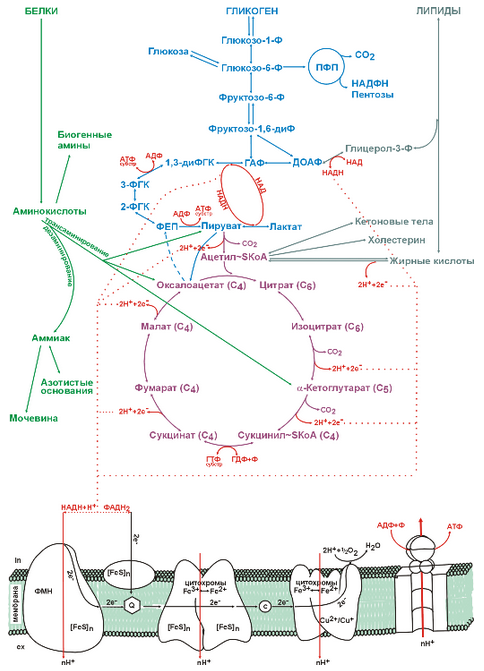 Метаболизм представляет собой высоко координированную и целенаправленную клеточную активность, обеспеченную участием многих взаимосвязанных ферментативных систем, и включает два неразрывных процесса анаболизм и катаболизм. Метаболизм представляет собой высоко координированную и целенаправленную клеточную активность, обеспеченную участием многих взаимосвязанных ферментативных систем, и включает два неразрывных процесса анаболизм и катаболизм. Катаболизм – расщепление и окисление сложных органических молекул до более простых конечных продуктов. Оно сопровождается высвобождением энергии, заключенной в сложной структуре веществ. Большая часть высвобожденной энергии рассеивается в виде тепла. Меньшая часть этой энергии "перехватывается" коферментами окислительных реакций НАД и ФАД, некоторая часть сразу используется для синтеза АТФ. Первый этап Происходит в кишечнике (переваривание пищи) или в лизосомах (самообновление клеток) при расщеплении уже ненужных или лишних молекул. При этом освобождается около 1% энергии, заключенной в молекуле. Она рассеивается в виде тепла. Второй этап Вещества, образованные при внутриклеточном гидролизе или проникающие в клетку из крови, на втором этапе обычно превращаются в пировиноградную кислоту (моносахариды в гликолизе), в ацетил-SKoA, в пируват и другие кетокислоты (в катаболизме аминокислот), в ацетил-SКоА (при β-окислении жирных кислот). Локализация второго этапа – цитозоль и митохондрии. На этом этапе выделяется около 30% энергии, заключенной в молекуле, и при этом запасается около 13% от всей энергии вещества (или примерно 43% от выделенной на этом этапе энергии). Третий этап Все реакции этого этапа идут в митохондриях. Ацетил-SКоА (и кетокислоты) включается в реакции цикла трикарбоновых кислот, где углероды веществ окисляются до углекислого газа. Выделенные атомы водорода соединяются с НАД и ФАД, восстанавливают их и после этого НАДН и ФАДН2 переносят водород в цепь ферментов дыхательной цепи, расположенную на внутренней мембране митохондрий. Сюда же отдают свои атомы водорода молекулы НАДН и ФАДН2, образованные на втором этапе (гликолиз, окисление жирных кислот и аминокислот). В третьем этапе выделяется до 70% всей энергии вещества. Из этого количества усваивается почти две трети (66%), что составляет около 46% от общей. Таким образом, из 100% энергии окисляемой молекулы клетка запасает больше половины – 59%. На внутренней мембране митохондрий в результате процесса под названием "окислительное фосфорилирование" образуется вода и главный продукт биологического окисления – АТФ. 1) Нуклеозидтрифосфаты. Наиболее распространенными высокоэнергетическими общими промежуточными продуктами являются нуклеозидтрифосфаты (НТФ), которые могут передавать свою концевую высокоэнергетическую фосфатную группу любой из многочисленных органических молекул-акцепторов (чаще всего энергия образуется в виде АТФ). Особенность высокоэнергетических нуклеотидов состоит в том, что они выступают в качестве универсального источника энергии для большого числа энергозависимых реакций. 2)Молекула АТФ состоит из аденилатной группы и трех остатков фосфорной группы. Значительная часть свободной энергии этой молекулы обусловлена взаимным электростатическим отталкиванием этих фосфатных остатков аналогично взаимному отталкиванию одноименно заряженных зарядов. Разрыв связей между остатками фосфорной кислоты сопровождается освобождением энергии. 3) Аргининфосфат и креатинфосфат - выполняют роль своеобразных аккумуляторов химической энергии, которые используются для быстрого фосфорилирования АТФ во время энергетического мышечного сокращения. Их называют фосфагенами. 4) Ацилфосфаты– макроэргические соединения с ангидридной связью, в которых карбонильный атом углерода ацильной группы особенно легко участвует в реакции с нуклеофилами. Значение ΔG = -12,8 ккал/моль. Например, глицеро-1,3-дифосфат + НОН → глицеро-3-фосфат + Н3РО4. 5) Тиоэфиры играют очень важную роль в метаболизме в качестве метаболически активной формы ацильной группы. В природе основными тиолсодержащими соединениями являются: кофермент А, липоевая кислота, белки с –SH группой: ацетил-КоА + НОН → ацетат + НS-КоА; ΔG = -7,37 ккал/моль. 6) Восстановленные формы НАДН + Н+ и НАДФН + Н+, будучи синтезированными в клетке, затем вновь окисляются, при этом происходит перенос электронов на кислород. Этот способ используется в качестве основного, посредством которого клетка превращает химическую энергию поступивших извне питательных веществ в утилизируемую метаболическую энергию. 27. Гликолиз (основные этапы, биологический смысл, энергетический результат). 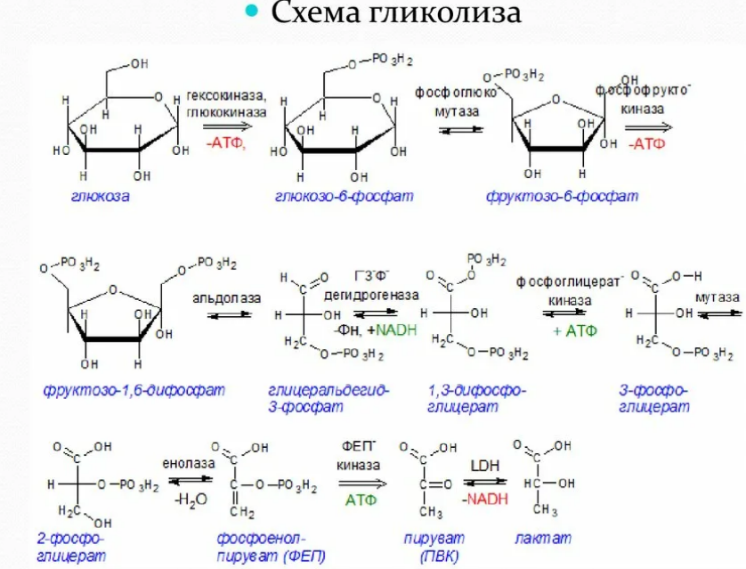 Первый этап внутриклеточного окисления углеводов осуществляется без участия кислорода и называется гликолиз (от «гликис» — сладкий, «лизис» — распад). Он происходит в цитоплазме. Первый этап внутриклеточного окисления углеводов осуществляется без участия кислорода и называется гликолиз (от «гликис» — сладкий, «лизис» — распад). Он происходит в цитоплазме.На первых этапах гликолиза тратится две молекулы АТФ на фосфорилирование 1 молекулы сахара. Образующаяся гексоза (С6), несущая два остатка фосфорной кислоты, распадается на две фосфорилированные триозы (2*С3). Затем происходит окисление фосфотриозы (фосфорилированного C3-сахара — «половинки» глюкозы) до фосфоглицериновой кислоты (ФГК). Это окисление осуществляется путем отнятия двух атомов водорода и переноса их на НАД с образованием НАДН. Выделяющаяся при этом энергия используется для присоединения фосфатного остатка к АДФ с образованием АТФ. Так как окислению подвергаются две триозы («половинки» глюкозы), образовавшиеся в результате расщепления 1 глюкозы, то образуется 2 молекулы АТФ на 1 молекулу глюкозы, т. е. восполняются затраты на активацию глюкозы. Образовавшаяся ФГК превращается далее в пировиноградную кислоту (ПВК), или пируват, при этом синтезируется еще две молекулы АТФ в расчете на 1 молекулу глюкозы. Таким образом, расщепление в гликолизе одной молекулы глюкозы дают в результате выигрыш в 2 молекулы АТФ. Пируват — это конечный продукт гликолиза. В результате этого процесса в клетке будет накапливаться НАД∙Н, который необходимо снова превратить в НАД. У аэробов водород, который несет НАДН, передается на молекулярный кислород в дыхательной цепи митохондрий с образованием воды и большого количества АТФ. В условиях же бескислородной среды окисление НАДН до НАД+ происходит путем передачи водородов на образовавшийся в гликолизе пируват. В отсутствие кислорода пируват все равно не может быть окислен далее. Этот процесс восстановления пирувата и его дальнейших превращений называется брожением, его цель — получение НАД+ для дальнейшего использования вновь в гликолизе. Без НАД+ гликолиз остановится, и клетка погибнет от недостатка энергии (АТФ). Суммарное уравнение Значение гликолиза: 1) осуществляет связь между дыхательными субстратами и циклом Кребса; 2) поставляет на нужды клетки две молекулы АТФи две молекулы НАДH при окислении каждой молекулы глюкозы (в условиях аноксии гликолиз, по-видимому, служит основным источником АТФ в клетке); 3) производит интермедиаты для синтетических процессов в клетке (например, фосфоенолпируват, необходимый для образования фенольных соединений и лигнина); 4) в хлоропластах обеспечивает прямой путь для синтеза АТФ, независимый от поставок НАДФH; кроме того, через гликолиз в хлоропластах запасенный крахмал метаболизируется в триозы, которые затем экспортируются из хлоропласта. 28. Цикл трикарбоновых кислот (основные этапы, биологический смысл, энергетический результат). Цикл протекает в матриксе митохондрий и представляет собой окисление молекулы ацетил-SКоА в восьми последовательных реакциях. В первой реакции связываются ацетил и оксалоацетат (щавелевоуксусная кислота) с образованием цитрата (лимонной кислоты), далее происходит изомеризация лимонной кислоты до изоцитрата и две реакции дегидрирования с сопутствующим выделением СО2 и восстановлением НАД. В пятой реакции образуется ГТФ, это реакция субстратного фосфорилирования. Далее последовательно происходит ФАД-зависимое дегидрирование сукцината (янтарной кислоты), гидратация фумаровой кислоты до малата (яблочная кислота), далее НАД-зависимое дегидрирование с образованием оксалоацетата. В итоге после восьми реакций цикла вновь образуется оксалоацетат. Ф 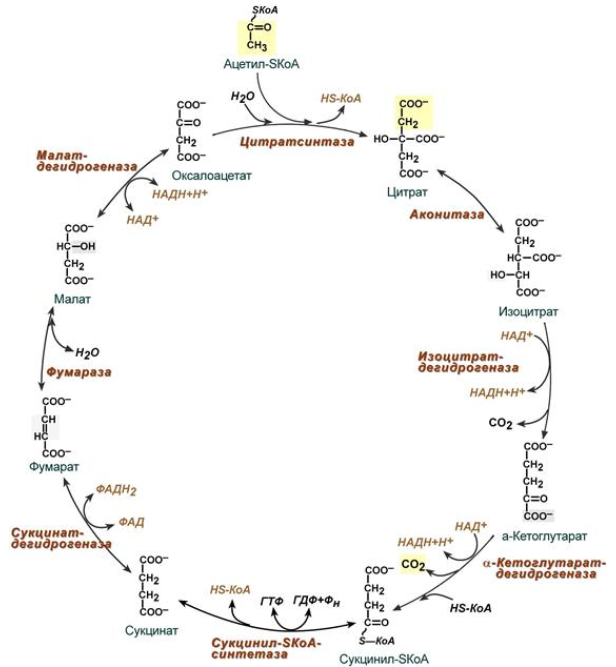 ункции ЦТК ункции ЦТК 1. Энергетическая генерация атомов водорода для работы дыхательной цепи, а именно трех молекул НАДН и одной молекулы ФАДН2, синтез одной молекулы ГТФ (эквивалентна АТФ). 2. Анаболическая. В ЦТК образуются предшественник гема – сукцинил-SКоА, кетокислоты, способные превращаться в аминокислоты – α-кетоглутарат для глутаминовой кислоты, оксалоацетат для аспарагиновой, лимонная кислота, используемая для синтеза жирных кислот, оксалоацетат, используемый для синтеза глюкозы Выполняют функцию: интеграционную, амфиболическую (т.е. катаболическую и анаболическую), энергетическую и водороддонорную роль. 29. β-Окисление жирных кислот (основные этапы, биологический смысл, энергетический результат). Этапы окисления жирных кислот 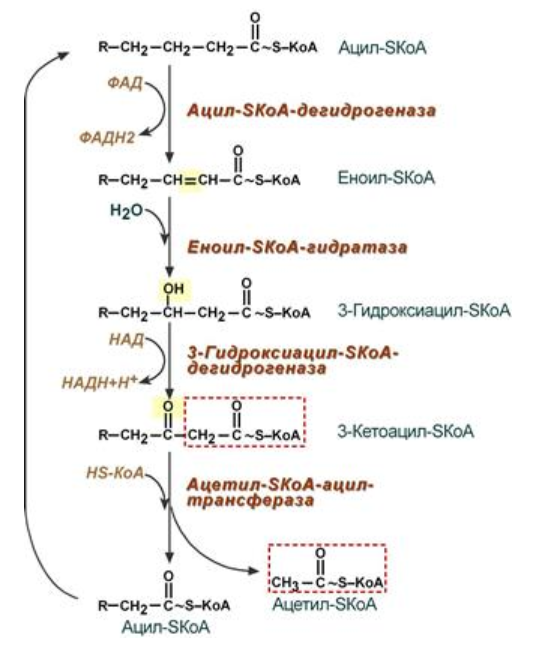 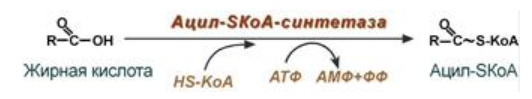 1. Прежде, чем проникнуть в матрикс митохондрий и окислиться, жирная кислота должна активироваться в цитозоле. Это осуществляется присоединением к ней коэнзима А с образованием ацил-SКоА. Ацил-SКоА является высокоэнергетическим соединением. Необратимость реакции достигается гидролизом дифосфата на две молекулы фосфорной кислоты. 1. Прежде, чем проникнуть в матрикс митохондрий и окислиться, жирная кислота должна активироваться в цитозоле. Это осуществляется присоединением к ней коэнзима А с образованием ацил-SКоА. Ацил-SКоА является высокоэнергетическим соединением. Необратимость реакции достигается гидролизом дифосфата на две молекулы фосфорной кислоты.2 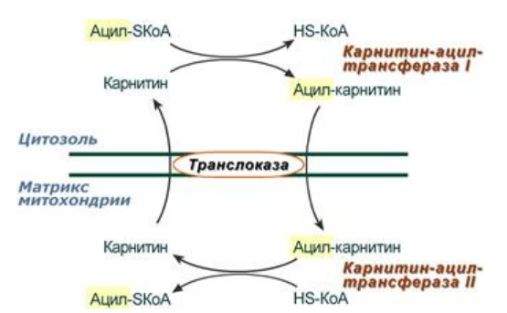 . Ацил-SКоА не способен проходить через митохондриальную мембрану, поэтому существует способ переноса жирной кислоты в комплексе с витаминоподобным веществом карнитином (витамин В11). На наружной мембране митохондрий имеется фермент карнитин-ацилтрансфераза I. . Ацил-SКоА не способен проходить через митохондриальную мембрану, поэтому существует способ переноса жирной кислоты в комплексе с витаминоподобным веществом карнитином (витамин В11). На наружной мембране митохондрий имеется фермент карнитин-ацилтрансфераза I.3. После связывания с карнитином жирная кислота переносится через внутреннюю митохондриальную мембрану транслоказой. На внутренней стороне этой мембраны фермент карнитин-ацилтрансфераза II вновь образует ацил-SКоА, который вступает на путь β-окисления. 4. Процесс собственно β-окисления состоит из 4-х реакций, повторяющихся циклически. В них последовательно происходит окисление (ацил-SКоА-дегидрогеназа), гидратирование (еноил-SКоА-гидратаза) и вновь окисление 3-го атома углерода (гидроксиацил-SКоА-дегидрогеназа). В последней, трансферазной, реакции от жирной кислоты отщепляется ацетил-SКоА. К оставшейся (укороченной на два углерода) жирной кислоте присоединяется HS-КоА, и она возвращается к первой реакции. Все повторяется до тех пор, пока в последнем цикле не образуются два ацетил-SКоА. 30. Дыхательная цепь и окислительное фосфорилирование, цель переноса электронов (основные этапы). Принцип работы дыхательной цепи Образующиеся в реакциях катаболизма НАДН и ФАДН2 передают атомы водорода (т.е. протоны водорода и электроны) на ферменты дыхательной цепи. Электроны движутся по ферментам дыхательной цепи и теряют энергию. Эта энергия используется на выкачивание протонов Н+ из матрикса в межмембранное пространство. В конце дыхательной цепи электроны попадают на кислород и восстанавливают его до воды. Протоны Н+ стремятся обратно в матрикс и проходят через АТФ-синтазу. При этом они теряют энергию, которая используется для синтеза АТФ. В пируватдегидрогеназной реакции и в цикле Кребса происходит дегидрирование (окисление) субстратов (пируват, изоцитрат, α-кетоглутарат, сукцинат, малат). В результате этих реакций образуются НАДН и ФАДН2. Эти восстановленные формы коферментов окисляются в митохондриальной дыхательной цепи. Окисление НАДН и ФАДН2, протекающее сопряжённо с синтезом АТФ из АДФ и Н3РО4 называется 1 2 |
