тобт. Вопросы по курсу теоретические основы биотехнологии
 Скачать 385.01 Kb. Скачать 385.01 Kb.
|
|
Классификация микроорганизмов по типу получение энергии и источникам углерода. Различают углеродное и азотное питание. I. По типу углеродного питания микроорганизмы принято делить на аутотрофы и гетеротрофы. Аутотрофы (прототрофы) – микроорганизмы, способные воспринимать углерод из углекислоты воздуха. К ним относятся нитрифицирующие бактерии, железобактерии, серобактерии. Аутотрофы способны использовать воспринятую углекислоту для синтеза сложных органических соединений. Таким образом, аутотрофы обладают способностью синтезировать сложные органические соединения из неорганических. Поскольку такие микробы не нуждаются в готовых органических соединениях, среди них нет болезнетворных. Однако среди аутотрофов встречаются микроорганизмы, обладающие способностью усваивать углерод из углекислоты воздуха и из органических соединений. Такие микроорганизмы, имеющие смешанный тип питания определены как миксотрофы.Гетеротрофы в противоположность аутотрофам используют углерод из любых готовых органических соединений (чаще всего это углерод спиртов, сахаров, органических кислот, многоатомных спиртов). К гетеротрофам принадлежат возбудители различного рода брожений, гнилостные микробы и микроорганизмы – возбудители различных заболеваний. Однако деление микроорганизмов на аутотрофы и гетеротрофы достаточно условно, так как при изменении условий среды обмен веществ у микроорганизмов может меняться.Гетеротрофы включают в себя две подгруппы: метатрофы (сапрофиты) – живут за счет использования мертвых субстратов (гнилостные микроорганизмы) и паратрофы - паразитические микроорганизмы, живущие на поверхности или внутри организма хозяина и питающиеся за его счет. II. По способу усвоения азотистых веществ микроорганизмы подразделяют на четыре группы: ·Протеолитические, способные расщеплять нативные белки, пептиды, аминокислоты. ·Дезаминирующие, способные отщеплять аминогруппы только у свободных аминокислот. ·Нитритно-нитратные, усваивающие окисленные формы азота. ·Азотфиксирующие, обладающие свойством усваивать атмосферный азот. Некоторые микроорганизмы в качестве ростовых факторов используют аминокислоты, синтезируемые самой микробной клеткой или находящиеся в среде. Некоторые микроорганизмы обладают способностью синтезировать ростовые факторы в относительно больших количествах, обеспечивая не только свои потребности, но и интенсивно выделяя синтезируемые вещества в окружающую среду. Например, пропионовокислые бактерии способны синтезировать витамин В12, что активно используется в промышленности. Кроме описанных способов получения микроорганизмами питательных веществ часто применяется классификация микроорганизмов в зависимости от источника энергии: · Фототрофные микроорганизмы – это микроорганизмы, способные использовать в качестве источника энергии свет. Например, синезеленые водоросли, пурпурные серобактерии. Эти микроорганизмы содержат пигменты, по своему составу близкие к хлорофиллу растений. · Хемотрофные микроорганизмы получают энергию в результате окислительно-восстановительных реакций с участием питательных субстратов.
См1???
См3
При поверхностном методе культура растет на поверхности твердой увлажненной питательной среды. Мицелий полностью обволакивает и довольно прочно скрепляет твердые частицы субстрата, из которого получают питательные вещества. Поскольку для дыхания клетки используют кислород, то среда должна быть рыхлой, а слой культуры-продуцента небольшим. Выращивание производственной культуры происходит обычно в асептических условиях, но среду и кюветы необходимо простерилизовать. Перед каждой новой загрузкой также необходима стерилизация оборудования. Преимущества поверхностной культуры: значительно более высокая конечная концентрация фермента на единицу массу среды (при осахаривании крахмала 5 кг поверхностной культуры заменяют 100 кг культуральной жидкости), поверхностная культура относительно легко высушивается, легко переводится в товарную форму. Посевной материал может быть трёх видов: - культура, выросшая на твердой питательной среде; - споровый материал; - мицелиальная культура, выращенная глубинным способом. В три этапа получают и посевную культуру. Сначала музейную культуру продуцента пересевают на 1 - 1.5 г увлажненных стерильных пшеничных отрубей в пробирку и выращивают в термостате до обильного спорообразования. Второй этап - аналогично, но в колбах, третий - в сосудах с 500 г среды. Основу питательной среды составляют пшеничные отруби, как источник необходимых питательных и ростовых веществ. Кроме того, они создают необходимую структуру среды. Для повышения активности ферментов к отрубям можно добавлять свекловичный жом, соевый шрот, крахмал, растительные отходы. Стерилизуют среду острым паром при помешивании (температура - 105-140 С, время 60-90 минут). После этого среду засевают и раскладывают ровным слоем в стерильных кюветах. Кюветы помещают в растильные камеры. Культивируют в течение 36-48 часов. Рост делится на три периода, примерно равных по времени. Сначала происходит набухание конидий и их прорастание (температура не ниже 28о С), затем рост мицелия в виде пушка серовато-белого цвета (необходимо выводить выделяемое тепло) и образование конидий. Для создания благоприятных условий роста и развития продуцента необходима аэрация и поддержание оптимальной влажности (55-70%). Выросшая в неподвижном слое при поверхностном культивировании культура представляет корж из набухших частиц среды, плотно связанных сросшимся мицелием. Массу размельчают до гранул 5-5 мм. Культуру высушивают до 10-12% влажности при температурах не выше 40оС, не долее 30 минут. Иногда препарат применяют прямо в неочищенном виде - в кожевенной и спиртовой промышленности. В пищевой и особенно медицинской промышленности используются ферменты только высокой степени очистки. Схема очистки сводится к следующему: - освобождение от нерастворимых веществ; - освобождение от сопутствующих растворимых веществ; - фракционирование (как правило, хроматографическими методами). Для выделения фермента из поверхностной культуры необходима экстракция. Как правило, экстраген - вода. При этом в раствор переходят сахара, продукты гидролиза пектиновых веществ и целлюлозы. Стадию выделения и очистки завершает сушка. После сушки препарат должен содержать не более 6-8% влаги, тогда он может в герметичной упаковке храниться до года без потери активности. Стандартизация ферментного препарата - доводка активности фермента до стандартной, соответствующей требованиям ГОСТ. Для этого используются различные нейтральные наполнители - крахмал, лактоза и др.
См. кривую роста Из всех продуктов, получаемых с помощью микробных процессов, наибольшее значение имеют вторичные метаболиты. Вторичные метаболиты, называемые также идиолитами, это низкомолекулярные соединения, не требующиеся для роста в чистой культуре. Они производятся ограниченным числом таксономических групп и часто представляют собой смесь близкородственных соединений, относящихся к одной и той же химической группе. К вторичным метаболитам относятся антибиотики, алкалоиды, гормоны роста растений и токсины. Рост микроорганизмов можно охарактеризовать как S - образную кривую. Первая стадия - стадия быстрого роста, или логарифмическая, для которой характерен синтез первичных метаболитов. Далее наступает фаза медленного роста, когда увеличение биомассы клеток резко замедляется. Микроорганизмы, производящие вторичные метаболиты, вначале проходят стадию быстрого роста, тропофазу, во время которой синтез вторичных веществ незначителен. По мере замедления роста из-за истощения одного или нескольких необходимых питательных веществ в культуральной среде микроорганизм переходит в идиофазу; именно в этот период синтезируются идиолиты. Идиолиты, или вторичные метаболиты, не играют явной роли в процессах метаболизма, они вырабатываются клетками для адаптации к условиям окружающей среды, например, для защиты. Их синтезируют не все микроорганизмы, а в основном нитчатые бактерии, грибы и спорообразующие бактерии. Таким образом, продуценты первичных и вторичных метаболитов относятся к разным таксономическим группам.
Известно, что активность ферментов сравнительно легко может быть уменьшена с помощью разнообразных воздействий. Такое снижение скорости ферментативных реакций принято называть торможением активности, или ингибированием ферментов. Когда конечный продукт какого-либо метаболического пути начинает накапливаться, он может действовать как аллостерический ингибитор на фермент, контролирующий первый этап этого пути. При этом снижается сродство данного фермента к его субстрату и соответственно уменьшается или вовсе приостанавливается дальнейшее образование самого конечного продукта. Это явление - ингибирование конечным продуктом. 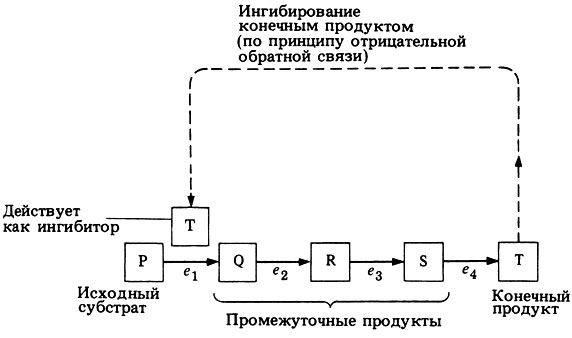
Получение биогаза, основным компонентом которого (до 80--85%) является метан, - сложный бактериальный процесс, протекающий в анаэробных условиях. В нем участвуют разнообразные по физиолого-биохимическим свойствам микроорганизмы. Венцом таких ассоциаций являются метаногены -- древнейшие представители так называемых архебактерий. Как и другие архебактерии, метаногены отличаются от остальных прокариот (эубактерий) составом ряда компонентов клеток, в том числе клеточной стенкой, не содержащей муреина, а также характером липидов, в которые не входят жирные кислоты. Большую часть нейтральных липидов составляют простые эфиры глицерина и длинноцепочечного спирта фитанола. В метаболизме метанобразующих бактерий участвует кофермент М (2-меркаптоэтансульфоновая кислота), фактор F420, представляющий собой особый флавин, и ряд других соединений, которые у остальных организмов не обнаружены или встречаются крайне редко. Но главное, что отличает метаногенов, как и других архебактерий, от остальных организмов, - это нуклеотидная последовательность в 16S рРНК, о чем свидетельствует изучение состава получаемых из нее олигонуклеотидов. Все метанобразующие бактерии - строгие анаэробы. Некоторые из них мезофилы, другие, растущие при 60 - 80 °С и более высокой температуре, термофилы. К числу термофилов относится, например, М. thermoautotrophicum. Оптимальное значение рН для роста разных видов 6,5 - 8,0. Некоторые штаммы способны расти при наличии в среде до 5 - 7 % и более NaCl. Как источник серы бактерии чаще всего используют сульфид, а как источник азота - аммоний. Некоторые виды нуждаются для роста в наличии дрожжевого автолизата или смеси витаминов. Известны также метанобразующие бактерии, для роста которых необходимо присутствие ацетата и (или) других органических веществ. Но довольно многие из этих микроорганизмов могут расти в автотрофных условиях (при наличии в качестве единственного источника углерода углекислоты). Ассимиляция углекислоты в автотрофных условиях, как показано для М. thermoautotrophicum, происходит особым нециклическим путем. Началом его является образование из углекислоты С2-соединения в виде ацетил-кофермента А (КоА). Дальнейшее превращение ацетил-КоА включает следующие реакции: ацетил-Ко > пируват > фосфоенолпируват > оксалоацетат > малат > фумарат > сукцинат > сукцинил-КоА > б-кетоглутарат. Образующиеся пируват, оксалоацетат, 2-кетоглутарат используются частично для синтеза аминокислот, а фосфоенолпируват - углеводов. Субстратами, из которых большинство известных видов метаногенов образуют метан, служат молекулярный водород и углекислота: Ряд видов синтезируют метан из окиси углерода: Некоторые виды образуют метан из муравьиной кислоты. Известны метанобразующие бактерии, образующие метан из метанола, метиламина, диметиламина, триметиламина и (или) ацетата: При превращении метилированных аминов, метанола и ацетата в метан в него переходит метильная группа субстрата. Технологически метановое брожение подразделяют на два этапа: созревание метанового биоценоза и ферментацию. В течение первого этапа развиваются бактерии, участвующие в анаэробном разложении исходных органических веществ и продуктов их распада. В результате деятельности этих микроорганизмов создаются оптимальные условия для активного биосинтеза метана. Несмотря на сложность и далеко неполную изученность, такая биологическая система достаточно надежна и проста для получения биогаза в промышленных масштабах. Метановое брожение жидких органических веществ осуществляется в строго анаэробных условиях при 30 - 40 °С (мезофильный процесс) или 52 - 60 °С (термофильный процесс). Ферментацию проводят в реакторах (метантенках) объемом от одного до нескольких тысяч кубических метров. Метантенки выполняются из железобетона или металла. Они могут иметь разную форму и конструкцию, от кубической до цилиндрической, расположены горизонтально или вертикально. Лучшей признается яйцеобразная конструкция. Ферментация протекает непрерывно, полупериодически и периодически
Обобщённая схема производства ферментных препаратов при глубинном способе культивирования производственной культуры продуцента. Условно можно выделить три этапа: подготовительный этап (стерилизация оборудования, приготовление среды для культивирования, её стерилизация, подготовка культуры продуцента, инокулирование среды, очистка воздуха), этап получения производственной культуры (ферментация) и получение ферментных препаратов с заданными характеристиками. При сравнении производств ферментативных препаратов, получаемых глубинным способ культивирования, можно отметить, что схемы отличаются в основном на первом и завершающем этапах. Это связано с использованием различных продуцентов и требуемыми качествами ферментативных препаратов. Также можно отметить различные пути использования нерастворимых остатков после этапа производственного культивирования. Он может использоваться для получения биошрота, поступать на культивирование в качестве инокулята или, после соответствующей обработки, входить в состав среды. Этот способ имеет ряд очевидных преимуществ перед поверхностным, так как позволяет значительно сократить производственные площади, исключить тяжелый непроизводительный ручной труд, улучшить гигиену труда, упрощает механизацию и автоматизацию производства, делает возможным переход на непрерывный способ культивирования. При глубинном способе культивирования более рационально используются питательные вещества сред, что дает возможность значительно сократить отходы производства в виде нерастворимых осадков твердой питательной среды, получать препараты ферментов с меньшим содержанием примесей и большей удельной активностью. Глубинное культивирование проводят в вертикальных емкостях различного размера, называемых ферментаторами. Основное требование к ферментатору - возможность проведения процесса культивирования продуцента в асептических условиях при интенсивном аэрировании среды. В процессе культивирования приходится иметь дело со сложной трехфазной системой жидкость - твердая взвесь - газ. В такой системе затруднены массообменные процессы, и поэтому усложняется аппаратурное оформление всей стадии выращивания.
Регуляторы ферментов, регулируют активность ферментов или скорость их биосинтеза. Универсальными регуляторами активности ферментов являются субстраты вещества, которые претерпевают превращения в реакциях, катализируемых ферментами. Репрессия конечным продуктом. Все биосинтетические пути находятся под контролем механизма репрессии конечным продуктом. Точно так же образование большинства анаболических ферментов регулируется путем репрессии их синтеза. Репрессия осуществляется особыми присутствующими в клетке веществами — репрессорами. Факторами, модифицирующими активность репрессоров, могут быть конечные продукты биосинтетических путей, а также промежуточные продукты некоторых катаболических или амфиболических путей. Репрессия может быть координированной, т. е. синтез каждого фермента данного пути в одинаковой степени подавляется конечным продуктом. Часто синтез ферментов одного пути репрессируется в разной степени. В разветвленных биосинтетических путях механизмы репрессии могут быть модифицированы (как и механизмы ингибирования), чтобы лучше обеспечить регуляцию нескольких конечных продуктов из общего исходного субстрата. Синтез многих ферментов в таких путях репрессируется только при совместном действии всех конечных продуктов. Если реакция на общем участке разветвленного пути катализируется изоферментами, синтез каждого из них находится под контролем "своего" конечного продукта. Механизм репрессии конечным продуктом на уровне транскрипции стал проясняться с 50-х гг. Большой вклад в это внесли работы Ф. Жакоба и Ж. Моно. Было показано, что наряду со структурными генами, кодирующими синтез ферментов, в бактериальном геноме существуют специальные регуляторные гены. Один из них — ген-регулятор (ген R), функция которого заключается в регуляции процесса транскрипции структурного гена (или генов). Ген-регулятор кодирует синтез специфического аллостерического белка-репрессора, имеющего два центра связывания: один узнает определенную последовательность нуклеотидов на участке ДНК, называемом оператором (ген О), другой — взаимодействует с эффектором. Ген-оператор расположен рядом со структурным геном (генами) и служит местом связывания репрессора. В отличие от операторных генов гены-регуляторы расположены на некотором расстоянии от структурных генов (продукты регулярных генов — репрессоры являются свободно диффундирующими белковыми молекулами). Часто структурные гены, относящиеся к одному биохимическому пути, объединены в группу, составляющую вместе с оператором единицу транскрипции и регуляции — оперон. Все структурные гены, объединенные в оперон, имеют один операторный участок, локализованной на краю оперона, и координирование регулируются одним репрессором. Оперон представляет собой весьма рациональную и эффективную систему регуляции метаболического пути. Индукция синтеза ферментов. В большинстве случаев регуляция путем индукции характерна для катаболических путей, где в качестве индукторов выступают обычно субстраты этих путей. Классический пример индуцибельного фермента — (3-галактозидаза Е. coli. Оказалось, что если клетки Е. coli выращивать в среде, содержащей глюкозу, то они не могут использовать лактозу. Если такие клетки поместить в среду, где лактоза — единственный источник углерода, после некоторого периода в них происходит интенсивный синтез фермента (3-галактозидазы, катализирующего гидролиз лактозы на D-глюкозу и D-галактозу. С помощью этого фермента Е. coli может теперь использовать лактозу в качестве единственного источника углерода. Если затем клетки, растущие на среде с лактозой, перенести на среду с глюкозой, синтез (3-галактозидазы прекращается. Изучение индукции (3-галактозидазы у Е. coli позволило установить, что рост клеток на среде с лактозой происходит не в результате отбора мутантов, у которых способность использовать лактозу есть следствие мутации. Способностью синтезировать этот фермент обладают все клетки. Было также показано, что в процессе индукции происходит не активирование уже имеющегося в клетках фермента (З-галактозидазы, а его синтез de novo из аминокислот. |
