пцукпцук. Введение в биохимию. Химическое строение, классификации и функции аминокислот. Физикохимические свойства белков. Структура белковой молекулы. Количественное определение белков. Определение
 Скачать 186 Kb. Скачать 186 Kb.
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Компонент | Доля массы клетки, % | Число молекул на клетку | Число видов молекул |
| Неорганические компоненты клетки | |||
| Вода | 70 | 4×1010 | 1 |
| Неорганические ионы | 1,0 | 2,5×108 | 20 |
| Низкомолекулярные метаболиты и биорегуляторы | |||
| Моносахариды и производные | 1,0 | 2,0×108 | 250 |
| Аминокислоты и их производные | 0,4 | 3,0×107 | 100 |
| Нуклеотиды и производные | 0,4 | 1,2×107 | 100 |
| Липиды | 1,0 | 2,5×107 | 50 |
| Другие низкомолекулярные соединения | 0,2 | 1,5×107 | 300 |
| Биополимеры | |||
| Белки | 15 | 1,0×106 | 3000 |
| РНК | 6 | 3,0×104 | 1000 |
| ДНК | 1 | 4 | 1 |
| Полисахариды | 2 | 3,9×104 | 50 |
| Фосфолипиды мембран | 2 | - | 40 |
| Всего | 100 | - | 3000 |
В пересчете на сухую массу в организме человека содержится С -50%, О – 20%, Н – 10%, N – 8,5%, Са – 4%, P – 2,5%, K – 1%, S – 0,8%, Na – 0,4%, Cl – 0,4%, Mg – 0,1%, Fe – 0,01%, Mn – 0,001%, J -0,00005%. При недостатке йода и фтора в воде и пище возникают гипотиреоз (эндемический зоб) и кариес зубов. При недостатке железа – железодефицитная анемия.
Элементы-органогены (С, О, N, H, P, S) образуют две группы органических веществ живых организмов – биополимеры и низкомолекулярные биорегуляторы.
По химическому составу тело человека и животных включает 5 основных классов веществ (для человека массой 65 кг): 1) белки 11 кг (17%); 2) жиры 9 кг (13,8%); 3) углеводы 1 кг (1,5%); 4) вода 40 кг (61,6%); 5) минералы 4 кг (6,1%).
В составе организмов присутствуют карбоновые кислоты, углеводороды, амины, спирты, альдегиды. В отдельные группы должны быть выделены вещества, присутствующие в тканях живых организмов в небольших количествах, но играющих первостепенную роль в регуляции обмена веществ: пептиды, гормоны, витамины, простагландины, кинины, нуклеарные регуляторные факторы и др.
Белки являются основными биополимерами клеток, за счет которых осуществляются практически все функции организма. Термин “белок” происходит от немецкого слова “Eiwei“, что означает яичный белок или вообще белок. Другое название - протеины, происходит от греческого слова “протос” - первичный.
Белки являются линейными неразветвленными полимерами построенными из аминокислот.. Информация о структуре белка закодирована в ДНК. Все живые организмы используют 20 идентичных аминокислот и, за некоторым исключением, имеют одинаковый генетический код.
Белки преимущественно состоят из 5 главных элементов: С – 50-55%, Н – 6-7,3%, О – 19-24%, N – 13-19%, S – 0-4%. Кроме вышеперечисленных, белки могут содержать также другие элементы, такие как P, Fe, Cu, I, Mg, Zn и др. В большинстве белков имеется постоянное содержание азота, равное 16%. Поэтому количество белков иногда выражают через азот: количество белка = содержание азота × 6,25. Различные ткани отличаются по содержанию белков. В пересчете на сухую массу в селезенке 84%, в легких 82%, в мышцах 80%, а в костях 24-28% белков.
Белки относятся к высокомолекулярным соединениям, в состав которых входят сотни и даже тысячи аминокислотных остатков. Молекулярная масса белков колеблется от 6000 до 1000000 Да и выше в зависимости от количества отдельных полипептидных цепей в составе единой молекулярной структуры белка. Молекулярная масса пептидов меньше 6000 Да.
Для определения молекулярной массы белков используют следующие методы.
1. Химический метод требует точного знания количественного содержания аминокислоты в белке. Например, в простом белке содержится 0,6% триптофана с молекулярной массой 204. Тогда М.м. белка = 204×100/0,6= 34 000 Да. Применение ограничено.
1 Да (дальтон) весьма близок к массе атома водорода. 1000 Да = 1 кДа (килодальтон).
2. Электронная микроскопия. Точная навеска окрашивается осмиевой кислотой и подсчитывается количество частиц. Делят навеску на число частиц и находят массу одной молекулы.
3. Метод ультрацентрифугирования. В пробирке ультрацентрифуги создается центробежное ускорение, превышающее земное притяжение до 500000g. По мере перемещения молекул белка в таком центробежном поле они разделяются по молекулярной массе. При этом образуются границы белок-растворитель, которые регистрируют и рассчитывают скорость их перемещения. Вначале вычисляют константу седиментации белка (S), которая зависит от массы и формы белковой молекулы
ν – скорость перемещения границы белок-растворитель; ω – угловая скорость ротора (рад/с); r – расстояние от центра ротора до середины пробирки с раствором белка, см. Константа седиментации имеет размерность времени (ее выражают в секундах). Величина константы седиментации, равная 1∙10-13 с принята за единицу и названа Cведбергом (S).
Величина молекулярной массы вычисляется по уравнению Сведберга.
где R – газовая постоянная, эрг/(моль·град); Т – абсолютная температура (по шкале Кельвина); S – константа седиментации; ρ – плотность растворителя; ϋ – парциальный удельный объем молекулы белка; D – коэффициент диффузии.
4. Гель-фильтрация и диск-электрофорез. Калибруют колонку, заполненную стандартными гранулами сефадекса (учитывается расстояние между гранулами и величина пор в гранулах), белками с известной молекулярной массой (рис. 2.2). Находят зависимость между элюционным объемом (Vэ) и молекулярной массой. Чем меньше молекулярная масса, тем больше элюционный объем (т.е. объем растворителя, с которым белок выходит из колонки).
Через калиброванную колонку пропускают неизвестный белок, определяют его элюционный объем и по калибровочному графику определяют молекулярную массу. В методе диск-электрофореза сравнивают не элюционные объемы, а электрофоретическую подвижность белков.

 VэА А
VэА А VэВ В
VэВ В VэС С
lg молекулярной массы
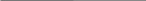 М.м. А М.м. В М.м.С
М.м. А М.м. В М.м.С Рис. 2.2. Калибровка хроматографической колонки
В настоящее время для определения молекулярной массы нативного (находящегося в структурном состоянии для выполнения функции) белка используют методы гельхроматографии или аналитического ультрацентрифугирования. Сочетание обоих подходов позволяет оценить как молекулярную массу белка, так и его протомеров. Однако эти методы не годны для решения современных задач протеомики. Точное определение массы белковых молекул осуществляется методом масс-спектрометрии после разделения белков методом изоэлектрофокусирования с последующим двумерным электрофорезом в полиакриламидном геле.
Различают 2 группы: простые и сложные (конъюгированные).
1. Простые белки (альбумин, кератин и др.) состоят только из аминокислот и делятся на:
а) фибриллярные белки имеют палочкообразную вытянутую форму, нерастворимы в воде и физически прочные (отношение длины молекулы к диаметру больше 10); они выполняют структурные и защитные функции;
б) глобулярные белки представляют собой компактные сферические молекулы, водорастворимы (отношение длины молекулы к диаметру не превышает 4); глобулярные белки выполняют динамические функции (ферменты, иммуноглобулины и транспортные белки гемоглобин и альбумины).
2. Сложные (конъюгированные) белки состоят из простого белка комбинированного с небелковым компонентом. Небелковая часть называется простетической группой (или конъюгированной группой). Белок без простетической группы называется апопротеином. Белковая часть с простетической группой называется холопротеином. Простетическая группа играет ключевую роль в функционировании белка.
Пищевая ценность белков определяется наличием незаменимых аминокислот. Согласно этой классификации белки делятся на 3 группы:
1. Полноценные белки – содержат 10 незаменимых аминокислот в необходимых пропорциях для обеспечения нормального роста (например, яичный белок, казеин молока).
2. Частично полноценные белки. Эти белки содержат сниженное количество одной или более незаменимых аминокислот и могут обеспечивать только умеренный рост (например, белок пшеницы и риса содержат недостаточное количество лизина, триптофана). Известно правило, что скорость синтеза белка зависит от незаменимой аминокислоты, концентрация которой наименьшая.
3. Неполноценные белки. Эти белки не содержат одну или более незаменимых аминокислот. Не могут обеспечить нормальный рост организма (например, желатин не содержит аминокислоту триптофан).
Аминокислоты являются структурной единицей белков. Аминокислоты содержат аминогруппу (-NH2), карбоксильную группу (-СООН), атом водорода и боковую цепь, связанную с α-углеродным атомом. Одна из 20 аминокислот, пролин, является, иминокислотой (-NH-), остальные 19 являются α-аминокислотами.
В природе выявлено около 300 аминокислот. Из них 20 являются стандартными (протеиногенными) аминокислотами, которые обнаружены в структуре белков, полученных из различных организмов – животных, растений и микроорганизмов. Это - результат универсальной природы генетического кода, обеспечивающей включение 20 аминокислот при биосинтезе белков.
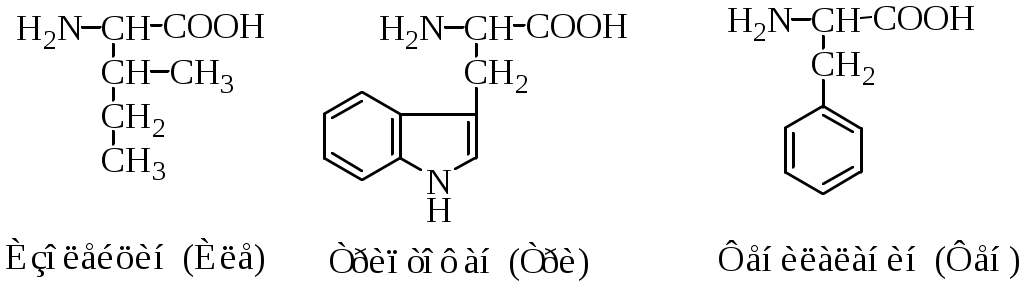
Классификация протеиногенных аминокислот по строению радикала: 1) алифатические (глицин, аланин, валин, лейцин, изолейцин, метионин, пролин; 2) ароматические (фенилаланин, тирозин, триптофан; 3) алифатические, содержащие гидроксильную группу (серин, треонин); 4) алифатические, содержащие сульфгидрильную группу (цистеин); 5) основные (лизин, аргинин, гистидин); 6) кислые (аспарагиновая и глутаминовая кислоты); 7) алифатические, содержащие карбоксамидную группу (аспарагин, глутамин).
Аминокислотные остатки в полипептидной цепи имеют сокращенные названия: аланин (ала, А), глицин (гли, G), валин (вал, V), лейцин (лей, L), изолейцин (иле, I), аспарагиновая кислота (асп, D), глутаминовая кислота (глу, E), серин (сер, S), треонин (тре, Т), цистеин (цис, С), метионин (мет, М), аргинин (арг, R), лизин (лиз, K), гистидин (гис, Н), пролин (про, P), фенилаланин (фен, F), тирозин (тир, Y), триптофан (три, W), аспарагин (асн, N), глутамин (глн, Q).
Существует несколько специальных классификаций аминокислот, основанные на структуре и химической природе, заменимости, путях метаболизма и т.д.
Классификация аминокислот по полярности радикалов
1. Неполярные аминокислоты (аланин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан, пролин). Эти аминокислоты гидрофобны. Имеют незаряженный радикал. При сближении в пространстве радикалы этих аминокислот обеспечивают гидрофобное взаимодействие.
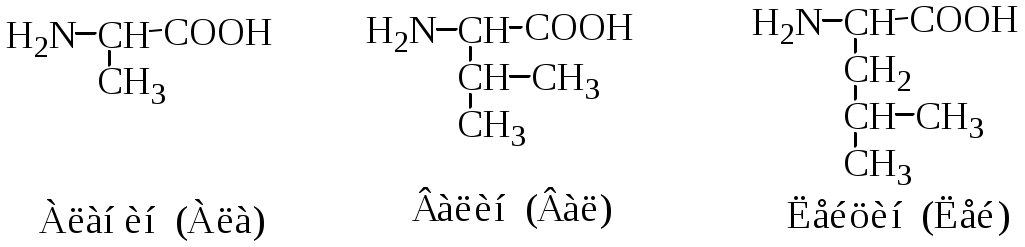
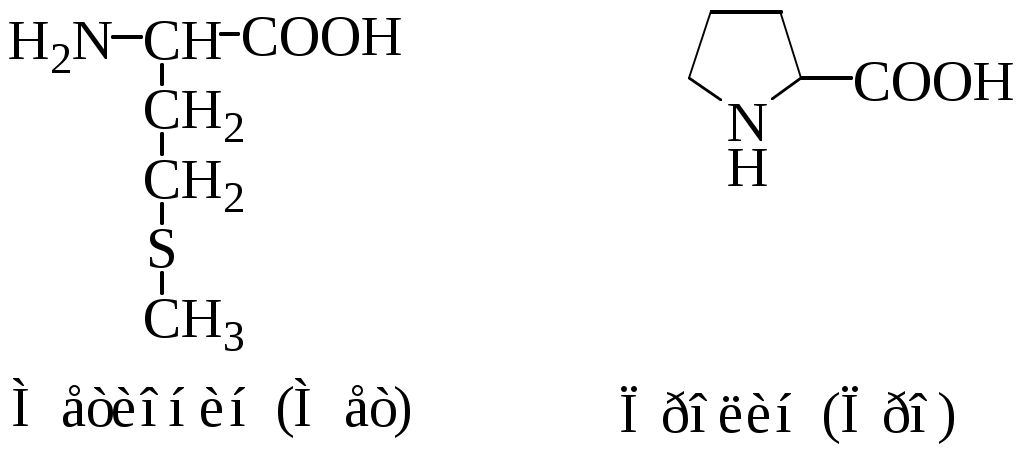
2. Полярные, гидрофильные, незаряженные аминокислоты (глицин, треонин, цистеин, тирозин, серин, аспарагин, глутамин). Содержат такие полярные функциональные группы как гидроксильная, сульфгидрильная и амидогруппа. При сближении в пространстве радикалы этих аминокислот образуют водородные связи. Связанные дисульфидной связью два остатка цистеина называют цистином.
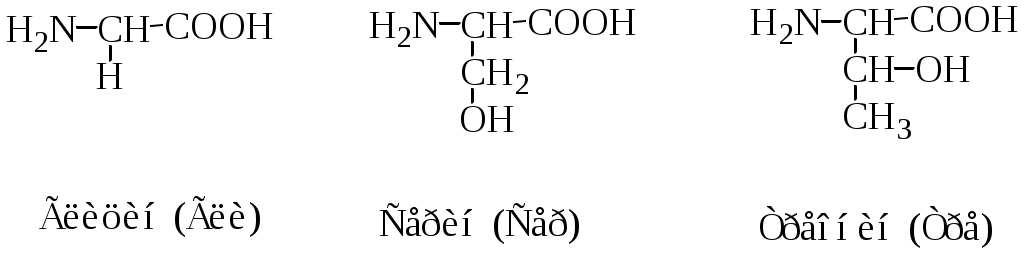
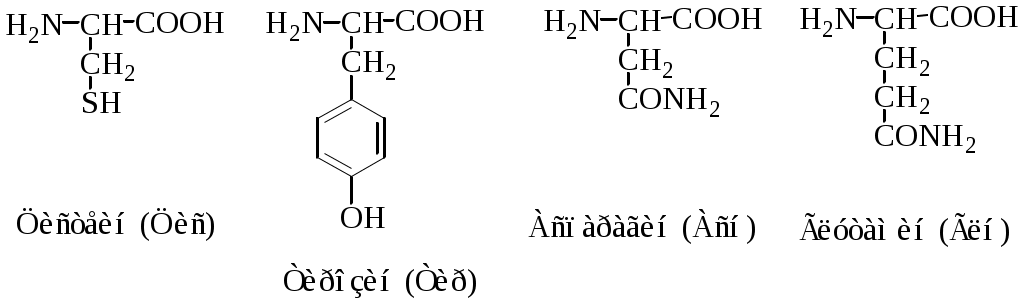
3. Кислые аминокислоты (отрицательно заряженные аминокислоты) имеют отрицательный заряд (аспарагиновая и глутаминовая кислоты) при рН 7,0
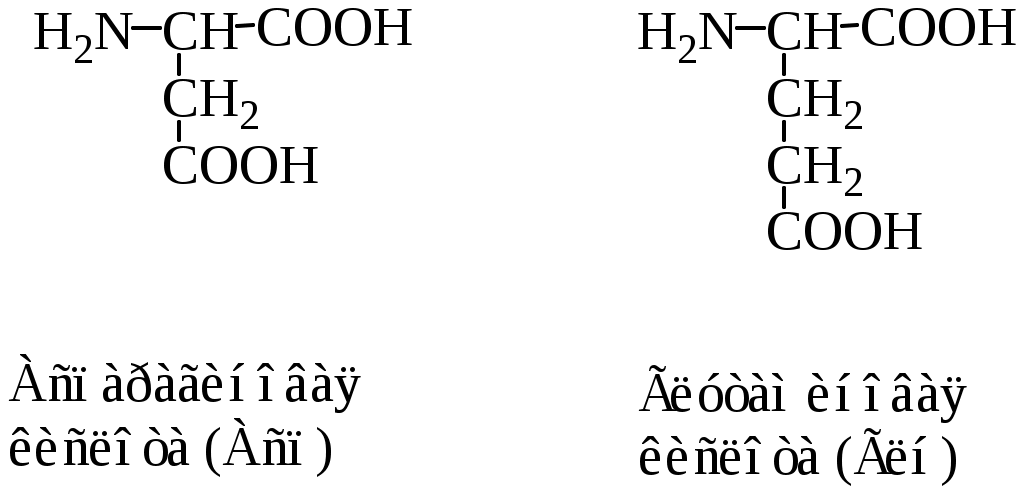
4. Основные аминокислоты (положительно заряженные аминокислоты) имеют положительный заряд при рН 7,0.
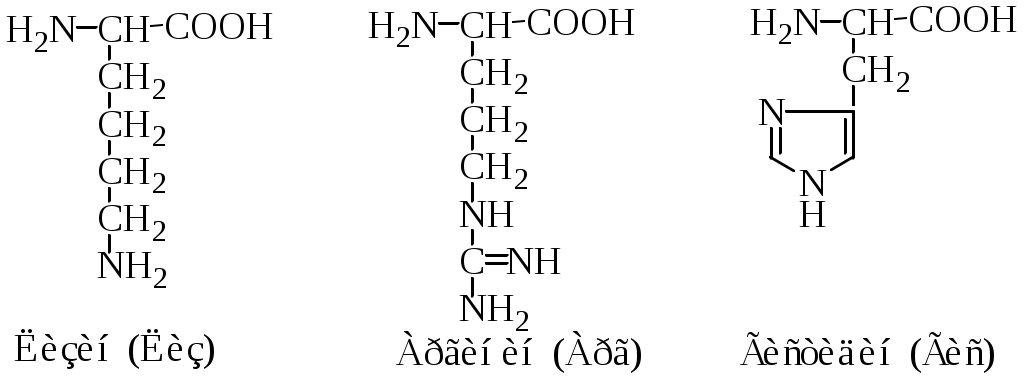
Радикалы аминокислот 3 и 4 групп участвуют в образовании ионных связей.
Аминокислоты классифицируются на заменимые и незаменимые (эссенциальные).
1. Незаменимые (эссенциальные) аминокислоты не могут синтезироваться в организме и должны поступать с пищей. Они необходимы для обеспечения и поддержания роста: аргинин, валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин (шесть аминокислот 1-й группы, одна – второй и три – четвертой).
2. Заменимые аминокислоты. Организм может синтезировать около 10 аминокислот для обеспечения биологических потребностей, поэтому поступление их с пищей не обязательно (аланин, аспарагин, аспарагиновая кислота, цистеин, глутаминовая кислота, глутамин, глицин, пролин, серин, тирозин).
Аминокислоты, связанные пептидной связью, образуют полипептидную цепь и каждая аминокислота в ней называется аминокислотный остаток. В полипептиде выделяют N-конец (терминальная альфа-аминогруппа) и С-конец (терминальная альфа-карбоксильная группа). Большинство природных полипептидных цепей, содержащих от 50 до 2000 аминокислотных остатков, называют белками (протеинами). Полипептидные цепи меньшей длины называют олигопептидами или просто пептидами. В некоторых белках полипептидные цепи связываются поперечными дисульфидными связями, образованными окислением двух остатков цистеина. Внеклеточные белки часто содержат дисульфидные связи, а внутриклеточные белки часто утрачивают их. В некоторых белках образуются поперечные связи при взаимодействии радикалов других аминокислотных остатков (коллаген, фибрин).
Физико-химические свойства белков
1. Растворимость. Белки формируют коллоидные растворы, что обусловлено размером частиц (размеры частиц 0,1-0,001 мкм). Для растворов белков характерны следующие характеристики: низкое осмотическое давление, высокая вязкость, низкая способность к диффузии. В лабораторной практике используют 2 свойства коллоидных растворов белков: нефелометрическое определение количества белка на основе эффекта Тиндаля; диализ – очистка белков от низкомолекулярных примесей.
2. Амфотерность белков. Белки обладают кислыми и основными свойствами из-за присутствия карбоксильных и аминогрупп. Изоэлектрическая точка белков (pI) – значение рН, при котором суммарный заряд белка равен нулю. В pI белок электронейтрален с минимальной растворимостью, максимальной преципитацией и наименьшей буферной способностью. Изоэлектрическая точка определяется количеством NH2 и СООН групп в молекуле белка. Если количество NH2 и СООН групп равны, рI лежит в слабокислой среде (ионизация карбоксильных групп несколько выше, чем аминных) при рН≤7. Если количество NH2>СООН, то pI лежит в щелочной среде. Если количество NH2<СООН, то pI лежит в кислой среде. При рН>pI заряд белка всегда отрицательный, так как карбоксильные группы переходят в форму СОО-, а аминные группы в форму NH2. При рН<рI заряд белка положительный, т.к. при уменьшении рН все больше аминогрупп переходит в форму NH3+, а диссоциация карбоксильных групп подавляется.
3. Способность к осаждению (преципитации). Существуют два фактора устойчивости белков в коллоидном растворе: заряд и гидратная оболочка. Белки могут быть преципитированы путем дегидратации и/или нейтрализации полярных групп.
Преципитация в рI. Белки мало растворимы в изоэлектрической точке. Например, белок молока казеин сворачивается, если молоко кислое. Это объясняется тем, что молочная кислота, образуемая бактериями, снижает рН, приближая его к изоэлектрической точке казеина (pI= 4,6).
Высаливание. Процесс преципитации добавлением нейтральных солей (сульфата аммония или сульфата натрия) называется высаливанием. Этот процесс объясняется дегидратацией молекул белков солями, что приводит к молекулярной агрегации и преципитации. Количество соли, необходимой для преципитации, зависит от молекулярной массы белка. Чем больше молекулярная масса белка, тем меньше соли необходимо для преципитации. Например, глобулины сыворотке осаждаются полунасыщенным раствором сульфата аммония, в то время как альбумин – насыщенным раствором. Высаливание используется для разделения белков сыворотки крови.
Добавление незначительного количества нейтральных солей повышает растворимость белков.
Осаждение солями тяжелых металлов. Ионы тяжелых металлов (Pb2+, Hg2+, Fe2+, Zn2+, Cd2+) вызывают осаждение белков. Металлы имеют положительный заряд и в щелочной среде вызывают преципитацию белков.
Осаждение анионами или алкалоидными реактивами. Белки осаждаются трихлоруксусной кислотой, сульфосалициловой кислотой, пикриновой кислотой, таниновой кислотой. Белки являются катионами и добавление анионов кислот приводит к образованию комплексов белок-анион.
4. Электрофорез белков. В методе электрофореза белков сыворотки используют слабощелочные буферные растворы (т.е. рН>pI), чаще рН 8,6. При этом белки заряжаются отрицательно и перемещаются к аноду. Подвижность заряженной молекулы в электрическом поле называют электрофоретической подвижностью μ. Этотпоказательдля сферической молекулы рассчитывают μ=Q/6πηr×V, где Q – суммарный заряд молекулы, r – радиус молекулы, η – вязкость жидкой среды, в которой движется заряженная частица, V – приложенное напряжение. Принято, что в среде с постоянной вязкостью и напряжением движение заряженной частицы определяется величиной отношения заряда к радиусу частицы. С увеличением этого отношения подвижность частиц растет. Если частицы близки по радиусу, то их электрофоретическая подвижность будет пропорциональна заряду. Величина μ растет с повышением значения Q.
Изоэлектрическое фокусирование. Метод основан на том, что в изоэлектрической точке белок теряет заряд и теряет подвижность в электрическом поле. Трубку с гелем заполняют амфолинами, создающими градиент рН. В электрическом поле белок будет передвигаться до того значения, где он войдет в свое изоэлектрическое состояние и, потеряв заряд, остановится.
Наибольшее распространение и развитие получил метод электрофореза в полиакриламидном геле.
Наибольшие успехи в изучении заряженных молекул получены с помощью метода электрофореза. В этом методе заряженные частицы распределяются в электрическом поле в зависимости от заряда. Электрофорез может производиться в буферном растворе с регистрацией границы между фракцией белка и буферным раствором (капиллярный электрофорез) или на носителях. Для изучения белков чаще используют электрофорез в полиакриламидном геле (рисунок.2.4).
Электрофорез в присутствии додецилсульфата натрия (SDS-PAGE) обладает высокой разрешающей способностью, а именно, используя краситель Кумасси голубой, можно выявить 0,1 мкг (2 пмоль) белка, а при серебрении – чувствительность повышается в 5 раз (выявление 0,02 мкг белка). При доступной технике SDS-PAGE удается разделить белки, отличающиеся только на 2% по молекулярной массе (например, белки с молекулярными массами 40 и 41 кДа, имеющие различие только по 10 аминокислотным остаткам полипептидных цепей).
Изоэлектрическое фокусирование позволяет разделить белки, отличающиеся по изоэлектрической точке только на 0,01. Комбинация изоэлектрического фокусирования с SDS-PAGE дает весьма чувствительный метод разделения белков - двумерный электрофорез (Two-DimensionalElectrophoresis). Этот способ разделения белков использовался при рождении протеомики. По этому способу 1) производят в горизонтальном направлении разделение белков методом изоэлектрического фокусирования (по рI), а затем 2) в вертикальном направлении производят двумерный электрофорез разделившихся белков методом SDS-PAGE (по молекулярной массе).
Структура белковой молекулы
Первичная структура белка – линейная специфическая последовательность аминокислот, соединенных между собой пептидными связями. Пептиды и полипептиды состоят менее чем из 50 аминокислот, белки содержат более 50 аминокислот в пептидной цепи.
Пептидные связи (пептидные группы) образуются между -аминогруппой одной аминокислоты и -карбоксильной группой другой аминокислоты. При образовании пептидной связи выделяется молекула воды. Процесс образования пептидной связи является эндергоничным, т.е. требует затраты энергии.
Характеристика пептидной связи
Копланарность – все атомы, входящие в пептидную группу, находятся в одной плоскости (рис. 3.1.).
Атом водорода аминогруппы и атом кислорода карбонильной группы находятся в транс-положении.
Связь между атомом углерода карбонильной группы и атомом азота имеет частично двойной характер из-за p,-сопряжения (сопряжение свободной пары электронов атома азота с -электронами двойной связи С=О). Поэтому свободное вращение вокруг пептидной связи невозможно.
4. Пептидная связь является ковалентной и стабильной связью. Разрушение пептидной связи возможно только в присутствии катализаторов.
Роль первичной структуры
Последовательность аминокислот в первичной структуре белка определяет специфичность белка.
Первичная структура генетически детерминирована и воспроизводится в процессе транскрипции и трансляции.
Первичная структура белка является основойдля формирования последующих структур белка за счет взаимодействия радикалов аминокислотных остатков полипептидной цепи.
Замена аминокислоты L-ряда на аминокислоту D-ряда может привести к полному исчезновению биологической активности пептида.
Принято чтение последовательности аминокислотных остатков в полипептидной цепи начинать с N-конца. В пентапептиде ала-гли-глу-фен-лей (АGЕFL) аланин является N-концевым остатком, а лейцин – С-концевым остатком аминокислот. При наименовании пептидов суффиксы –ин (аланин), -ан (триптофан) и –ат (глутамат) заменяются на –ил, за исключением последней аминокислоты.
Вторичная структура – регулярная организация полипептидной цепи в виде упорядоченной структуры, стабилизируемой водородными связями, которые образуются между NH- и СО-группами пептидных групп.
Вторичная структура определяется первичной структурой. Поскольку первичная структура генетически детерминирована, формирование вторичной структуры может происходить при выходе полипептидной цепи из рибосомы. Различают -спираль, -структуру и неупорядоченную конформацию (клубок).
-Спираль. Структура α-спирали была предложена Л. Полингом и Р. Кори (1951). Это разновидность вторичной структуры белка, имеющая вид регулярной спирали (рис. 3.2). α-Спираль – это палочкообразная структура, в которой пептидные связи расположены внутри спирали, а боковые радикалы аминокислот – снаружи.
-Спираль стабилизирована водородными связями, которые параллельны оси спирали и возникают между первым и пятым аминокислотными остатками. Таким образом, в протяженных спиральных участках каждый аминокислотный остаток принимает участие в формировании двух водородных связей.
На один виток спирали приходится 3,6 аминокислотных остатка, шаг спирали 0,54 нм, на один аминокислотный остаток приходится 0,15 нм. Угол подъема спирали 26. Период регулярности -спирали равен 5 виткам или 18 аминокислотным остаткам. Наиболее распространены правые -спирали, т.е. закручивание спирали идет по часовой стрелке. Образованию -спирали препятствует пролин, аминокислоты с заряженным и объемными радикалами (электростатическое и механическое препятствие).
Для решения задач: средняя молекулярная масса аминокислоты 110 Да, размер аминокислотного остатка в полипептидной цепи 0,15 нм
Другая форма спирали присутствует в коллагене. В организме млекопитающих коллаген – преобладающий в количественном отношении белок: он составляет 25% общего белка. Коллаген присутствует в различных формах, прежде всего, в соединительной ткани. Это левая спираль с шагом 0,96 нм и 3,3 остатка в каждом витке, более пологая по сравнению с α-спиралью. В отличие от α-спирали образование водородных мостиков здесь невозможно. Коллаген имеет необычный аминокислотный состав: 1/3 составляет глицин, примерно 10% пролин, а также гидроксипролин и гидроксилизин. Последние две аминокислоты образуются после биосинтеза коллагена путем посттрансляционной модификации. В структуре коллагена постоянно повторяется триплет гли-X-Y, причем положение Х часто занимает пролин, а Y – гидроксилизин. Имеются веские основания тому, что коллаген повсеместно присутствует в виде правой тройной спирали, скрученной из трех первичных левых спиралей. В тройной спирали каждый третий остаток оказывается в центре, где по стерическим причинам помещается только глицин. Вся молекула коллаген имеет длину около 300 нм.
-структура(-складчатый слой). Встречается в глобулярных белках, а также в некоторых фибриллярных белках, например, фиброин шелка. Структура имеет плоскую форму. Полипептидные цепи почти полностью вытянуты, а не туго скручены, как в -спирали. Плоскости пептидных связей расположены в пространстве подобно равномерным складкам листа бумаги. Стабилизируется водородными связями между СО- и NH-группами пептидных групп соседних полипептидных цепей. Эти водородные связи перпендикулярны оси молекулы. Если полипептидные цепи, образующие -структуру идут в одном направлении (т.е. совпадают С- и N-концы) – параллельная -структура; если в противоположном – антипараллельная -структура. Боковые радикалы одного слоя помещаются между боковыми радикалами другого слоя. Если одна полипептидная цепь изгибается и идет параллельно себе, то это антипараллельная -кросс-структура. Водородные связи в -кросс-структуре образуются между пептидными группами петель полипептидной цепи.
Доказано, что образованию α-спирали чаще всего способствуют глу, ала, лей, а β-структуры – вал, иле, фен; в местах изгиба полипептидной цепи – гли, про, асп. Следовательно, характер вторичной структуры зависит от аминокислотного состава сегмента первичной структуры.
Простые α-спиральные структуры обычно длиной не более 4,5 нм, но устойчивыми являются более длинные структуры – 100 нм и более (миозин и тропомиозин в мышцах, фибрин кровяного сгустка, кератин волос).
Третичная структура - способ укладки полипептидной цепи в трехмерном пространстве. Третичная структура стабилизируется связями между боковыми радикалами аминокислот. К ним относятся ковалентная (дисульфидная) и нековалентные (водородная, ионная связи и гидрофобное взаимодействие). По форме третичной структуры белки делятся на глобулярные и фибриллярные. Глобулярные белки имеют эллипсовидную форму, а фибриллярные – нитевидную, вытянутую форму (форма палочки, веретена). При образовании глобулярных белков гидрофобная часть полипептидной цепи располагается внутри структуры, а гидрофильная – снаружи.
Многие белки в третичной структуре имеют спирализованные, складчатые и неупорядоченные сегменты. При этом в функциональном и структурном отношениях важно взаимное расположение аминокислотных радикалов.
Домены – анатомически выделяемые участки третичной структуры белка, отвечающие за выполнение определенной функции белка.
Гидрофобные карманы – полости в третичной структуре, выстланные радикалами гидрофобных аминокислот и необходимы для погружения в молекулу белка гидрофобных лигандов.
Гидрофобные кластеры – участки поверхности белка, где сконцентрированы радикалы гидрофобных аминокислот и служат для взаимодействия с гидрофобными кластерами других молекул.
Каждый белок в нативном состоянии имеет уникальную трехмерную структуру (конформация белка), в которой белок выполняет функцию.
Белок приобретает нативную структуру для выполнения функции путем складывания полипептидной цепи.
Денатурация – разрушение третичной и частично вторичной структуры белка с сохранением первичной структуры, т.е. потеря нативной структуры. Денатурация отличается от гидролиза белка тем, что при гидролизе необратимо разрушается первичная структура путем разрыва пептидных связей.
1. В зависимости от степени денатурации потеря биологической активности может быть частичной или полной.
2. При денатурации изменяются физические свойства белка, например, снижается растворимость и белок выпадает в осадок, поскольку теряются основные факторы устойчивости – заряд и гидратная оболочка. Если после удаления денатурирующего агента восстанавливается нативная структура белковой молекулы, то это называется ренатурация (ренативация).
3. При денатурации первичная структура не изменяется, т.е. не происходит разрыва пептидных связей.
4. Денатурированные под действием соляной кислоты белки в желудочно-кишечном тракте более легко перевариваются под действием пищеварительных ферментов.
Факторы, вызывающие денатурацию
1. Химические факторы: сильные кислоты или щелочи, органические растворители, детергенты, восстанавливающие агенты, концентрированные соли, тяжелые металлы.
2. Физические факторы: температура, давление, механическое воздействие, ультразвуковое и ионизирующее излучение.
Четвертичная структура
Представляет собой организацию нескольких полипептидных цепей, каждая из которых имеет третичную структуру, в единую функциональную молекулу белка. Четвертичной структурой обладают белки с молекулярной массой более 50000 Да. Протомер – отдельная полипептидная цепь в третичной структуре, не выполняющая функцию белка. Субъединица – протомер или объединение несколько протомеров, способных выполнять часть функций белка. Олигомер (мультимер) – сочетание протомеров или субъединиц в четвертичной структуре белка, несущих полную функциональную активность белка. Четвертичная структура стабилизируется нековалентными связями между протомерами (водородные, электростатические, гидрофобные взаимодействия). При разрушении связей, стабилизирующих четвертичную структуру, происходит разделение субъединиц и потеря функции белка.
Способность к специфическому узнаванию и специфическому взаимодействию является основой биологических функций всех белков. Специфически узнать молекулу - это значит найти поверхность молекулы с такой мозаикой радикалов, с которой можно образовать максимально возможное количество связей. Специфически взаимодействовать - это значит образовывать между участками поверхностей молекул максимально возможное число связей. Поверхности молекул, которые при образовании связей дополняют друг друга, называются комплементарными: положительному заряду должен соответствовать отрицательный, группе с поляризованным протоном должен соответствовать атом с неподеленной парой электронов, одной гидрофобной группе стерически должна соответствовать другая.
Правило: две молекулы, поверхности которых комплементарны, находят друг друга и взаимодействуют.
Уникальность белков в том, что они могут менять свою конформацию, делая поверхность комплементарной лиганду. Например: взаимодействие активного центра фермента с субстратом (по Кошланду). Различные лиганды связываются с белковыми молекулами по центрам связывания. Очевидно, что эти центры связывания должны быть комплементарны функциональным группам лиганда. Связи между лигандом и центром связывания белка нековалентные (водородные, ионные, гидрофобные). Поэтому такое связывание обратимо. Мономерные белки связываются с лигандом по гиперболической зависимости; мультимерные - по сигмоидной зависимости из-за кооперативного эффекта. Связывание белка с лигандом зависит от числа мест (центров) связывания и количества лиганда. Если количество молекул лиганда превышает число центров связывания на белке, дальнейшего связывания не происходит (белок насыщен лигандом). Специфическое взаимодействие за счет комплементарных поверхностей объясняет большинство функций белков (фермент - субстрат; гормон - рецептор; антиген - антитело и т.д.
Количественное определение белка
Различают две группы методов: 1) Определение количества белков в растворе на основе физико-химических свойств: биуретовый метод (основан на образовании окрашенного в фиолетовый цвет комплекса пептидных связей белка с ионами двухвалентной меди в щелочной среде); рефрактометрический и нефелометрический методы; поглощение ультрафиолетового излучения (при 280 нм поглощают УФО остатки ароматических аминокислот, при 180-210 нм - пептидная связь и ряд конформационных факторов). Используют закон Ламберта-Бэра А=εcl, где ε – коэффициент экстинкции (М-1см-1); с – концентрация вещества в растворе (М); l – длина пути светового луча в кювете (см). Для триптофана максимум абсорбции при 280 нм и коэффициент экстинкции равен
3400 М-1см-1, а для тирозина максимум абсорбции при 276 нм и коэффициент экстинкции составляет 1400 М-1см-1 (рисунок 4.1). Определение поглощения света длиной волны 280 нм используется для анализа концентрации белка в растворе (если известно количество остатков триптофана и тирозина в белковой молекуле).
2) Количественное определение индивидуальных белков на основе их биологических свойств (радиоиммунный, иммуноферментные методы).
Задача: в биологической жидкости имеется смесь белков (А+В+Х). Необходимо определить количество белка Х. Здесь общее определение количества белка не годится. Для количественного определения индивидуального белка Х в смеси белков предложен радиоиммунный метод. Рассмотрим его суть.
Первый этап: приготовление реагента для определения - чистым препаратом белка Х, полученным заблаговременно, иммунизируют животное. Против этого белка в организме животного образуются антитела. Их выделяют из крови и метят 125I. Этот этап осуществляется на предприятиях, производящих наборы реагентов для радиоиммунного определения белка.
Второй этап: анализируют смесь белков, добавляя к ним меченое антитело в избытке. Меченное антитело связывает из-за специфического взаимодействия только белок Х. Этот комплекс выделяют, подсчитывают радиоактивность и определяют количество метки. По количеству метки определяют количество антитела Х, т.е. искомого белка. Метод весьма чувствителен, поскольку основан на специфичности белков, т.е. специфическом комплементарном взаимодействии индивидуальных белков.
В настоящее время нашел широкое распространение иммуноферментный анализ индивидуальных белков (ИФА), основанный на сродстве антитела к конкретному антигену (ELISA).
Напомним, что антитела продуцируют В-клети (В-лимфоциты). Каждая клетка системы иммунитета вырабатывает одно антитело, которое распознает отдельный участок (эпитоп, антигенную детерминанту) молекулы антигена. Поскольку в молекуле антигена присутствует несколько разных эпитопов, антитела против каждого из них вырабатываются отдельными клетками системы иммунитета. Такие антитела, каждое из которых взаимодействует с данным антигеном, называют поликлональными. Они вариабельны по количеству, в связи с чем не нашли применения в методе ELISA. Известно, что В-клетки не воспроизводятся в культуре. Но после слияния с миеломными клетками удалось получить гибридомы и выделить растущие и делящиеся в культуре клоны клеток, которые продуцируют высокоспецифичные моноклональные антитела. Их и используют в методе ELISA.
Моноклональные антитела широко применяются в настоящее время при определении полипептидных гормонов, маркеров опухолей, цитокинов, лекарственных препаратов, различных низкомолекулярных биорегуляторов, возбудителей инфекционных заболеваний.
ELISA включает следующие основные этапы:
1. Образец, в котором хотят обнаружить специфическую молекулу или микроорганизм, фиксируют на твердой подложке, чаще используют пластиковые 96-луночные плашки.
2. К фиксированному образцу добавляют антитело, специфичное к маркерной молекуле (первое антитело), затем промывают лунку, чтобы удалить не связавшиеся молекулы первого антитела.
3. В лунку добавляют второе антитело, которое специфически связывается с первым антителом и не взаимодействует с маркерной молекулой. К этому антителу присоединен фермент, катализирующий превращение неокрашенного субстрата в окрашенный продукт (чаще, щелочная фосфатаза, пероксидаза или уреаза). Промывают лунку, чтобы удалить не связавшиеся молекулы конъюгата второе антитело-фермент.
4. Добавляют в лунку неокрашенный субстрат.
5. Проводят количественное (качественное) определение окрашенного продукта.
Основной принцип ELISA – специфическое связывание первого антитела с мишенью (белок, клетка). Применение моноклональных антител позволило существенно повысить специфичность метода ELISA, поскольку они связываются с одним, строго определенным антигенным сайтом.
Если первое антитело не связывается с мишенью, то оно удаляется при первом промывании. Второму конъюгату антитело-фермент не с чем связываться, он удаляется при втором промывании, и образец остается неокрашенным. Если связывание с мишенью происходит, то второе антитело присоединяется к первому, и конъюгированный фермент катализирует образование легко регистрируемого окрашенного продукта.
