|
|
мембранология. Мембранология. Заболевания, связанные с нарушением системы передачи сигналов (холера, коклюш, онкологические заболевания и др., нервномышечные расстройства, связанные с никотиновыми ацетилхолиновыми рецепторами)
Заболевания, связанные с нарушением системы передачи сигналов (холера, коклюш, онкологические заболевания и др., нервно-мышечные расстройства, связанные с никотиновыми ацетилхолиновыми рецепторами)
Холера
Определение
Холера (лат. cholera) - острая кишечная антропонозная инфекция, вызываемая бактериями вида Vibrio cholerae. Характеризуется фекально-оральным механизмом заражения, поражением тонкого кишечника, водянистой диареей, рвотой, быстрейшей потерей организмом жидкости и электролитов с развитием различной степени обезвоживания вплоть до гиповолемического шока и смерти. Распространяется, как правило, в форме эпидемий. Эндемические очаги располагаются в Африке, Латинской Америке, Индии (Юго-Восточной Азии).
В современном мире холера уже не представляет такой опасности, какую представляла раньше, однако до сих пор регистрируют отдельные случаи и даже вспышки эпидемии холеры в развивающихся и в бедных странах, особенно при массовых стихийных бедствиях, например, при землетрясениях, наводнениях.
Патогенез
Входными воротами возбудителя является пищеварительный тракт. Холерные вибрионы часто погибают в желудке вследствие наличия там хлористоводородной (соляной) кислоты. Заболевание развивается лишь тогда, когда они преодолевают желудочный барьер и достигают тонкой кишки, где 4 начинают интенсивно размножаться и выделять экзотоксин. Возникновение холерного синдрома связано с наличием у вибриона двух веществ: 1) белкового энтеротоксина - холерогена (экзотоксина) и 2) нейраминидазы. Холероген связывается со специфическим рецептором энтероцитов - ганглиозидом. Нейраминидаза, расщепляя кислотные остатки ацетилнейраминовой кислоты, образует из ганглиозидов специфический рецептор, усиливая тем действие холерогена. Комплекс холероген-специфический рецептор активирует аденилатциклазу, которая при участии и посредством стимулирующего действия простагландинов увеличивает образование циклического аденозинмонофосфата (АМФ). АМФ регулирует посредством ионного насоса секрецию воды и электролитов из клетки в просвет кишечника. В результате активации этого механизма слизистая оболочка тонкой кишки начинает секретировать огромное количество изотонической жидкости, которую не успевает всасывать толстая кишка. Начинается профузная диарея изотонической жидкостью.
Грубых морфологических изменений клеток эпителия у больных холерой выявить не удается (при биопсии). Нет данных о том, что токсин у человека поражает какие-либо другие органы, кроме тонкой кишки. Секретируемая тонкой кишкой жидкость характеризуется малым содержанием белка (около 1 г в 1 л), содержит следующие электролиты: натрий, калий, бикарбонаты, хлориды. Потеря жидкости достигает 1 л в течение часа. В результате наступает уменьшение объема плазмы со снижением количества циркулирующей крови и ее сгущением. Происходит перемещение жидкости из интерстициального во внутрисосудистое пространство, которое не может компенсировать продолжающихся потерь жидкой безбелковой части крови. В связи с этим быстро наступают гемодинамические расстройства, нарушения микроциркуляции, которые приводят к дегидратационному шоку и острой почечной недостаточности.
Из Chapter 22 Integration and Hormonal Regulation of Mammalian Metabolism «Principles of Biochemistry» 5th Edition A.l.Lehninger, D.L.Nelson, M.M.Cox
Токсин холеры, секретируемый холерным вибрионом, обнаруженным в загрязненной питьевой воде, катализирует перенос АДФ-рибозы от НАД + к α-субъединице Gs, блокируя его активность ГТФазы и тем самым делая ее постоянно активированной (рисунок). Это приводит к непрерывной активации аденилатциклазы кишечных эпителиальных клеток, и в результате высокая концентрация цАМФ запускает постоянную секрецию Cl , HCO3 и воды в просвет кишечника.Возникающее в результате обезвоживание и потеря электролитов являются основными патологиями холеры.
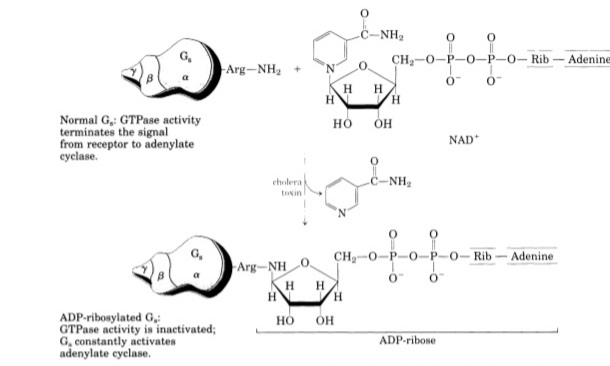
Восприимчивость к инфекции высокая. После перенесённой инфекции формируется видоспецифический антимикробный и антитоксический иммунитет, который длится от 1 до 3 лет.
Механизм передачи
Холера передается при употреблении воды, морепродуктов или других продуктов, зараженных экскрементами людей с симптоматической или бессимптомной инфекцией. Домашние больных холерой имеют высокий риск инфицирования, которое, вероятно, происходит через общие источники загрязненной пищи и воды. Передача инфекции от человека к человеку менее вероятна, потому что для нее требуется большое количество материала возбудителя.
Лечение
Основные задачи терапии:
восстановить объём циркулирующей крови и электролитный состав тканей, чтобы поддержать жизнь пациента;
воздействовать на возбудителя, чтобы сократить сроки болезни (антибиотикотерапия).
На первом этапе обязательна первичная регидратация — восполнение утраченной воды и солей. Далее проводится компенсаторная регидратация — коррекция продолжающейся потери воды и электролитов. Жидкость необходимо восполнять после каждого эпизода дефекации. Общий объём поступающей жидкости должен в 1,5 раза превышать объём теряющейся.
Если пациент может самостоятельного принимать жидкость, то ему назначают растворы с электролитами для питья (регидрон, оралит, раствор Филипса). В остальных случаях в зависимости от степени поражения солевые растворы вводят внутривенно (трисоль, квартасоль, дисоль, лактасоль и др.).
На фоне продолжающейся регидратационной терапии показано этиотропное лечение — приём антибиотиков тетрациклиновой или фторхинолоновой группы совместно с замещающими препаратами (например, энтеролом).
В качестве средств, направленных на борьбу с возбудителем болезни, возможно назначение препаратов калия и натрия. Также появились сведения о пользе препаратов цинка, которые достоверно снижают объём выделяемых каловых масс и уменьшают продолжительность диареи.
Профилактика
Для контроля заболеваемости холерой нужно грамотно избавляться от человеческих экскрементов и проводить должное очищение воды. В эндемичных регионах питьевую воду нужно кипятить или хлорировать, а овощи и рыбу тщательно готовить. Доступны несколько оральных холерных вакцин.
Живая аттенуированная моновалентная оральная вакцина в однократнй дозе под названием Вакскора® (лиофилизированный V. cholerae CVD 103-HgR) доступна в США и предназначена для взрослых до 64 лет включительно, путешествующих в зараженные холерой регионы. Она защищает от заболеваний, вызванных штаммом V. cholerae 01. Эффективность препарата Вакскора® при применении больше 3-6 месяцев неизвестна.
Две убитые цельноклеточные оральные вакцины, используемые как для детей, так и для взрослых, доступные на международном рынке, но не в США:
Dukoral®: Эта моновалентная вакцина содержит только вибрионы V. cholera 01 (классические и Эль-Тор) с небольшим количеством нетоксичных b-субъединиц холерного токсина; перед приемом ее необходимо смешать с буферной жидкостью (пакет с буфером растворяют в 150 мл [5 унций] прохладной воды).
ShanChol® - это новая бивалентная вакцина, которая содержит два штамма V. cholera – 01 и 0139 и не имеет дополнительных компонентов, исключающая необходимость приема жидкости во время вакцинации.
Обе вакцины обеспечивают 60-85% уровень защиты на срок до 5 лет. Каждая из вакцин принимается в 2-х дозах, а после 2 лет людям с постоянной опасностью заражения холерой рекомендуются бустерные дозы.
Инъекционные вакцины обеспечивают меньшую защиту на более короткие периоды времени, обладают большим количеством побочных эффектов и не рекомендуются к применению, если доступна пероральная вакцина.
Антибиотикопрофилактика при бытовых контактах с больными холерой не рекомендуется, поскольку данных, подтверждающих ее эффективность, недостаточно.
Коклюш
Определение
Коклюш — острое инфекционное заболевание, при котором доминирующим признаком является приступообразный спазматический кашель. Во всем мире отмечается увеличение заболеваемости детского населения коклюшем. Так, согласно статистическим данным, заболеваемость детей коклюшем за последние 15 лет в нашей стране увеличилась более чем в 6 раз: с 4,0 на 100 тыс. детского населения в 2002 г. до 24,7 на 100 тыс. детского населения в 2017 г.
Возбудитель
Самая первая эпидемия коклюша, которая описана в научной литературе, произошла в Париже в 1578 г. Есть упоминания в литературных источниках о трех эпидемиях коклюша в Персии, которые произошли на сто лет ранее парижской, и, возможно, являлись частью первой пандемии этого заболевания, распространившегося впоследствии в Европе. Возбудитель коклюша — Bordetella pertussis — был открыт в 1901 г. исследователями Ж. Ж. Борде и О. Жангу.
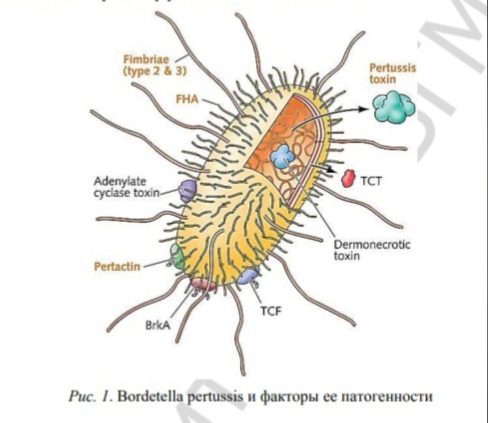
B. pertussis (рис. 1) патогенна только для человека и является возбудителем коклюша. Представляет собой мелкую (от 0,2–0,5 до 0,5–2,0 мкм) грамотрицательную аэробную кокккобактерию, требовательную к условиям выращивания. Бактерия является облигатным патогеном, нестойка во внешней среде, погибает при прогревании до 50 °С за 30 мин и при обработке дезинфицирующими растворами. Важным фактором патогенности B. pertussis является коклюшный токсин — pertussis toxin (PT) — экзотоксин, белок с массой 117 000 Да, состоящий из двух функциональных частей (А и В) и пяти структурных субъединиц (S1–S5). Фрагмент А, соответствующий субъединице S1, обладает ферментативной активностью, ингибирует клеточную аденилатциклазу. Участок В, соответствующий субъединицам S2–S5, отвечает за присоединение токсина к рецепторам клеток-мишеней. PT обладает разносторонней биологической активностью, являясь лимфоцитозостимулирующим, гистаминсенсибилизирующим и протективным антигеном, а его секреция контролируется 9 генами. Токсин обладает высокой иммуногенностью, в инактивированной форме он включен в состав всех бесклеточных вакцин. Определение антител к РТ методом иммуноферментного анализа (ИФА) применяется для диагностики коклюша и контроля эффективности вакцинации.
Филаментозный гемагглютинин (FHA) — поверхностный белок, участвующий в адгезии, обладает протективными свойствами. Входит в состав бесклеточных вакцин. FHA является важным фактором, способствующим не только колонизации бордетеллами эпителия дыхательных путей, но и замедлению их клиренса из бронхолегочной системы.
Пертактин (pertactin) — белок наружной мембраны, относится к системе адгезинов, обладает протективными свойствами.
Агглютиногены (fimbriae) — поверхностные белки, ответственные за выработку агглютинирующих антител.
Аденилатциклаза-гемолизин (adenylate cyclase toxin) — это комплекс экзофермента аденилатциклазы, которая при попадании в клетки катализирует образование цАМФ, с токсином гемолизином. Токсин — основной фактор патогенности, действующий на начальном этапе инфекции.
Липополисахарид обладает выраженной иммуногенностью, с ним связывают реактогенность клеточной вакцины.
Трахеальный цитотоксин (ТСТ) — фрагмент клеточной стенки бактерии, обладающий такими разнообразными свойствами, как пирогенность, адъювантность, артритогенность,. Вызывает цилиостаз и обеспечивает нарушение мукоцилиарного клиренса, что способствует колонизации возбудителя.
Дермонекротизирующий токсин (dermonecrotic toxin) участвует в непосредственном повреждении клеток эпителия, но его роль в патогенезе заболевания до конца не ясна.
Механизм передачи
Механизм передачи коклюшной инфекции — аэрогенный, путь передачи — воздушно-капельный. Инфицирование происходит при длительном и тесном контакте с источником инфекции, так как во внешней среде возбудитель нестоек. Заболеть коклюшем ребенок может с первых дней жизни. Выраженной сезонности не наблюдается. После перенесенного коклюша формируется нестойкий иммунитет (до 12–15 лет), повторные случаи заболевания возможны.
Патогенез
Входными воротами для B. pertussis являются слизистые оболочки дыхательных путей. Посредством специфических рецепторов системы адгезии с участием филаментозного гемагглютинина и наружных белков мембраны коклюшной палочки (фимбрий) происходит адгезия возбудителя к клеткам реснитчатого эпителия дыхательных путей с последующей колонизацией. Распространение возбудителя в организме осуществляется бронхогенным путем и достигает альвеол. Коклюшная палочка и продукты ее жизнедеятельности вызывают длительное раздражение рецепторов афферентных волокон блуждающего нерва, импульсы с которых направляются в дыхательный центр, что вызывает кашель по типу безусловного рефлекса. Постоянные импульсы с рецепторов эпителия дыхательных путей приводят к формированию в нем застойного очага возбуждения, характеризующегося признаками доминанты по А. А. Ухтомскому.
Основными его признаками при коклюше являются:
повышенная возбудимость дыхательного центра и способность суммировать раздражения;
возможность специфического ответа на неспецифический раздражитель;
иррадиация возбуждения на соседние центры (рвотный — с ответной реакцией в виде рвоты после приступа кашля; сосудистый — повышение артериального давления, спазм сосудов с развитием острого нарушения мозгового кровообращения и отека головного мозга; центр скелетной мускулатуры — ответ в виде тонико-клонических судорог);
стойкость;
инертность (сформировавшись, очаг периодически ослабевает и усиливается);
возможность перехода доминантного очага в состояние парабиоза дыхательного центра c задержкой и остановкой дыхания.
Признаки доминанты могут возникать в предсудорожном периоде, однако наиболее ярко они выражены в судорожном периоде, особенно на 2–3-й неделе заболевания.
Факторы патогенности B. pertussis приводят к локальному повреждению слизистых дыхательных путей и цилиостазу. Трахеальный цитотоксин и дермонекротизирующий токсин непосредственно повреждают клетки цилиндрического эпителия. Аденилатциклазный и коклюшный токсины подавляют антибактериальные и цитотоксические функции нейтрофилов, моноцитов и натуральных киллеров, способствуя развитию вторичной инфекции дыхательных путей. Кроме того, аденилатциклазный токсин индуцирует апоптоз макрофагов и других клеток, что отчасти объясняет развитие иммунной недостаточности у больных коклюшем в поздние сроки заболевания.
В период разгара заболевания в клинической картине доминируют системные проявления действия PT. Обладая аденозиндифосфатрибозилтрансферазной активностью, PT участвует в процессах рибозилирования поверхностно расположенных мембранных белков клеток хозяина — G-белков, которые играют ключевую роль в осуществлении действия гормонов, нейромедиаторов и других сенсорных сигналов, регулируя уровень цАМФ в клетках. Таким образом, повышая уровень цАМФ внутри клетки, PT приводит к усиленному распаду АТФ, что ведет к деполяризации клеточной мембраны и увеличению ее проницаемости, и, в конечном счете, к увеличению внутриклеточной концентрации кальция.
PT потенцирует действие вазопрессиновых агонистов, чем способствует усилению реабсорбции воды и электролитов (Na+ и Cl–) и оказывает антидиуретический и антинатрийуретический эффект. Это, наряду с повышением сосудистой проницаемости и микроциркуляторными расстройствами, обусловливает развитие отечного синдрома при коклюше.
Лечение
Для лечения коклюша необходим комплексный подход: проведение рациональной фармакотерапии (этиотропное, патогенетическое и симптоматическое лечение) и правильная организация режима, ухода и питания.
На первом этапе лечения наиболее важным является назначение рациональной антибиотикотерапии. Антибиотиками выбора в настоящее время являются макролиды. Азитромицин — препарат первой линии лечения в целях предотвращения передачи инфекции. Высокая усваиваемость и хорошая переносимость препарата позволяет применять его у новорожденных и детей раннего возраста.
Оксигенотерапия, проводимая в кувезе или кислородной палатке в течение 30–40 мин несколько раз в день является жизненно необходимой процедурой во время приступов кашля. Задачей патогенетической терапии является профилактика и лечение специфических осложнений: нарушений ритма дыхания, судорожного и геморрагического синдромов, специфических воспалительных изменений со стороны бронхолегочной системы. Активно используются противокашлевые ненаркотические препараты центрального действия: бутамирата цитрат (Синекод); препараты, разжижающие мокроту и улучшающие ее эвакуацию — амброксол, ацетилцистеин. Также могут использоваться средства, оказывающие успокаивающий эффект (например, настойки валерианы, пустырника, пиона), физиотерапевтическое лечение (электрофорез с препаратами кальция, новокаином).
Профилактика
Плановая специфическая профилактика включает в себя активную иммунизацию. Сегодня специфическую профилактику коклюша проводят цельноклеточной или ацеллюлярной вакциной в комбинации с дифтерийным и столбнячным анатоксином или с другими вакцинными компонентами, начиная с 3-месячного возраста, трехкратно с интервалом в 1,5 месяца, ревакцинацию — в 18 месяцев (АКДС, Пентаксим, Инфанрикс). АКДС является цельноклеточной вакциной и состоит из взвеси убитых коклюшных микробов и очищенных столбнячного и дифтерийного анатоксинов, адсорбированных на гидроксиле алюминия.
С 2005 г. успешно осуществляется в ряде стран так называемая стратегия «кокон» (cocooning), когда ацеллюлярными вакцинами прививаются все члены семьи, окружающие новорожденного: родители, непривитые братья и сестры, члены семьи старшего поколения.
Миастения
Определение
Миастения – быстро прогрессирующая, хроническая патология аутоиммунного характера, развивающаяся вследствие поражения рецепторов, отвечающих за передачу нервных импульсов антителами. В результате нервно-мышечная передача нарушается и происходит реактивная утомляемость скелетных мышц. Заболевание также называют «миастения гравис» и «болезнь Эрба-Гольдфлама» в честь ученых, которые вплотную занимались его изучением. Процент заболеваемости среди населения планеты достаточно высок. Миастения выявляется приблизительно у каждого 5-10 на 100 тысяч человек. В редких случаях развивается в детском возрасте.
Классификация
Миастения классифицируется по формам:
Глазная - выражается поражением нервных окончаний черепно-мозгового отдела. Первый тревожный сигнал, на который стоит сразу же обратить внимание – асимметрия опущения век.
Бульбарная - выявляется в 15% случаев. Сопровождается поражением гортанных и жевательных мышц. Явные симптомы – изменения в голосе: больной начинает говорить не так громко и отчетливо, возникают трудности с произношением определенных букв и мимикой.
Генерализованная - при этой разновидности болезни страдают глазные мышцы, далее – мышцы горла, конечностей. Поражаются бедренные мышцы. Особая опасность данного типа заболевания состоит в поражении тканей мышц дыхательного аппарата.
Миастения Ламберта-Итона - в основном диагностируется у лиц преклонного возраста. Прогрессирует ускоренными темпами. Выражается расстройством проводимости нервных импульсов к мышцам шеи и конечностей. Отсюда трудности с держанием головы в прямом положении. Процент смертности достаточно высок.
Патогенез
Механизмы развития приобретенной миастении тесно связаны с патологическими изменениями тимуса. Происходит образованием антител и аутореактивных Т-клеток, поражающих органы-мишени – структуры синапса и непосредственно мышечную ткань. К антигенным мишеням относят: мышечный ацетилхолиновый рецептор (АХР), мышечно-специфическая тирозинкиназа, рианодиновый рецептор, титин-протеин и другие. Антитела к AxP обнаруживаются у 85 % пациентов с генерализованной миастенией и 50-70 % пациентов с окулярной миастенией. Они очень специфичны для миастении и не выявляются у здоровых людей. Благодаря высокой чувствительности и специфичности исследование на анти-АхР является основным способом подтверждения диагноза "миастения".
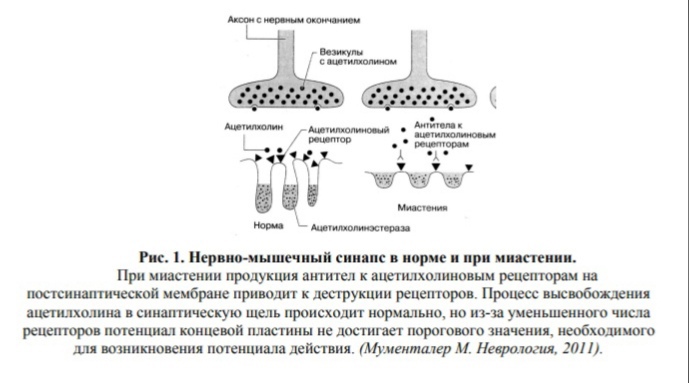
Также при миастении обнаружены антитела к некоторым цитокинам, ганглиозидам миелина нервной ткани и другим белковым структурам. Поражение приводит к нарушению нервно-мышечной передачи, проявляющейся мышечной слабостью и патологической утомляемостью. Перенос импульса от нерва к мышце происходит в нервно-мышечном синапсе. Потенциал действия, дошедший до нервного окончания, приводит к высвобождению в синаптическую щель кванта ацетилхолина, который содержится в везикулах нервных окончаний. На постсинаптической мембране молекулы ацетилхолина взаимодействуют с ацетилхолиновыми рецепторами, что приводит к временному открытию катионных каналов рецепторов и генерированию потенциала концевой пластинки. Когда он достигает критической величины, возникает потенциал действия, который распространяется вдоль мышечного волокна по поперечной тубулярной системе, вызывая высвобождение кальция в саркоплазму, взаимодействие актина и миозина и, вследствие этого, мышечное сокращение. Миастения – приобретенное расстройство нервно-мышечной передачи. Количество ацетилхолиновых рецепторов значительно снижено. Расстояние между нервным окончанием и постсинаптической мембраной увеличено, а складки постсинаптической мембраны, которые содержат рецепторы, оказываются более широкими, но менее глубокими, чем в норме. Снижение числа АХР ведет к уменьшению потенциала концевой пластинки, поэтому в вовлеченных мышцах не генерируется потенциал действия. Если нарушается передача импульсов достаточно большой части мышечных волоки, развивается клинически выраженная мышечная слабость. При повторном сокращении нарушение передачи распространяется на все большее количество синапсов, и сила мышцы прогрессивно уменьшается.
Лечение
В настоящее время врачи не имеют возможности полностью остановить процесс разрушения ацетилхолиновых рецепторов и избавить человека от симптомов миастении. Основное лечение направлено на остановку патологического процесса и достижение ремиссии, а также снижение утомляемости мускулатуры.
Основу терапии составляют средства, тормозящие работу иммунной системы: гормоны (преднизолон), цитостатики (циклоспорин), а также иммуноглобулины. Специфические препараты прозерин и калимин тормозят разрушение ацетилхолина, что позволяет увеличить его концентрацию в нервно-мышечном синапсе и, соответственно, улучшить передачу нервного импульса. Для ускорения процесса возбуждения используют препараты калия.
Специфическое лечение миастении дополняется общими средствами, в частности, антиоксидантами, стабилизирующими работу нервной системы. В зависимости от ситуации также назначаются лекарства, устраняющие побочные эффекты основных медикаментов.
При выявлении в ходе диагностики опухоли вилочковой железы проводится ее хирургическое удаление, иногда в сочетании с лучевой терапией. Показаниями к операции выступает неуклонное прогрессирование заболевания и его генерализованная форма у пациентов младше 70 лет. При идеальном результате после удаления тимуса человек практически полностью отказывается от медикаментов, а симптомы контролируются диетой и образом жизни.
При запредельно высокой концентрации антител в крови может назначаться ее искусственная очистка: плазмаферез, криофероз, иммуносорбция. Во время ремиссии проводятся курсы физиопроцедур (электрофорез, электромиостимуляция), массаж, санаторно-курортное лечение. |
|
|
 Скачать 206.41 Kb.
Скачать 206.41 Kb.


