Химия. Задание 1 (Блок 1 Классы минеральных веществ) к амфотерным оксидам относится
 Скачать 52.52 Kb. Скачать 52.52 Kb.
|
|
- Задание 1 (Блок 1 – Классы минеральных веществ) К амфотерным оксидам относится Оксид алюминия Оксид магния Оксид лития Оксид меди (II) - Задание 2 (Блок 1 - Классы минеральных веществ) Кислой солью (гидросолью) является 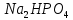 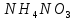 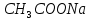 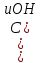 - Задание 3 (Блок 1 - Классы минеральных веществ) Для полной нейтрализации серной кислоты массой 4,9 грамма требуется гидроксид натрия массой… 4 г 2 г 8 г 1 г - Задание 4 (Блок 1 - Классы минеральных веществ) При взаимодействии ортофосфорной кислоты и калиевой щелочи образуется вода и 1) фосфит калия 2) фосфат калия 3) гидрофосфат калия 4) дигидрофосфат калия Возможны варианты 2, 3 и 4 в зависимости от соотношения кислоты и щёлочи Возможны варианты 1 и 2 в зависимости от температуры Всегда только 2 Всегда только 1 - Задание 5 (Блок 1 – Классы минеральных веществ) Оксид цинка будет проявлять кислотные свойства при взаимодействии с Гидроксидом лития Хлороводородной кислотой Серной кислотой Алюминием - Задание 6 (Блок 1 - Классы минеральных веществ) При взаимодействии 1 моля сульфата меди и 1 моля гидроксида натрия образуется 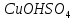 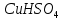 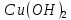 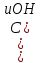 - Задание 7 (Блок 1 - Классы минеральных веществ) Один моль любого газа занимает объем 22,4 л При Т = 273 К, p = 1 атм Всегда Если он легче воздуха При Т = 0 К, p = 1 атм - Задание 8 (Блок 1 - Классы минеральных веществ) Если некоторое количество углекислого газа занимает при нормальных условиях объем 1,12 л, то масса этого газа составляет 2,2 г 22 г 44 г 22,4 г - Задание 9 (Блок 1 - Классы минеральных веществ) Какой объем триоксида серы образуется при взаимодействии 10 л диоксида серы и 10 л кислорода? 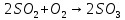 10 л 20 л 5 л 15 л - Задание 10 (Блок 2 – Строение атома и Периодический закон) Электроны, характеризующиеся орбитальным квантовым числом l=3 находятся на орбиталях f p d f - Задание 11 (Блок 2 – Строение атома и Периодический закон) В ряду HF – HCl – HBr кислотные свойства Усиливаются Ослабевают Не изменяются Изменяются периодически - Задание 12 (Блок 2 - Строение атома и Периодический закон) Максимально возможная степень окисления марганца равна … +7 +6 +8 +4 - Задание 13 (Блок 2 - Строение атома и Периодический закон) В ряду BeO – CaO – BaO основные свойства оксидов Возрастают Убывают Не изменяются Изменяются периодически - Задание 14 (Блок 2 – Строение атома и Периодический закон) В группе галогенов наиболее сильным окислителем является Фтор Хлор Бром Йод - Задание 15 (Блок 2 - Строение атома и Периодический закон) В ряду 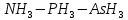 термическая устойчивость соединений термическая устойчивость соединенийУменьшается Увеличивается Не изменяется Сначала увеличивается, потом уменьшается - Задание 16 (Блок 2 - Строение атома и Периодический закон) Изотопами называются Атомы с одинаковым числом протонов и разным числом нейтронов Атомы с одинаковым числом протонов и нейтронов Атомы с одинаковым числом нейтронов и разным числом протонов Атомы с одинаковым числом нейтронов и электронов - Задание 17 (Блок 2 - Строение атома и Периодический закон) Число валентных электронов в основном состоянии атому элемента, образующего высший оксид состава 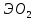 , равно , равно4 2 1 6 - Задание 18 (Блок 3 – Кинетика и термодинамика) Изотопами называются Атомы с одинаковым числом протонов и разным числом нейтронов Атомы с одинаковым числом протонов и нейтронов Атомы с одинаковым числом нейтронов и разным числом протонов Атомы с одинаковым числом нейтронов и электронов - Задание 19 (Блок 3 – Кинетика и термодинамика) Увеличение скорости химической реакции при ведении катализатора происходит в результате Уменьшения энергии активации Увеличения энтальпии реакции Уменьшения энергии Гиббса Увеличения энтропии системы - Задание 20 (Блок 3 – Кинетика и термодинамика) При уменьшении объема реакционной смеси в 4 раза скорость гомогенной элементарной химической реакции 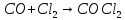 Увеличится в 16 раз Увеличится в 4 раза Уменьшится в 16 раз Уменьшится в 4 раза Задание 21 (Блок 3 – Кинетика и термодинамика) Во сколько раз должна увеличиться концентрация NO, чтобы скорость реакции 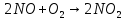 выросла в 9 раз? выросла в 9 раз?В 3 раза В 9 раз В 1,5 раза В 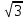 раза раза- Задание 22 (Блок 3 - Кинетика и термодинамика) Укажите верную запись Первого закона термодинамики: 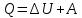 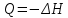 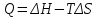 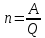 - Задание 23 (Блок 3 - Кинетика и термодинамика) В соответствии с термохимическим уравнением 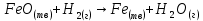 , ∆H = 23 кДж, , ∆H = 23 кДж, для получения 700 г железа нужно затратить ____ тепла 287,5 кДж 700 кДж 23 кДж 230,5 кДж - Задание 24 (Блок 3 - Кинетика и термодинамика) Для уравнения реакции 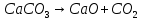 укажите правильную запись константы равновесия 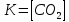 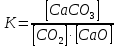 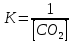 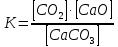 - Задание 25 (Блок 3 - Кинетика и термодинамика) Если температурный коэффициент реакции равен 2, то на сколько градусов нужно изменить температуру, чтобы скорость реакции увеличилась в 64 раза? Увеличить на 60ºС Увеличить на 40ºС Увеличить на 20ºС Уменьшить на 20ºС. - Задание 26 (Блок 3 - Кинетика и термодинамика) Согласно следствию из закона Гесса, тепловой эффект химической реакции равен сумме теплот сгорания исходных веществ за вычетом суммы теплот сгорания продуктов реакции с учетом их стехиометрических коэффициентов сумме теплот образования исходных веществ за вычетом суммы теплот образования продуктов реакции с учетом их стехиометрических коэффициентов сумме теплот образования исходных веществ и продуктов реакции с учетом их стехиометрических коэффициентов сумме теплот образования продуктов реакции с учетом их стехиометрических коэффициентов. - Задание 27 (Блок 3 - Кинетика и термодинамика) При наступлении химического равновесия скорости прямой и обратной реакций становятся равными прямая и обратная реакции прекращаются концентрации исходных веществ и продуктов реакции становятся равными ΔG < 0 - Задание 28 (Блок 3 - Кинетика и термодинамика) Теплота образования воды соответствует тепловому эффекту реакции 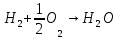 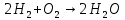 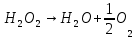 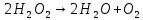 - Задание 29 (Блок 4 –Растворы) Количество вещества, растворенного в одном литре раствора – способ выражения концентрации раствора, называемый молярность моляльность нормальность мольная доля - Задание 30 (Блок 4 –Растворы) Закон Рауля характеризует зависимость давления насыщенного пара растворителя над раствором от _____ растворенного вещества (вставьте пропущенное слово) мольной доли моляльности молярности массовой доли - Задание 31 (Блок 4 –Растворы) При какой температуре замерзает раствор, полученный смешиванием 500 мл воды и 32 г метанола (криоскопическая константа воды К=1,86 град∙кг/моль). - 3,72ºС 0 ºС - 1,86 ºС - 0,93 ºС - Задание 32 (Блок 4 –Растворы) Массовая доля соли в растворе, полученном при смешивании 200 г 20% раствора и 300 г 30% раствора NaCl составляет 26% 28% 25% 50% - Задание 33 (Блок 4 –Растворы) При растворении 20 г гидроксида натрия в колбе объемом 0,5 л получается раствор с концентрацией 1 моль/л 2 моль/л 0,5 моль/л 0,038 моль/л - Задание 34 (Блок 4 –Растворы) Чему равна молярная масса неэлектролита, если его раствор, полученный смешиванием 6,4 г этого неэлектролита и 100 г воды, кипит при температуре 101,04ºС (Эбуллиоскопическая константа воды К =0,52 град∙кг/моль)? г/моль 32 г/моль 46 г/моль 64 г/моль 52 г/моль - Задание 35 (Блок 4 – Раcтворы) При одинаковой температуре кипят растворы неэлектролитов С одинаковой моляльной концентрацией растворенного вещества С одинаковой массовой долей растворенного вещества С одинаковой массой растворителя С одинаковой молярной концентрацией растворенного вещества - Задание 36 (Блок 4 – Раcтворы) Осмотическое давление раствора объемом 250 мл, содержащего 18 г глюкозы при температуре 27ºС равно примерно 997 кПа 90 кПа 27 кПа 300 кПа - Задание 37 (Блок 5 – Реакции ионного обмена) Выберите правильную запись произведения растворимости для ортофосфата кальция 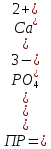 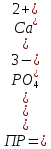 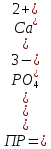 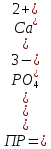 - Задание 38 (Блок 5 – Реакции ионного обмена) При растворении какого из перечисленных электролитов в воде образуется максимальное количество ионов? Сульфат алюминия Хлорид аммония Нитрат кальция Гидроксид натрия - Задание 39 (Блок 5 – Реакции ионного обмена) И с кислотами, и со щелочами вступает в реакции ионного обмена Гидроксид цинка Серная кислота Сульфит калия Гидроксид натрия - Задание 40 (Блок 5 – Реакции ионного обмена) Реакция ионного обмена ацетата калия с серной кислотой Идет с образованием слабого электролита Идет с образованием осадка Идет с выделением газа Не идет - Задание 41 (Блок 5 – Реакции ионного обмена) Уменьшить степень гидролиза хлорида алюминия можно, если Добавить соляной кислоты Добавить воды Повысить температуру Понизить давление - Задание 42 (Блок 5 – Реакции ионного обмена) Если концентрация NaOH в растворе равна 0,001 моль/л, то водородный показатель этого раствора pH=11 pH=12 pH=3 pH=7 - Задание 43 (Блок 5 – Реакции ионного обмена) К сильным электролитам относятся Все растворимые соли Все кислоты Все гидроксиды Все основания - Задание 44 (Блок 5 – Реакции ионного обмена) В реакциях ионного обмена кислых солей не образует Азотная кислота Серная кислота Хромовая кислота Ортофосфорная кислота - Задание 45 (Блок 5 – Реакции ионного обмена) Раствор электролита называется насыщенным, если произведение молярных концентраций ионов этого электролита Равно произведению растворимости ПР Больше, чем произведение растворимости ПР Меньше, чем произведение растворимости ПР Не совпадает с величиной произведения растворимости ПР - Задание 46 (Блок 5 – Реакции ионного обмена) Выберите самую слабую из перечисленных кислот, зная их константы диссоциации Синильная кислота  Азотистая кислота  Уксусная кислота  Д=- Вариант ответа Хлорноватистая кислота  - Задание 47 (Блок 5 – Реакции ионного обмена) Среда раствора остается нейтральной при растворении в воде Хлорида натрия Хлорида аммония Ацетата натрия Карбоната лития - Задание 48 (Блок 5 – Реакции ионного обмена) Раствор карбоната натрия может дать реакцию совместного гидролиза с выпадением осадка и выделением газа при смешивании с раствором Хлорида алюминия Сульфата калия Сульфида калия Нитрата бария - Задание 49 (Блок 5 – Реакции ионного обмена) Растворимость карбоната бария  равна равна3,94 мг/л 1,97 мг/л 7,88 мг/л 10 мг/л - Задание 50 (Блок 5 – Реакции ионного обмена) Сокращенному ионному уравнению  соответствует химическая реакция соответствует химическая реакция    - Задание 51 (Блок 5 – Реакции ионного обмена) И с кислотами, и со щелочами вступает в реакции ионного обмена Гидроксид цинка Серная кислота Сульфит калия Гидроксид натрия - Задание 52 (Блок 5 – Реакции ионного обмена) Полная нейтрализация сероводородной кислоты гидроксидом калия описывается сокращённым ионным уравнением   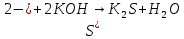 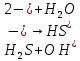 - Задание 53 (Блок 6 – Окислительно-восстановительные реакции) Окисление ванадия происходит в процессе, схема которого: 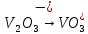 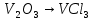   - Задание 54 (Блок 6 – Окислительно-восстановительные реакции) К сильным окислителям относятся Азотная кислота Сероводородная кислота Азотистая кислота Водный раствор аммиака - Задание 55 (Блок 6 – Окислительно-восстановительные реакции) В реакции  Коэффициент перед окислителем равен 2 5 16 8 - Задание 56 (Блок 6 – Окислительно-восстановительные реакции) Серная кислота проявляет сильные окислительные свойства, если ее раствор соответствует определению концентрированный разбавленный переохлажденный нейтральный - Задание 57 (Блок 6 – Окислительно-восстановительные реакции) Реакцией диспропорционирования называется реакция, схема которой     - Задание 58 (Блок 6 – Окислительно-восстановительные реакции) Максимально высокая возможная степень окисления кислорода в соединениях равна +2 +6 -1 0 - Задание 59 (Блок 6 – Окислительно-восстановительные реакции) Одинаковую степень окисления хром проявляет в соединениях  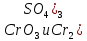 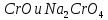 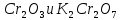 - Задание 60 (Блок 6 – Окислительно-восстановительные реакции) Выберите соединение азота, в котором азот может быть только восстановителем 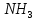 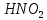 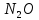 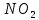 - Задание 61 (Блок 6 – Окислительно-восстановительные реакции) Восстановление перманганат-ионов в кислой среде происходит по схеме 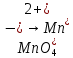    - Задание 62 (Блок 6 – Окислительно-восстановительные реакции) При действии перманганатом калия на концентрированный раствор галогеноводорода реакция не идет для фтороводорода хлороводорода бромоводорода йодоводорода - Задание 63 (Блок 6 – Окислительно-восстановительные реакции) В реакции, схема которой имеет вид  восстановителем является восстановителем являетсябромид калия бромит калия бромат калия гипобромит калия - Задание 64 (Блок 6 – Окислительно-восстановительные реакции) В каком направлении будет протекать реакция 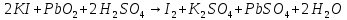 при стандартных условиях, если окислительно-восстановительные потенциалы полуреакций равны 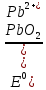 , , 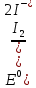 В прямом направлении В обратном направлении Реакция не идет Система находится в химическом равновесии - Задание 65 (Блок 7 –Электрохимические процессы) Для защиты никелевых изделий от коррозии в качестве катодного покрытия можно использовать медь цинк магний алюминий - Задание 66 (Блок 7 –Электрохимические процессы) ЭДС гальванического элемента 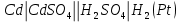 , в котором , в котором молярная концентрация раствора сульфата кадмия равна 1 моль/л, а концентрация раствора серной кислоты равна 0,5 моль/л, примерно равна 0,4 В - 0,4 В 0,2 В - 0,2 В - Задание 67 (Блок 7 –Электрохимические процессы) Для гальванического элемента 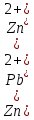 Цинк является анодом Цинк является катодом ЭДС меньше нуля Растворяется свинец - Задание 68 (Блок 7 –Электрохимические процессы) Для получения 71 г газообразного хлора электролизом водного раствора KCl при выходе по току 100% сухого хлорида калия 149 г 74,5 г 37,25 г 71 г - Задание 69 (Блок 7 –Электрохимические процессы) После пропускания постоянного электрического тока через водный раствор хлорида натрия среда раствора будет щелочной кислой нейтральной возможны разные варианты кислотности среды - Задание 70 (Блок 7 –Электрохимические процессы) Продуктами, выделяющимися на инертных электродах при электролизе водного сульфата меди, являются Медь и кислород Медь и водород Водород и сера Водород и кислород - Задание 71 (Блок 7 –Электрохимические процессы) Выберите вещество, при электролизе которого и в водном растворе, и в расплаве образуются одинаковые продукты на электродах Хлорид меди Хлорид натрия Фторид натрия Сульфат меди - Задание 72 (Блок 7 –Электрохимические процессы) По схеме коррозионной гальванопары 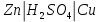 можно утверждать, что можно утверждать, что Коррозии подвергается цинк Коррозии подвергается медь Это химическая коррозия Коррозия идет с кислородной деполяризацией - Задание 73 (Блок 7 –Электрохимические процессы) При электролизе водного раствора нитрата железа (III) схема процесса на аноде 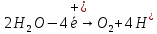 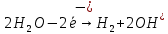 2   - Задание 74 (Блок 7 –Электрохимические процессы) При электролизе водного раствора нитрата калия образуются продукты Водород, кислород, гидроксид калия Гидроксид калия и азотная кислота Калий, кислород, аммиак Нитрит калия, кислород - Задание 75 (Блок 7 –Электрохимические процессы) Объём газа (при нормальных условиях), выделившегося на аноде при электролизе раствора серной кислоты, производившегося в течение 10 мин при силе тока 1,5А, составляет 52 мл 104 мл 75 мл 150 мл - Задание 76 (Блок 7 –Электрохимические процессы) При электролизе водного раствора нитрата калия образуются продукты Водород, кислород, гидроксид калия Гидроксид калия и азотная кислота Калий, кислород, аммиак Нитрит калия, кислород - Задание 77 (Блок 7 –Электрохимические процессы) Объём газа (при нормальных условиях), выделившегося на аноде при электролизе раствора серной кислоты, производившегося в течение 10 мин при силе тока 1,5А, составляет 52 мл 104 мл 75 мл 150 мл - Задание 78 (Блок 7 –Электрохимические процессы) При прохождении через раствор сульфата никеля (II) тока силой 2А масса катода увеличилась на 0,24 г. Если выход по току равен 0,8, то время электролиза равно примерно 8 минут 6,5 минут 4 минуты 13 минут - Задание 79 (Блок 7 –Электрохимические процессы) Электролизом из водного раствора соли невозможно выделить алюминий медь хром кобальт - Задание 80 (Блок 7 –Электрохимические процессы) Электрохимическая коррозия с водородной деполяризаций происходит В растворе кислоты В растворе щёлочи В некипяченой воде В растворе хлорида натрия - Задание 81 (Блок 7 –Электрохимические процессы) При нарушении оловянного покрытия на железном изделии в кислой среде на аноде будет протекать реакция     - Задание 82 (Блок 7 –Электрохимические процессы) ЭДС медного концентрационного гальванического элемента будет иметь наибольшее значение, если один из электродов стандартный, а другой погружен в раствор, концентрация ионов меди в котором 0,0001 моль/л 1 моль/л 0,25 моль/л 2 моль/л - Задание 83 (Блок 8 –Комплексные соединения) Координационное число комплексобразователя в  равно равно6 3 9 4 - Задание 84 (Блок 8 –Комплексные соединения) При первичной диссоциации соли  в растворе образуется в растворе образуется4 иона 3 иона 6 ионов 10 ионов - Задание 85 (Блок 8 –Комплексные соединения) Один моль вещества номинального состава  взаимодействует в растворе с двумя молями нитрата серебря с образованием нерастворимого хлорида серебра. Формула вещества должна быть записана как взаимодействует в растворе с двумя молями нитрата серебря с образованием нерастворимого хлорида серебра. Формула вещества должна быть записана как    - Задание 86 (Блок 8 –Комплексные соединения) Для комплексного соединения  укажите правильную запись константы нестойкости укажите правильную запись константы нестойкости    - Задание 87 (Блок 8 –Комплексные соединения) В комплексной соли  в состав внутренней координационной сферы входят ионы в состав внутренней координационной сферы входят ионы   только   - Задание 88 (Блок 8 –Комплексные соединения) В сульфате тетраамминмеди  лигандом является лигандом является    - Задание 89 (Блок 8 –Комплексные соединения) Для комплексных соединений характерно такое явление как изомерия аллотропия изотопия самовозгорание - Задание 90 (Блок 8 –Комплексные соединения) При добавлении щелочи к растворам сложных соединений состава  и и  в первом случае выпал зеленоватый осадок, а во втором –признаков реакции не наблюдалось. Это объясняется тем, что в первом случае выпал зеленоватый осадок, а во втором –признаков реакции не наблюдалось. Это объясняется тем, что – двойная соль, – двойная соль,  – комплексная соль – комплексная соль  – комплексная соль, – комплексная соль,  – двойная соль – двойная соль  – подвергается гидролизу – подвергается гидролизу – окислитель – окислитель - Задание 91 (Блок 9 Качественный анализ) Действием концентрированного раствора щёлочи можно отличить друг от друга Гидроксид магния и гидроксид цинка Гидроксид цинка и гидроксид алюминия Гидроксид магния и гидроксид кальция Хлорид натрия и хлорид калия - Задание 92 (Блок 9 Качественный анализ) Действием подкисленного раствора перманганата калия можно обнаружить в растворе Нитрит-ионы Нитрат-ионы Сульфат-ионы Ортофосфат-ионы - Задание 93 (Блок 9 Качественный анализ) Действием подкисленного раствора дихромата калия можно обнаружить в растворе ионы 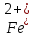 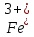 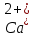 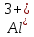 - Задание 94 (Блок 9 Качественный анализ) С помощью раствора лакмуса можно различить растворы Хлорида алюминия и карбоната натрия Серной кислоты и соляной кислоты Гидроксида натрия и гидроксида лития Гидроксида калия и карбоната натрия - Задание 95 (Блок 9 Качественный анализ) Качественной реакцией на определение нахождения в растворе иона  является является    - Задание 96 (Блок 9 Качественный анализ) С помощью измерения электропроводности можно отличить друг от друга водные растворы Раствор серной кислоты и раствор глицерина Раствор соляной кислоты и раствор щелочи Раствор сульфата натрия и раствор гидроксида натрия Раствор сахара и раствор этилового спирта - Задание 97 (Блок 9 Качественный анализ) Появление характерного запаха при добавлении к исследуемому раствору концентрированной горячей щелочи – это качественная реакция на ионы     - Задание 98 (Блок 9 Качественный анализ) Специфическим реагентом, определяющим наличие иона никеля в растворе, является диметилглиоксим перманганат калия глицерин Дихромат калия - Задание 99(Блок 9 Качественный анализ) Специфическим реагентом, определяющим наличие иона никеля в растворе, является диметилглиоксим перманганат калия глицерин Дихромат калия Задание 100 (Блок 9 Качественный анализ) Для определения качественного состава неизвестной соли исследовали её раствор желтоватого цвета. При добавлении раствора сильной кислоты появился резкий запах уксуса. При добавлении роданида аммония раствор приобрёл кроваво-красную окраску. Неизвестная соль - это Ацетат железа (III) Ацетат никеля (II) Сульфид железа (II) Сульфит меди (II) |
