Зачет. Закон и периодическая система химических элементов Д. И. Менделеева в свете учения в строении атома. Развитие изученных знаний о периодическом законе и периодической системе
 Скачать 1.48 Mb. Скачать 1.48 Mb.
|
|
Билеты по химии 1.Периодический закон и периодическая система химических элементов Д.И. Менделеева в свете учения в строении атома. Развитие изученных знаний о периодическом законе и периодической системе. Периодический закон Менделеева фундаментальный закон, устанавливающий периодическое изменение свойств химических элементов в зависимости от увеличения зарядов ядер их атомов. Открыт Д. И. Менделеевым в 1869 при сопоставлении свойств всех известных в то время элементов и величин их атомных весов. Физический смысл П. з. был вскрыт лишь после выяснения того, что заряд ядра атома возрастает при переходе от одного химического элемента к соседнему (в периодической системе) на единицу элементарного заряда. Численно заряд ядра равен порядковому номеру (атомному номеру Z) соответствующего элемента в периодической системе, то есть числу протонов в ядре, в свою очередь равному числу электронов соответствующего нейтрального атома (см. Атом) . Химические свойства атомов определяются структурой их внешних электронных оболочек, периодически изменяющейся с увеличением заряда ядра, и, следовательно, в основе П. з. лежит представление об изменении заряда ядра атомов, а не атомной массы элементов. П. з. имеет огромное естественнонаучное и философское значение. Он позволил рассматривать все элементы в их взаимной связи и прогнозировать свойства неизвестных элементов. Благодаря П. з. многие научные поиски получили целенаправленный характер. П. з. - яркое проявление действия общих законов диалектики, в частности закона перехода количества в качество. 2.Атом – сложная частница. Состав атомного ядра. Электронная оболочка атома. Атом — частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств. Атомы состоят из положительно заряженного ядра и оболочки, образованной отрицательно заряженными электронами. Общий заряд свободного атома* равен нулю, так как заряды ядра и электронной оболочки уравновешивают друг друга. При этом величина заряда ядра равна номеру элемента в периодической таблице (атомному номеру) и равна общему числу электронов (заряд электрона равен −1). Атомное ядро состоит из положительно заряженных протонов и нейтральных частиц — нейтронов, не имеющих заряда. Электронная оболочка атома — область пространства вероятного местонахождения электронов, характеризующихся одинаковым значением главного квантового числа n и, как следствие, располагающихся на близких энергетических уровнях. Число электронов в каждой электронной оболочке не превышает определенного максимального значения. Порядок заполнения электронных оболочек (орбиталей с одинаковым значением главного квантового числа n) определяется правилом Клечковского, порядок заполнения электронами орбиталей в пределах одного подуровня (орбиталей с одинаковыми значениями главного квантового числа n и орбитального квантового числа l) определяется Правилом Хунда. Валентная оболочка — самая внешняя оболочка атома. Электроны этой оболочки зачастую неверно называют валентными электронами, то есть электронами, определяющими поведение атома в химических реакциях. 3.Состав атомных ядер. Изотопы. Понятие химического элемента. Атомное ядро́ — центральная часть атома, в которой сосредоточена основная его масса. Атомные ядра различных элементов состоят из частиц двух видов – протонов и нейтронов. Первая из этих частиц представляет собой атом водорода, из которого удален единственный электрон. В 1919 году Э. Резерфорд обнаружил ядра атома водорода в продуктах расщепления ядер атомов многих элементов. Резерфорд назвал эту частицу протоном. Протон обладает массой, практически равной массе атома водорода (точно 1,00728 углеродных единиц) и электрическим зарядом, равным +1. В 1932 г. Дж. Чедвик открыл элементарную частицу, не обладающую электрическим зарядом, в связи с чем она была названа нейтроном. Нейтрон обладает массой, немного превышающей массу протона (точно 1,008665 углеродных единиц). Ядра атомов всех элементов (за исключением водорода) состоят из протонов и нейтронов. Число протонов в ядре определяет значение его положительного заряда, а суммарное число протонов и нейтронов - значение его массы. Изотопы — разновидности атомов (и ядер) какого-либо химического элемента, которые имеют одинаковый атомный (порядковый) номер, но при этом разные массовые числа. Название связано с тем, что все изотопы одного атома помещаются в одно и то же место (в одну клетку) таблицы Менделеева. Химический элемент — совокупность атомов с одинаковым зарядом ядра и числом протонов, совпадающим с порядковым (атомным) номером в таблице Менделеева. 4.Электронные формулы и графические схемы строения электронных слоев атомов. 5.Особенности электронного строения атомов больших периодов. Радиусы атомов, учетом положения химических элементов в периодической системе Д.И. Менделеева. В группах (главная подгруппа) с увеличением зарядов атомных ядер элементов (сверху вниз) металлические свойства усиливаются, неметаллические ослабевают. Это объясняется тем, что: • число электронов на внешнем уровне атомов остается одинаковым; • увеличивается число энергетических уровней в атоме; • увеличивается радиус атомов. В больших периодах такие изменения происходят медленнее, так как, начиная с третьего элемента, у атомов достраивается не внешний энергетический, а предвнешний уровень с 8 до 18 электронов (у элементов побочных подгрупп), и лишь затем заполняется внешний уровень с 2 до 8 электронов (у элементов главных подгрупп). В «сверхбольших» периодах (шестом и седьмом, незавершенном) эти изменения происходят еще медленнее, так как у лантаноидов и актиноидов достраивается не внешний предвнешний уровень, а третий снаружи уровень — с 18 до 32 электронов. Это объясняется тем, что свойства химических элементов и образуемых ими веществ зависят в первую очередь от строения внешнего энергетического уровня атомов, меньше — от строения предвнешнего и почти не зависят от строения внутренних уровней. Атом не является сферой со строго определенными поверхностью и радиусом. Напомним, что атом представляет собой ядро, окруженное облаком электронов. Вероятность обнаружения электрона по мере удаления от ядра постепенно возрастает до некоторого максимума, а затем постепенно уменьшается, но становится равной нулю только на бесконечно большом расстоянии. Во-вторых, если мы все же выберем некоторое условие для определения радиуса, такой радиус все равно нельзя будет измерить экспериментально. Эксперимент позволяет определять только межъядерные расстояния, другими словами длины связей. Для их определения используется рентгеноструктурный анализ или метод электронографии (основанный на дифракции электронов). Радиус атома полагают равным половине наименьшего межъядерного расстояния между одинаковыми атомами. Вандерваальсовы радиусы. Для несвязанных между собой атомов половина наименьшего межъядерного расстояния называется вандерваальсовым радиусом. Ковалентные радиусы. Ковалентный радиус определяется как половина межъядерного расстояния (длины связи) между двумя одинаковыми атомами, связанными друг с другом ковалентной связью. Ионные радиусы. Ионный радиус-это одна из двух частей межъядерного расстояния между соседними одноатомными (простыми) ионами в кристаллическом ионном соединении (соли). Определение ионного радиуса тоже сопряжено с немалыми проблемами, поскольку экспериментально измеряют межионные расстояния, а не сами ионные радиусы. Межионные расстояния зависят от упаковки ионов в кристаллической решетке. 6.Виды химической связи: ионная, металлическая, ковалентная (полярная, неполярная). Общая характеристика. 1)Ионная связь — очень прочная химическая связь, образующаяся между атомами с большой разностью (>1,5 по шкале Полинга) электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательность (один из атомов отдает электрон и становится катионом, а другой атом принимает электрон и становится анионом.). Это притяжение ионов как разноименно заряженных тел. Ионная связь — крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу. Образуются ионы. Характеристикой подобных соединений служит хорошая растворимость в полярных растворителях (вода, кислоты и т. д.). Это происходит из-за заряженности частей молекулы. При этом диполи растворителя притягиваются к заряженным концам молекулы, и, в результате Броуновского движения, «растаскивают» молекулу вещества на части и окружают их, не давая соединиться вновь. В итоге получаются ионы окружённые диполями растворителя. 2) Металлическая связь — химическая связь, которая обусловлена взаимодействием положительных ионов металлов, составляющих кристаллическую решётку, с электронным газом из валентных электронов (электроны свободны). Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Многие металлы обладают высокой твёрдостью, например хром, молибден, тантал, вольфрам и др. Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей. Большинство металлов образует одну из следующих высокосимметричных решёток с плотной упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную. 3) Ковалентная связь (атомная связь) — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений. Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными. Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей. Ковалентная неполярная связь образуется между одними и теми же атомами неметалла. Ковалентная полярная связь образуется между элементами неметаллами с разной электроотрицательностью, при этом один элемент приобретает условно положительный. 7.Ковалентная связь, способы ее образования. Длина и энергия связи. Виды связи(полярная, неполярная). Электроотрицательность химических элементов. Ковалентная связь (атомная связь) — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. 1)Образование связи при рекомбинации атомов: Атомы и свободные радикалы склонны к рекомбинации — образованию ковалентной связи путём обобществления двух неспаренных электронов, принадлежащих разным частицами. H + H → H2; ·CH3 + ·CH3 → CH3 — CH3. Образование связи при рекомбинации сопровождается выделением энергии. Так, при взаимодействии атомов водорода выделяется энергия в количестве 436 кДж/моль. Этот эффект используют в технике при атомно-водородной сварке. Поток водорода пропускают через электрическую дугу, где генерируется поток атомов водорода. Атомы затем вновь соединяются на металлической поверхности, помещаемой на небольшое расстояние от дуги. Металл может быть таким путём нагрет выше 3500°C. Большим достоинством «пламени атомного водорода» является равномерность нагрева, позволяющая сваривать очень тонкие металлические детали. 2) Образование связи по донорно-акцепторному механизму: Существует гетерогенный механизм — взаимодействие разноименно заряженных ионов — протона H+ и отрицательного иона водорода H-, называемого гидрид-ионом: H+ + H- → H2 При сближении ионов двухэлектронное облако (электронная пара) гидрид-иона притягивается к протону и в конечном счёте становится общим для обоих ядер водорода, то есть превращается в связывающую электронную пару. Частица, поставляющая электронную пару, называется донором, а частица, принимающая эту электронную пару, называется акцептором. Такой механизм образования ковалентной связи называется донорно-акцепторным. 3)Ковалентная неполярная связь образуется между одними и теми же атомами неметалла. 4)Ковалентная полярная связь образуется между элементами неметаллами с разной электроотрицательностью, при этом один элемент приобретает условно положительный. 11.Классификация химических реакций в неорганической химии Химические реакции классифицируют по различным признакам. По числу исходных веществ и продуктов реакции
Одна из реакций обмена реакция нейтрализации – это реакция между кислотой и основанием, в результате которой получается соль и вода.NaOH + HCl → NaCl + H2O По тепловому эффекту
С + О2 → СО2 + Q
N2 + O2 → 2NO – Q По признаку обратимости
И реакции, протекающие без изменения степени окисления.HNO3 + KOH → KNO3 + H2O 5.Гомомгенные реакции, если исходные вещества и продукты реакции находятся в одном агрегатном состоянии. И гетерогенные реакции, если продукты реакции и исходные вещества находятся в разных агрегатных состояниях. Например: синтез аммиака. Окислительно-восстановительные реакции. Различают два процесса: Окисление – это отдача электронов, в результате степень окисления увеличивается. Атом молекула или ион, отдающий электрон называется восстановителем. Mg0 - 2e → Mg+2 2I- 2e → I2 Восстановление – процесс присоединения электронов, в результате степень окисления уменьшается. Атом молекула или ион, присоединяющий электрон называется окислителем. S0 +2e → S-2 O20 +4e → 2O-2 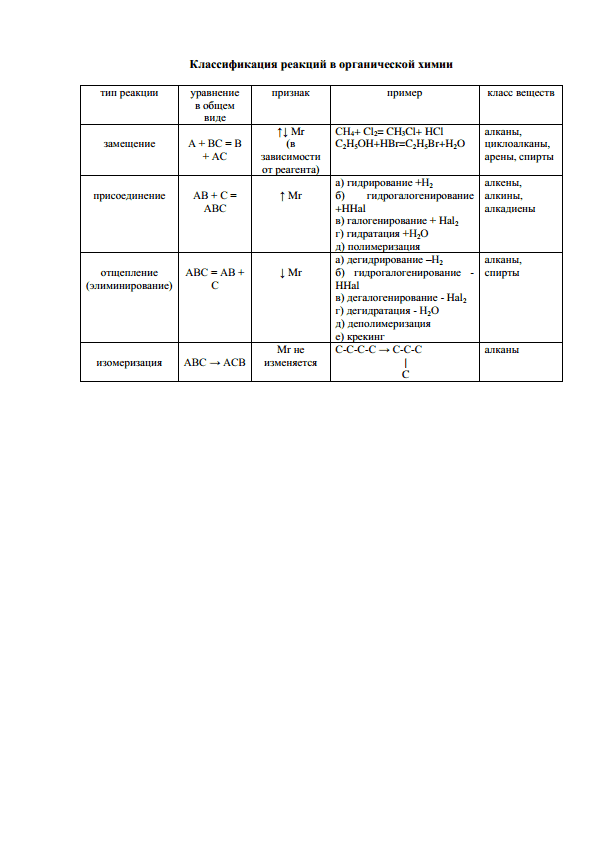 12.Скорость химической реакции - это величина, показывающая как изменяются концентрации исходных веществ или продуктов реакции за единицу времени. К факторам, влияющим на скорость реакции, относятся природа реагентов, катализатор, температура, концентрация реагентов. 1. Природа реагентов. Здесь большую роль играет характер химических связей в соединениях, строение их молекул. Например, выделение водорода цинком из раствора хлороводорода происходит значительно быстрее, чем из раствора уксусной кислоты, так как полярность связи Н – Cl больше, чем связи О – Н в молекуле СН3СООН; иначе говоря, из-за того, что НCl – сильный электролит, а СН3СООН – слабый электролит в водном растворе. Чем больше поверхность соприкосновения реагирующих веществ, тем быстрее протекает реакция. Поверхность твердого вещества может быть увеличена путем его измельчения или растворения (если вещество растворимо). Реакции в растворах протекают практически мгновенно. 2. Катализаторы. Большое влияние на скорость реакции оказываюткатализаторы – вещества, увеличивающие скорость реакции (часто от нуля до очень больших значений), но не входящие в состав продуктов. Увеличение скорости реакции под влиянием катализаторов называетсякатализом. Во многих случаях катализаторы образуют с одним из реагирующих веществ промежуточное соединение, которое реагирует с другим исходным веществом, в результате получается продукт и высвобождается катализатор. Иногда употребляют отрицательные катализаторы — ингибиторы, которые, наоборот, замедляют нежелательные химические реакции (например, коррозию металлов). 3. Температура. Для газовых реакций известно, что при повышении температуры на десять градусов скорость реакции возрастает в 2–4 раза Для реакций в растворах скорость также увеличивается с ростом температуры и часто в той же мере, как и для газовых реакций. При повышении температуры возрастает число активных молекул, т. е. таких молекул, которые в момент столкновения обладают большей энергией и могут образовать продукты. 4. Концентрация реагентов. Чтобы произошло взаимодействие, частицы реагирующих веществ в гомогенной среде должны столкнуться. Число столкновений пропорционально числу частиц реагирующих веществ в объеме реактора, т. е. молярным концентрациям этих веществ. Чем большие количества веществ взяты для реакции в данном объеме системы, т. е. чем выше концентрация реагентов, тем больше число столкновений частиц и тем больше скорость реакции. Зависимость скорости реакции от концентрации реагентов распространяется на газовые смеси и растворы. площадь соприкосновения реагирующих веществ Для увеличения площади соприкосновения реагирующих веществ, их измельчают. Наибольшей степени измельчения достигают путем растворения веществ. Быстрее всего вещества реагируют в растворах. природа реагирующих веществ Например, металлы магний и железо реагируют с соляной кислотой одинаковой концентрации с различной скоростью. Это связано с разной химической активностью металлов. 13)Химическое равновесие — состояние химической системы, в которой протекает одна или несколько химических реакций, причём скорости в каждой паре прямой-обратной реакции равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняется закономерности, которая была высказана в общем виде в 1885 году французским ученым Ле Шателье. Факторы, влияющие на химическое равновесие: 1) температура При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении - в сторону экзотермической (выделение) реакции. 2) давление При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении - в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся. 3) концентрация исходных веществ и продуктов реакции При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при повышении концентрации продуктов реакции - в сторону исходных веществ. 14.Обратимость химических реакций Химическая реакция называется обратимой, если в данных условиях протекает не только прямая реакция (>), но также и обратная реакция т. е. из исходных веществ образуются продукты и одновременно из продуктов получаются реагенты Обратимые реакции не доходят до конца. Концентрации реагентов уменьшаются, что приводит к уменьшению скорости прямой реакции . Скорость же обратной реакции постоянно возрастает, поскольку увеличиваются концентрации продуктов. Когда скорости прямой и обратной реакций станут одинаковыми, наступит состояние химического равновесия, при котором не происходит дальнейшего изменения концентраций реагентов и продуктов. Химическое равновесие не означает, что наступило состояние покоя. Прямая и обратная реакции протекают и в состоянии равновесия, но с одинаковой скоростью. Поэтому оно называетсяподвижным (динамическим)равновесием. Подвижное химическое равновесие можно нарушить, оказывая на систему внешнее воздействие и тем самым изменяя условия протекания реакции – температуру, давление, концентрацию. При любом нарушении(сдвиге)химического равновесия система перейдет (сместится) в другое состояние равновесия. 1)Температура. Повышение температуры смещает равновесие обратимой реакции в сторону процесса, идущего поглощением теплоты (эндотермическое направление), а понижение температуры – в сторону процесса, идущего выделением теплоты (экзотермическое направление). 2)Давление. Изменение давления оказывает влияние только на те системы, где хотя бы одно вещество находится в газообразном состоянии (твердые и жидкие вещества не учитываются, так как их собственный объем весьма мал по сравнению с объемом газов и паров). Увеличение давления в обратимой реакции смещает равновесие с сторону процесса, идущего с уменьшением количества газообразных веществ, т. е. с уменьшением объема, а уменьшение давления – в сторону увеличения количества газообразных веществ, т. е. с увеличением объема: 3) Концентрация. При увеличении концентрации одного из газообразных веществ (реагента или продукта), находящегося в равновесной системе, равновесие смещается в сторону расхода данного вещества. При уменьшении концентрации этого вещества равновесие смещается в сторону образования данного вещества. Изменение содержания твердых и жидких веществ не влияет на состояние равновесия. 15. Электролитическая диссоциация Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении. Диссоциация на ионы в растворах происходит вследствие взаимодействия растворённого вещества с растворителем; по данным спектроскопических методов, это взаимодействие носит в значительной мере химический характер. Наряду с сольватирующей способностью молекул растворителя определённую роль в электролитической диссоциации играет также макроскопическое свойство растворителя — его диэлектрическая проницаемость Слабые электролиты — химические соединения, молекулы которых даже в сильно разбавленных растворах незначительно диссоциированны на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами. К слабым электролитам относится большинство органических кислот и многие органические основания в водных и неводных растворах. Слабыми электролитами являются:
Сильные электролиты — химические соединения, молекулы которых в разбавленных растворах практически полностью диссоциированы на ионы. Степень диссоциации таких электролитов близка к 1. К сильным электролитам относятся многие неорганические соли, некоторые неорганические кислоты и основания в водных растворах, а также в растворителях, обладающих высокой диссоциирующей способностью (спирты, амиды и др.). Примеры сильных электролитов: некоторые кислоты (HClO4, HMnO4, H2SO4, HCl, HBr; HI), гидроксиды щелочных и щёлочноземельных металлов (NaOH, KOH, Ba(OH)2); большинство солей. 16) Многие соли — вещества с ионной связью, состоят из положительных и отрицательных ионов, связанных за счет притягивания противоположных зарядов. При растворении в воде происходит гидратация ионов — взаимодействие ионов с полярными молекулами воды. Это уменьшает притяжение между ионами соли и делает возможным переход гидратированных, т.е. связанных с молекулами воды, ионов в раствор (этому способствует тепловое движение частиц). При выпаривании соли из раствора часть воды может оставаться в составе получаемых кристаллов — кристаллизационная вода. Например, сульфат меди (II) при выпаривании из раствора образует медный купорос (синего цвета), содержащий 5 моль воды на 1 моль соли. Формула медного купороса записывается как CuSO4•5H2O — точка обозначает связь между молекулами воды и ионами в составе сульфата меди(II). При длительном нагревании медного купороса кристаллизационная вода улетучивается и соль приобретает белый цвет. Синий цвет растворов, содержащих ионы меди (II), свидетельствует о том, что в растворе находятся гидратированные ионы. У оснований механизм диссоциации такой же, как и у солей. Растворимые основания — щелочи, — диссоциируют с образованием катиона металла и гидроксид-ионов: NaOH = Na+ + OH– Кислоты содержат ковалентные полярные связи. Так, молекула хлороводорода поляризована: Hδ+Clδ− (δ+ и δ− означают частичные заряды, меньше единицы). При растворении в воде в результате гидратации поляризация молекулы усиливается и происходит разрыв связи между водородом и кислотным остатком с образованием положительного иона водорода и отрицательного иона кислотного остатка. Ионом водорода называют именно гидратированный протон и обозначают H3O+, но для простоты записывают H+ Согласно экспериментальным данным, в растворах не обнаружены частицы H3O+. Анализ показывает наличие катионов, включающих две молекулы воды: H5O2+ Вопрос 17: Обратимые и необратимые химические реакции. Обратимые реакции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), например: 3H2 + N2 ⇌ 2NH3. Направление обратимых реакций зависит от концентраций веществ — участников реакции. Так, в приведённой реакции, при малой концентрации аммиака в газовой смеси и больших концентрациях азота и водорода происходит образование аммиака; напротив, при большой концентрации аммиака он разлагается, реакция идёт в обратном направлении. По завершении обратимой реакции, т. е. при достижении химического равновесия, система содержит как исходные вещества, так и продукты реакции. Простая (одностадийная) обратимая реакция состоит из двух происходящих одновременно элементарных реакций, которые отличаются одна от другой лишь направлением химического превращения. Направление доступной непосредственному наблюдению итоговой реакции определяется тем, какая из этих взаимно-обратных реакций имеет бо́льшую скорость. Например, простая реакция N2O4 ⇌ 2NO2 складывается из элементарных реакций N2O4 ⇌ 2NO2 и 2NO2 ⇌ N2O4. Для обратимости сложной (многостадийной) реакции, например, уже упоминавшейся реакции синтеза аммиака, необходимо, чтобы были обратимы все составляющие её стадии. Необратимые реакции — реакции, при которых взятые вещества нацело превращаются в продукты реакции, не реагирующие между собой при данных условиях, например, разложение взрывчатых веществ, горение углеводородов, образование малодиссоциирующих соединений, выпадение осадка, образование газообразных веществ. Ba(ClO2)2 + H2SO4 → 2HClO2 + BaSO4↓ NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑ Однако надо понимать, что при изменении условий протекания реакции, теоретически возможно сместить равновесие любой реакции. Вопрос 18: Реакции ионного обмена______________________ Ионные реакции – это химические процессы, которые протекают в водном растворе с участием ионов электролитов. Такие реакции могут протекать как с изменением так и без изменения степени окисления: 3Cu0 + 8 HN +5O3 (разб.) à3Сu +2(NO3)2 + 2N +2O| +4H2O 3Cu0 + 8 H + +2NO3 - à3Сu +2 + 2NO| +4H2O NaOH + HCl à NaCl + H2O H+ + OH- à H2O В последнем случае реакции называются реакциями двойного обмена ( или обменными реакциями) Реакции обмена - реакции, происходящие между ионами - частицами, у которых все электроны спарены. Это реакции с ионным механизмом. Если ионы связываются в молекулы полярных соединений или в ионные кристаллы, то обратная реакция невозможна. Поэтому многие реакции ионного обмена необратимы, идут до конца. Реакции в растворах электролитов идут, когда участвующие во взаимодействии ионы полностью или частично уходят из сферы реакции (в виде осадка, газа или слабого электролита). Сумма электрических зарядов левой части уравнения должна быть равна сумме электрических зарядов правой части. Вопрос 19: Сущность окислительно-восстановительных реакций. Окислительно-восстановительные процессы принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике. Окисление-восстановление—один из важнейших процессов природы. Дыхание, усвоение углекислого газа растениями с выделением кислорода, обмен веществ и ряд других химических процессов в основе своей являются окислительно-восстановительными реакциями. Сжигание топлива в топках паровых котлов и двигателях внутреннего сгорания, электролитическое осаждение металлов, процессы, происходящие в гальванических элементах и аккумуляторах, включают реакции окисления-восстановления. Получение элементарных веществ (железа, хрома, марганца, золота, серебра, серы, хлора, йода и т. д. ) и ценных химических продуктов (аммиака, щёлочей, азотной, серной и других кислот) основана на окислительно-восстановительных реакциях. На окислении-восстановлении в аналитической химии основаны методы объёмного анализа: перманганатометрия, йодометрия, броматометрия, и другие, играющие важную роль при контролировании производственных процессов и выполнении научных исследований. В органической химии для проведения ряда химических превращений самое широкое распространение нашли процессы окисления-восстановления. Инертные газы лишь в исключительных случаях способны вступать в окислительно-восстановительные реакции. Вопрос 20: Составление окислительно-восстановительных реакций методом электронного___________. Метод электронного баланса основан на определении общего числа электронов, перемещавшихся от восстановителя к окислителю. Для составления уравнения окислительно-восстановительной реакции необходимо, прежде всего, знать химические формулы исходных веществ и полу-чающихся продуктов. Исходные вещества нам известны, а продукты реакции устанавливаются либо экспериментально, либо на основании известных свойств элементов. Участие воды в реакции выясняется при составлении уравнения. При составлении уравнения окисли-тельно-восстановительной реакции необходимо соблюдать следую-щую логическую последовательность операций: рассмотрим реакцию взаимодействия Sb2S5 и HNO3. 1. Устанавливаем формулы веществ, получающихся в результате реакции: Sb2S5 + HNO3 = H3SbO4+NO+H2SO4 . 2. Определяем степени окисления элементов, которые изменили ее в процессе реакции Sb2S2-5 + HN5+O3 = H3SbO4+N2+O+H2S6+O4 . 3.Определяем изменения, происшедшие в значениях степени окисления и устанавливаем окислитель и восстановитель. В данной реакции степень окисления атомов серы S2- повысилась с 2- до 6+; следовательно, S2- является восстанови-телем. А степень окисления атомов азота N5+ понизилась с 5+ до 2+; следовательно, N5+ является окислителем. На основании этого составляем схему электронного баланса реакции: N5+ + 3e N2+ ¦ 40 окислитель, процесс восстановления S2- - 40e S6+ ¦ 3 восстановитель, процесс окисления Пользуясь правилом электронного баланса, определяем общее число перемещающихся электронов нахождения наименьшего кратного. В данном случае оно равно 120. 4. Находим основные коэффициенты, то есть коэффициенты при окислителе и восстановителе 3 Sb2S5 + 40 HNO3 = H3SbO4 + NO + H2SO4 . 5. Согласно закону сохранения массы расставляем коэффици-енты в правой части уравнения (продукты реакции) перед окисленной и восстановленной формами: 3 Sb2S5 + 40 HNO3 = H3SbO4 + 40 NO + 15 H2SO4 . 6. Проверяем число атомов каждого элемента (кроме водорода и кислорода) в исходных веществах и продуктах реакции и подводим баланс по этим элементам, расставляя коэффициенты: 3 Sb2S5 + 40 HNO3 = 6 H3SbO4 + 40 NO + 15 H2SO4 . 7. Проверяем число атомов водорода в левой и правой частях уравнения и определяем число участвующих в реакции молекул воды 3 Sb2S5 + 40 HNO3 + 4 Н2О = H3SbO4 + 40 NO + 15 H2SO4 . 8. Проверяем сумму атомов кислорода в левой и правой частях уравнения. Если баланс по кислороду сходится, то уравнение реак-ции составлено правильно. Все вышеописанные операции производятся последовательно с одним и тем же уравнением и переписывать реакцию несколько раз не имеет смысла. Уравнение реакции окисления сульфида сурьмы азотной кислотой, с учетом схемы электронного баланса, запишется следующим образом: 3 Sb2S5 + 40 HNO3 + 4 Н2О = H3SbO4 + 40 NO + 15 H2SO4 .
Вопрос 21: Гидролиз солей. Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или молекулярном виде Различают обратимый и необратимый гидролиз солей:
Вопрос 22: Классификации: Все неорганические соединения делятся на две большие группы:
Простые веществапо химическим свойствам делятся на:
Сложные веществапо химическим свойствам делятся на:
бинарные соединения:
| ||||||||||||
