Зачет. Закон и периодическая система химических элементов Д. И. Менделеева в свете учения в строении атома. Развитие изученных знаний о периодическом законе и периодической системе
 Скачать 1.48 Mb. Скачать 1.48 Mb.
|
Лабораторные методы получения альдегидовОкислительные методы
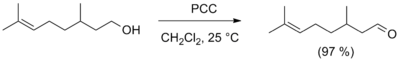 Как метод получения альдегидов может использоваться восстановительный озонолиз симметричных дизамещённых алкенов либо циклических алкенов (в данном случае реакция приводит в образованию диальдегида)
Восстановительные методы
Синтез ароматических альдегидовАльдегидную группу можно ввести в ароматические соединения реакциями Гаттермана, Гаттермана — Коха, Вильсмейера — Хаака, Рихе и Раймера — Тимана. 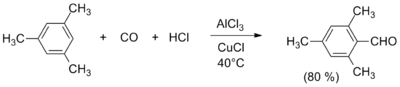
Вопрос 49К одноосновным предельным карбоновым кислотам относятся органические вещества, в молекулах которых имеется одна карбоксильная группа, связанная с радикалом предельного углеводорода или с атомом водорода. 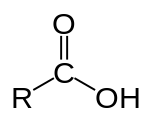 Муравьиная кислота, уксусная кислота, Масляная кислота, Валериановая кислота. Капроновая, каприловая и каприновая кислоты, Энантовая кислота, Пеларгоновая кислота, Лауриновая кислота. Уксусная кислота обладает всеми свойствами карбоновых кислот. Связь между водородом и кислородом карбоксильной группы (−COOH) карбоновой кислоты является сильно полярной, вследствие чего эти соединения способны легко диссоциировать и проявляют кислотные свойства.  В результате диссоциации уксусной кислоты образуется ацетат-ион CH3COO− и протон H+. Уксусная кислота является слабой одноосновной кислотой со значением pKa в водном растворе равным 4,75. Раствор с концентрацией 1.0 M (приблизительная концентрация пищевого уксуса) имеет pH 2,4, что соответствует степени диссоциации 0,4 %. На слабой диссоциации уксусной кислоты в водном растворе основана качественная реакция на наличие солей уксусной кислоты: к раствору добавляется сильная кислота (например, серная), если появляется запах уксусной кислоты, значит, соль уксусной кислоты в растворе присутствует (кислотные остатки уксусной кислоты, образовавшиеся из соли, связались с катионами водорода от сильной кислоты и получилось большое количество молекул уксусной кислоты)[13]. 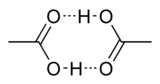 Исследования показывают, что в кристаллическом состоянии молекулы образуют димеры, связанные водородными связями.[14] Уксусная кислота способна взаимодействовать с активными металлами. При этом выделяется водород и образуются соли —ацетаты. Mg(тв) + 2CH3COOH → (CH3COO)2Mg + H2 Уксусная кислота может хлорироваться действием газообразного хлора. При этом образуется хлоруксусная кислота. CH3COOH + Cl2 → CH2ClCOOH + HCl 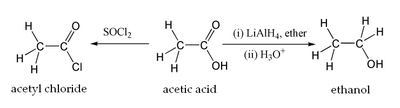 Этим путем могут быть получены также дихлоруксусная (CHCl2COOH) и трихлоруксусная (CCl3COOH) кислоты. Уксусная кислота вступает во все реакции, характерные для карбоновых кислот. Она может быть восстановлена до этанола действием алюмогидрида лития. Уксусная кислота также может быть превращена в хлорангидрид действием тионилхлорида. Натриевая соль уксусной кислоты декарбоксилируется при нагревании со щелочью, что приводит к образованию метана. Карбоновые кислоты - исходные соединения для получения промежуточных продуктов органического синтеза, в частности кетенов, галогенангидридов, виниловых эфиров, галогенкислот. Соли карбоновых кислот и щелочных металлов применяют как мыла, эмульгаторы, смазочные масла; соли тяжелых металлов - сиккативы, инсектициды и фунгициды, катализаторы. Эфиры кислот - пищевые добавки, растворители; моно- и диэфиры гликолей и полигликолей пластификаторы, компоненты лаков и алкидных смол; эфиры целлюлозы - компоненты лаков и пластмассы. Амиды кислот - эмульгаторы и флотоагенты. Муравьиная кислота является сильным восстановителем и обладает сильным бактерицидным эффектом. На этих свойствах основано ее применение в медицине (используется муравьиный спирт - 1,25% спиртовой раствор муравьиной кислоты), как консерванта (при силосировании зелёной массы и фруктовых соков) и для дезинфекции. Также применяется для обработки кожи и отделке текстиля и бумаги. Широко используются эфиры муравьной кислоты - метилформиат, этилформиат и изоамилформиат.[11] Уксусная кислота – в пищевой и химической промышленности (производство ацетилцеллюлозы, из которой получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза красителей, медикаментов и сложных эфиров). В домашнем хозяйстве как вкусовое и консервирующее вещество. В промышленности - растворитель лаков, коагулянт латекса, ацетилирующий агент[12]. Масляная кислота – для получения ароматизирующих добавок (эфиры метилбутират и изоамилбутират - ароматизаторы в промышленности), пластификаторов и флотореагентов, как экстрагент щелочно-земельных металлов.[13] Щавелевая кислота – в металлургической промышленности (удаление окалины), в качестве протравы при крашении, для отбелки соломы, при приготовлении чернил, как реагент в аналитической органической химии[14]. Стеариновая C17H35COOH и пальмитиновая кислота C15H31COOH – в качестве поверхностно-активных веществ (натриевая соль), смазочных материалов в металлообработке, как компонент и эмульгатор кремов и мазей. Эфиры - антиоксиданты и стабилизаторы пищевых продуктов, компоненты клеящих паст и для обработки текстиля и кожи.[15] Олеиновая кислота C17H33COOH – флотореагент при обогащении руд цветных металлов. 51)Сложные эфиры - класс органических соединений, представляющих собой производные неорганических или органических кислот, в которых гидроксильная группа заменена на алкоксильную группу. Взаимодействие карбоновых кислот со спиртами (реакция этерификации) сложных эфиров: 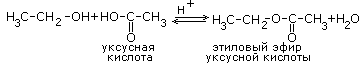 Применяются как растворители, благодаря приятному запаху применяются в пищевой и парфюмер косметической промышленности. В природе выполняют несколько ролей: 1)Строительная- жиры входят в состав клеточной мембраны. 2)Энергетическая – в ходе расщепления жиров происходит высвобождение энергии. 3)Запасающая- жиры запасают энергию. 52) В зависимости от числа углеводородных радикалов, связанных с атомом азота, различают первичные, вторичные и третичные амины, а также четвертичные аммониевые соли. RNH2 RR/NH RR/R//N RR/R// R///N+X- Первичныеамины вторичные амины третичныеамины четвертичные аммониевые соли 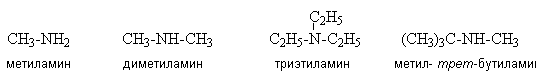 Пример: Химические свойства аминов. Отличительная способность аминов – присоединять нейтральные молекулыс образованием органоаммониевых солей, подобных аммонийным солям в неорганической химии. Растворяясь в воде, амины по такой же схеме захватывают протон, в результате в растворе появляются ионы ОН–, что соответствует образованию щелочной среды, ее можно обнаружить с помощью обычных индикаторов. Получение аминов. В промышленности алифатические амины получают каталитическим взаимодействием спиртов с NH3 при 300–500° С и давлении 1–20 МПа, в результате получают смесь первичных, вторичных и третичных аминов Применение аминов. Амины широко применяются для получения лекарств, полимерных материалов. Анилин — важнейшее соединение данного класса, которое используют для производства анилиновых красителей, лекарств (сульфаниламидных препаратов), полимерных материалов. 53) Он находит широкое применение в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств.Анилин представляет собой бесцветную маслянистую жидкость с характерным запахом . На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит.  Основной способ получения анилина — восстановление нитробензола. В промышленных условиях восстановление проводят водородом при 250-350 °С на никелевом или медном катализаторе. В лаборатории для этой цели используют цинк в кислой среде: С6Н5NО2 + 3Zn + 7HCl → C6H5NH3Cl + 3ZnCl2 + 2Н2О или алюминий в щелочной среде: C6H5NO2 + 2Al + 2NaOH + 4Н2О → C6H5NH2 + 2Na[Al(OH)4]. 54) Аминокислоты - это органические кислоты, у которых атом водорода -углеродного атома замещен на аминогруппу - NH2. Следовательно, по химической природе это -аминокислоты с общей формулой: Из этой формулы видно, что в состав всех аминокислот входят следующие общие группировки: - CH2, - NH2, - COOH. Боковые же цепи (радикалы - R ) аминокислот различаются.   Химические свойства:
H2N – CH2 – COOH + NaOH → H2N – CH2 - COONa + H2O
H2N – CH2 – COOH + HCI → [H3N+ - CH2 – COOH]CI-
H2N – CH2 – COOH ⇄ H3N+ — CH2 – COO-
CH3 – CH(NH2) – COOH + CН2О → CH3 – CH(N=CH2) – COOH + H2O 5. Реакция со спиртами: СН3 – СН(NH2) – СООН + С2Н5ОН ↔ СН3 – СН(NH2) – СООС2Н5 + Н2O 6. Взаимодействие с азотистой кислотой: СН3 – СН(NH2) – СООН + HONO → CH3 – CH2OH + N2↑ + H2O + CO2↑ 7. Гомополиконденсация. Так из ε-аминокапроновой кислоты получают полимер – капрон: nH2N – (CH2)5 – COOH → [-HN – (CH2)5 – CO- ]n + (n – 1)Н2О 8. Сополиконденсация различных аминокислот с образованием полипептидов: R – CH(NH2) – COOH + H2N – CH(R1) – COOH → R – CH (NH2) – C(O) – N(H) –CH(R1) –COOH -H2O
H2N – CH2 – COOH ⇄ H3N+ — CH2 – COO-
CH3 – CH(NH2) – COOH + CН2О → CH3 – CH(N=CH2) – COOH + H2O 5. Реакция со спиртами: СН3 – СН(NH2) – СООН + С2Н5ОН ↔ СН3 – СН(NH2) – СООС2Н5 + Н2O 6. Взаимодействие с азотистой кислотой: СН3 – СН(NH2) – СООН + HONO → CH3 – CH2OH + N2↑ + H2O + CO2↑ 55)   56) Крахмал – основной источник резервной энергии в растительных клетках – образуется в растениях в процессе фотосинтеза и накапливается в клубнях, корнях, семенах: 6CO2 + 6H2O свет, хлорофилл → C6H12O6 + 6O2 nC6H12O6 → (C6H10O5)n + nH2O глюкоза крахмал Крахмал чаще всего получают из картофеля. Для этого картофель измельчают, промывают водой и перекачивают в большие сосуды, где происходит отстаивание. Полученный крахмал еще раз промывают водой, отстаивают и сушат в струе теплого воздуха.  В медицине применяют крахмал как наполнитель, а в хирургии - для приготовления неподвижных повязок. Широко используется в присыпках, мазях, пастах вместе с оксидом цинка, тальком. Внутрь применяют как обволакивающее при желудочно-кишечных заболеваниях. Качественная реакция на крахмал. (C6H10O5)n+nI2=комплекс синефиолетового цвета  57) Сахароза C12H22O11, или свекловичный сахар, тростниковый сахар, в быту просто сахар — дисахарид из группы олигосахаридов, состоящий из двух моносахаридов — α-глюкозы и β-фруктозы. Изомеры сахарозы: С сахарозой гидроксид меди (II) образует голубой раствор: С12H22O11 + Cu(OH)2 = голубой раствор 58) Целлюлоза (клетчатка) – растительный полисахарид, являющийся самым распространенным органическим веществом на Земле. Физические свойства. Это вещество белого цвета, без вкуса и запаха, нерастворимое в воде, имеющее волокнистое строение. Растворяется в аммиачном растворе гидроксида меди (II) – реактиве Швейцера. Нахождение в природе. Этот биополимер обладает большой механической прочностью и выполняет роль опорного материала растений, образуя стенку растительных клеток. В большом количестве целлюлоза содержится в тканях древесины (40-55%), в волокнах льна (60-85%) и хлопка (95-98%). Основная составная часть оболочки растительных клеток. Образуется в растениях в процессе фотосинтеза. Состоит из остатков β - глюкозы  Целлюлоза используется в производстве бумаги, искусственных волокон, пленок, пластмасс, лакокрасочных материалов, бездымного пороха, взрывчатки, твердого ракетного топлива. Гидролиз (C6H10O5)n + nH2O t,H2SO4 → nC6H12O6 глюкоза Гидролиз протекает ступенчато: (C6H10O5)n → (C6H10O5)m → xC12H22O11 → n C6H12O6 (Примечание, m 59) Ферменты— обычно белковые молекулы или молекулы РНК или их комплексы, ускоряющие химические реакции в живых системах. Витамины - органические, биологически активные вещества, необходимые для нормальной жизнедеятельности человека и животных; они играют решающую роль в обмене веществ. Витамины не синтезируются в организме или синтеризуются в недостаточном количестве. Они поступают с растительной или животной пищей. Большинство витаминов участвует в обмене веществ, входя в состав более чем 100 ферментов или конферментов. Все витамины делят на жирорастворимые ( A, D, E, K), и водорастворимые ( B, C, PP и др.). Иногда одной буквой обозначаются несколько веществ или их смеси. Гормоны — биологически активные вещества органической природы, вырабатывающиеся в специализированных клетках желёз внутренней секреции, поступающие в кровь и оказывающие регулирующее влияние на обмен веществ и физиологические функции. Гормоны служат гуморальными (переносимыми с кровью) регуляторами определённых процессов в различных органах и системах. Лекарственные вещества разделяют по двум классификациям: Фармакологическая Химическая Первая классификация более удобна для медицинской практики. Согласно этой классификации, лекарственные вещества делятся на группы в зависимости от их действия на системы и органы. Например: Снотворные и успокаивающие(седативные); Сердечно – сосудистые; Анальгезирующие (болеутоляющие),жаропонижающие и противовоспалительные; Противомикробные (антибиотики,сульфаниламидные препараты и др.); Местно-анестезирующие; Антисептические; Диуретические; Гормоны; Витамины 60) Качественная реакция на белки. Белки выявляются в основном на реакциях, основанных на окрасках.  Ксантопротеиновая реакция. Данная реакция обнаруживает ароматические аминокислоты, входящие в белки (на примере тирозина): (OH)C6H4CH(NH2)COOH + HNO3 —-H2SO4——> (OH)C6H3(NO2)CH(NH2)COOH↓ + H2O — выпадает осадок желтого цвета. 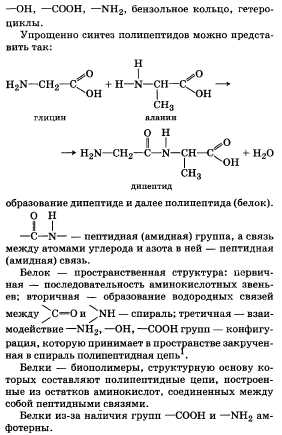 (OH)C6H3(NO2)CH(NH2)COOH + 2NaOH ——-> (ONa)C6H3(NO2)CH(NH2)COONa + H2O — раствор становится оранжевым.  |