Зачет. Закон и периодическая система химических элементов Д. И. Менделеева в свете учения в строении атома. Развитие изученных знаний о периодическом законе и периодической системе
 Скачать 1.48 Mb. Скачать 1.48 Mb.
|
Неорганические вещества, содержащие углерод:Данные вещества традиционно относятся к области неорганической химии:
Металлы - группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск. Характерные свойства металлов
В реакциях чаще всего являются восстановителями окислительно-восстановительных реакциях в водных растворах. Неметаллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов, и проявлению более высокой окислительной активности, чем у металлов. Неметаллы имеют высокие значения сродства к электрону, большую электроотрицательность и высокий окислительно-восстановительный потенциал. Вопрос 25: Электрохимический ряд активности (ряд напряжений, ряд стандартных электродных потенциалов) металлов — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов , отвечающих полуреакции восстановления катиона металла
Ряд напряжений характеризует сравнительную активность металлов в Соли взаимодействуют с металлами — более активные металлы, расположенные левее в электрохимическом ряду напряжений**, вытесняют из солей менее активные металлы. Например, железо вытесняет медь из раствора хлорида меди (II): Fe + CuCl2 = FeCl2 + Cu↓ Вопрос 28: Металлы, их положение в периодической системе химических элементов Д.И. Менделеева, строение их атомов, металлические связи. Общие химические свойства металлов. Положение металлов в периодической системе. Все химические элементы принято делить на металлы и неметаллы. Большинство элементов (более 85 из 109 известных) — это металлы. К металлам относятся s–элементы (элементы IA и IIA групп за исключением водорода и гелия); некоторые p–элементы (Al, Sn, Pb и другие); все d–элементы (элементы побочных подгрупп); все f–элементы (лантаноиды и актиноиды). Так как металлические свойства элементов с увеличением заряда ядра их атомов в периодах ослабевают, а в главных подгруппах усиливаются, то наиболее активные металлы сосредоточены в левом нижнем углу периодической системы элементов. Строение металлов. Отличительные особенности в строении атомов металлов — их большие по сравнению с неметаллами размеры (радиус) и небольшое число электронов на внешнем энергетическом уровне (как правило, 1-2 электрона, реже 3 или 4). Этим объясняется слабая связь внешних (валентных) электронов с ядром и способность атомов металлов легко отдавать эти электроны, превращаясь в положительно заряженные ионы. Этот процесс обратим, катионы металлов могут вновь притягивать к себе электроны (не только «свои», но и «чужие», то есть «потерянные» другими атомами). Иными словами, электроны свободно перемещаются в объеме металла, являются общими, «коллективными», называемыми также «электронным газом». Эти электроны и обеспечивают химическую связь металлов. В отличие от ковалентной связи (чаще всего образуемой парой электронов между двумя соседними атомами), металлическая связь делокализована (многоцентровая). Металлическая связь - это связь в металлах между атомами и ионами, образованная за счет обобществления электронов. Металлическая связь бывает не только в чистых металах но также характерна для смесей разных металов, сплавов в разных агрегатных состояниях. Металлическая связь имеет важное значение и обуславливает основные свойства металлов - электропроводность – беспорядочное движение електронов в объеме металла. Но при небольшой разности потенциалов , чтобы электроны двигались упорядоченно. Металами с лучшей проводимостью являются Ag, Cu, Au, Al. - пластичность Связи между слоями металла не очень значительны, это позволяет перемещать слои под нагрузкой (деформировать металл не ломая его). Наилучше деформирующиеся металы (мягкие)Au, Ag, Cu. - металлический блеск Электронный газ отражает почти все световые лучи. Вот почему чистые металлы так сильно блестят и чаще всего имеют сенрый или белый цвет. Металы являющиеся наилучшими отражателями Ag, Cu, Al, Pd, H Сильные восстановители: Me0 – nē ® Men+ I. Реакции с неметаллами 1) С кислородом: 2) С серой: 3) С галогенами: 4) С азотом: 5) С фосфором: 6) С водородом (реагируют только щелочные и щелочноземельные металлы) II. Реакции с кислотами 1) Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода: III. Взаимодействие с водой 1) Активные (щелочные и щелочноземельные металлы) образуют растворимое основание и водород 2) Металлы средней активности окисляются водой при нагревании до оксида 3) Неактивные (Au, Ag, Pt) - не реагируют. 4) Вытеснение более активными металлами менее активных металлов из растворов их солей Вопрос 29: Кислород. Физические свойства, распространение кислорода в природе. Физиологическое значение кислорода. Его роль в жизни и применение. Кислоро́д — элемент 16-й группы (по устаревшей классификации — главной подгруппы VI группы), второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 8. Обозначается симвом О. Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов. Простое вещество кислород при нормальных условиях — газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород[3]. Жидкий кислород имеет светло-голубой цвет, а твёрдый представляет собой кристаллы светло-синего цвета. Физические св-ва. При стандартных условиях кислород является бесцветным газом, без запаха и вкуса, немного тяжелее воздуха (средняя относительная молекулярная масса воздуха двадцать девять). Кислород мало растворим в воде (в ста объемах воды при температуре двадцать градусов по Цельсию растворяется три целых одна десятая объема кислорода). При температуре -183 ° С газообразный кислород превращается в голубую жидкость проявляет магнитные свойства. Окраска жидкого кислорода обусловлено взаимодействием соседних молекул, и поэтому газообразный кислород не имеет цвета. Магнитные свойства кислорода (жидкий кислород можно привлечь магнитом) используются для определения содержания кислорода в искусственной атмосфере, например, в инкубаторах для выхаживания недоношенных малышей. В таких случаях измеряют магнитные характеристики газовой смеси и по результатам измерений вычисляют концентрацию кислорода. Температура плавления твердого кислорода составляет -218 ° С. Распространение кислорода в природе. Кислород является важнейшей для жизни, поддерживающей дыхание составной частью атмосферного воздуха. Содержание кислорода в сухом воздухе составляет 20,9 об. % или 23,0 вее. %, причем в открытом пространстве содержание кислорода в воздухе очень мало изменяется (не более чем на 0.1 %). Несмотря на то, что при дыхании и за счет процессов горения кислород непрерывно расходуется, его количество все время пополняется благодаря процессам фотосинтеза, происходящим в зеленом веществе растений на солнечном свету. Физиологическая роль кислорода Содержание кислорода в организме взрослого человека состав ляет около 62% от массы тела (43 кг на 70 кг массы тела). Вместе с водородом кислород образует молекулу воды, содер жание которой в организме взрослого человека в среднем состав ляет около 55-65%. Кислород входит в состав белков, нуклеиновых кислот и дру гих жизненно-необходимых компонентов организма. Кислород необходим для дыхания, окисления жиров, белков, углеводов, ами нокислот, а также для многих других биохимических процессов. Обычный путь поступления кислорода в организм лежит че рез легкие, где этот биоэлемент проникает в кровь, поглощается гемоглобином и образует легко диссоциирующее соединение — оксигемоглобин, а затем из крови поступает во все органы и тка ни. Кислород поступает в организм также и в связанном состоя нии, в виде воды. В тканях кислород расходуется преимуществен но на окисление различных веществ в процессе их метаболизма. В дальнейшем почти весь кислород метаболизируется до углерода диоксида и воды, и выводится из организма через легкие и почки. Применение кислорода обусловлено его химическими свойствами. Кислород широко используется как окислитель. Его применяют для сварки и резки металлов, в химической промышленности - для получения различных соединений и интенсификации некоторых производственных процессов. В космической технике кислород применяется для сжигания водорода и других видов топлива, в авиации - при полетах на больших высотах, в хирургии - для поддержания больных с затрудненным дыханием. Неметаллы располагаются в правом верхнем углу периодической системы. Отличительные признаки простых веществ, образованных элементами-неметаллами, обычно определяют в негативном плане: неметаллическими свойствами обладают те простые вещества, которые не являются металлами, т. е. не имеют таких физических свойств, как электронная металлическая проводимость, теплопроводность, металлический блеск, ковкость, тягучесть и т. д. Проявление физических неметаллических свойств, таким образом, сопряжено с отсутствием в простых веществах-неметаллах делокализованных электронов. Это в свою очередь определяется особенностями строения атомов элементов-неметаллов 31) Классификация органических соединений. 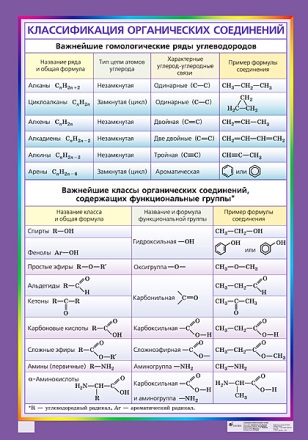 32) Основные положения теории химического строения А.М.Бутлерова. Химическое строение как порядок соединения и взаимного влияния атомов в молекулах. Основные направления развития данной теории. 1. Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается одной структурной формулой (формулой строения). 2. Химическое строение можно устанавливать химическими методами. 3. Свойства веществ зависят от их химического строения. 4. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы - предвидеть свойства. 5. Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга Химические формулы, в которых изображен порядок соединения атомов в молекулах, называются структурными формулами или формулами строения. Значение теории химического строения А.М. Бутлерова: 1) является важнейшей частью теоретического фундамента органической химии; 2) по значимости ее можно сопоставить с Периодической системой элементов Д.И. Менделеева; 3) она дала возможность систематизировать огромный практический материал; 4) дала возможность заранее предсказать существование новых веществ, а также указать пути их получения. Теория химического строения служит руководящей основой во всех исследованиях по органической химии. Основные направления развития двух теорий: Развитие теории происходит по философским законам (по спирали): формулировки положений корректируются в связи с новейшими научными открытиями, однако суть их остается прежней. Философские законы развития: Свойства химических элементов зависят от: - их относительных масс, - зарядов их атомных ядер; - периодичности в изменении внешних электронных слоев атомов; Свойства органических веществ зависят от: - их химического строения, - их пространственного строения, - их электронного строения. 33) Изомерия органических соединений, ее виды. Изомерия — это довольно важная характеристика химических веществ, так как от строения и ориентации молекулы зависят ее свойства. Виды изомерии, а также особенность структуры веществ активно изучаются и по сегодняшний день. Виды изомерии принято делить на две большие группы. Структурная изомерия и ее разновидности: Структурная изомерия — это явление, при котором изомеры различаются между собой химическим строением. Здесь выделяют несколько отдельных видов 1. Изомерия углеродного скелета. Такая форма характерна для углеродов и связана с различным порядком связей между атомами углерода. 2. Изомерия по положению функциональной группы. Это явление связано с различным положением функциональной группы или групп в молекуле. В качестве примера можно привести 4-хлорбутановую и 2-хлорбутановую кислоту. 3. Изомерия кратных связей. Кстати, сюда можно отнести самые распространенные виды изомерии алкенов. Изомеры различаются между собой положением ненасыщенной связи. 4. Изомерия функциональной группы. В этом случае общий состав вещества сохраняется, но свойства и характер самой функциональной группы изменяются. В качестве примера можно привести диметиловый эфир и этанол. Пространственные виды изомерии: Стереоизомерия (пространственная) связана с различной ориентацией молекул одного и того же строения. 1. Оптическая изомерия (энантиомерия). Такая форма связана с вращением функциональных групп вокруг асимметрической связи. В большинстве случаев вещества имеет асимметрический атом углерода, который связан с четырьмя заместителями. Таким образом, происходит вращение плоскости поляризации света. В результате образуются так называемые зеркальные антиподы и изомеры. Интересно, что последние характеризируются практически одинаковыми свойствами. 2. Диастереомерия. Этим термином обозначают такую пространственную изомерию, в результате которой не образуются вещества-антиподы. Стоит отметить, что наличие возможных изомеров в первую очередь связано с количеством углеродных связей. Чем длиннее углеродный скелет, тем большее число изомеров может образоваться. 34) Предельные углеводороды. Гомологический ряд, химические свойства алканов. Алканы (также насыщенные углеводороды, парафины, алифатические соединения) — ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2. Алканы являются насыщенными углеводородами и содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp3-гибридизации — все 4 гибридные орбитали атома С, идентичны по форме и энергии. Гомологический ряд алканов (первые 10 членов) Метан CH4, ЭтанC2H6,Пропан C3H8, БутанC4H10, ПентанC5H12, ГексанC6H14, ГептанC7H16, ОктанC8H18, Нонан C9H20, ДеканC10H22. Хим. Свойства:
CH4 + Cl2 → CH3Cl (хлорметан) + HCl CH3Cl + Cl2 → CH2Cl2 (дихлорметан) + HCl CH2Cl2 + Cl2 → CHCl3 (трихлорметан) + HCl CHCl3 + Cl2 → CCl4 (тетрахлорметан) + HCl.
RH + HNO3 → RNO2 + H2O. Все имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример: CH4 + 2O2 → CO2 + 2H2O + Q. В общем виде реакцию горения алканов можно записать следующим образом: СnН2n+2 +(1,5n+0,5)O2 → nCO2 + (n+1)H2O.
Могут образовываться спирты, альдегиды, карбоновые кислоты. При мягком окислении СН4 в присутствии катализатора кислородом при 200 °C могут образоваться: метанол: 2СН4 + О2 → 2СН3ОН; формальдегид: СН4 + О2 → СН2О + Н2O; муравьиная кислота: 2СН4 + 3О2 → 2НСООН + 2Н2O.
CH3–CH2–CH2–CH3(бутан) ––400°C> CH3–CH3(этан) + CH2=CH2(этилен) Повышение температуры процесса ведет к более глубоким распадам углеводородов и, в частности, к дегидрированию, т.е. к отщеплению водорода. Так, метан при 1500ºС приводит к ацетилену. 2CH4 ––1500°C> H–C=C–H(ацетилен) + 3H2
Образование: 1) В углеродном скелете 2 (этан) или 3 (пропан) атома углерода — получение (терминальных) алкенов, так как других в данном случае не может получиться; выделение водорода: Условия протекания: 400—600 °C, катализаторы — Pt, Ni, Al2O3, Cr2O3. CH3-CH3 → CH2=CH2 + H2 (этан → этен); 2) В углеродном скелете 4 (бутан, изобутан) или 5 (пентан, 2-метилбутан, неопентан) атомов углерода — получение алкадиенов; выделение водорода: CH3-CH2-CH2-CH3 → CH2=CH-CH=CH2 + 2H2 (бутан → бутадиен-1,3 — дегидрирование удалённых связей С—С). 3) В углеродном скелете 6 (гексан) и более атомов углерода — получение бензола и его производных: CH3-CH2-CH2-CH2CH2-CH2-CH2-CH3 (октан) → П.-ксилол, параллельно М.-ксилол, параллельно этилбензол + 4H2. 35) Применение и способы получения алканов. Получение алканов: 1.Действие металлического натрия на моногалогенпроизводные(Реакция Вюрца) C2H5I+CH3I+2Na=C3H8+2NaI 2. Восстановление непредельных углеводородов H3C- CH=CH2+H2s H3C-CH2-CH3 3.Сплавление солей карбоновых кислот со щелочью CH3COONa + NaOH sNa2CO3+CH4s Применениеалканов: Природный газ, основой которого является метан. Из него также производят технический углерод(сажу), который используется в производстве шин, типографской краски. Соединения алканов применяются в качестве хладагентов в домашних холодильниках. Ацетилен, который получают из метана, используется для сварки и резки металлов. Среди соединений алканов можно выделить галогенопроизводные, такие как хлороформ, четырёххлористый углерод, являющиеся одними из лучших растворителей. Алканы могут применяться в качестве моторного топлива (метан, пропан, бутан), которое мало загрязняет окружающую среду. Вазелиновое масло (смесь жидких углеводородов с числом атомов углерода до 15) - прозрачная жидкость без запаха и вкуса, используется в медицине, парфюмерии и косметике. Вазелин (смесь жидких и твёрдых предельных углеводородов с числом углеродных атомов до 25) применяется для приготовления мазей, используемых в медицине. Парафин (смесь твёрдых алканов С19-С35) - белая твёрдая масса без запаха и вкуса (tпл= 50-70°C) - применяется для изготовления свечей, пропитки спичек и упаковочной бумаги, для тепловых процедур в медицине и т.д. 36) Механизм реакции замещения на примере предельных углеводородов. Практическое значение предельных углеводородов. Галогенирование -- это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атому галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно -- за один этап замещается не более одного атома водорода: 1. CH4 + Cl2 > CH3Cl + HCl (хлорметан) 2. CH3Cl + Cl2 > CH2Cl2 + HCl (дихлорметан) 3. CH2Cl2 + Cl2 > CHCl3 + HCl (трихлорметан) 4. CHCl3 + Cl2 > CCl4 + HCl (тетрахлорметан). Под действием света молекула хлора распадается на радикалы, затем они атакуют молекулы алкана, замещая у них атом водорода, в результате этого образуются метильные радикалы СН3, которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы. Нитрование (реакция Коновалова) Алканы реагируют с 10 % раствором азотной кислоты или оксидом азота N2O4 в газовой фазе при температуре 140 °C и небольшом давлении с образованием нитропроизводных. Реакция также подчиняется правилу Марковникова. RH + HNO3 = RNO2 + H2O Все имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов. 1) метанв составе природного газа находит все более широкое применение в быту и на производстве; 2) пропан и бутанприменяются в виде «сжиженного газа», особенно в тех местностях, где нет подвода природного газа; 3) жидкие углеводороды используются как горючее для двигателей внутреннего сгорания в автомашинах, самолетах; 4) метанкак доступный углеводород в большей степени используется в качестве химического сырья; 5) реакция горения и разложения метанаиспользуется в производстве сажи, идущей на получение типографской краски и резиновых изделий из каучука; 6) высокая теплота сгорания углеводородов обусловливает использование их в качестве топлива; 7) метан– основной источник получения водорода в промышленности для синтеза аммиака и ряда органических соединений. Наиболее распространенный способ получения водорода из метана – взаимодействие его с водяным паром. Реакция хлорирования служит для получения хлорпроизводного метана 37) Нефть, ее свойства и состав. Продукты фракционной перегонки нефти. Охрана окружающей среды при нефтепереработке и транспортировке нефтепродуктов. Нефть – это маслянистая и горючая жидкость, которая распространена в зоне осадочной оболочки земной коры. Она является одним из самых важных полезных ископаемых для человека. Нефть представляет собой весьма сложную смесь цикланов, аренов и алканов. Также в ней присутствуют кислородные, сернистые и азотистые соединения. В составе нефти обнаружено свыше тысячи специфических органических веществ, которые содержат около девяноста процентов углерода, пятнадцати процентов водорода, пяти процентов серы, одного процента азота и трех процентов кислорода. Также нефть включает и небольшую примесь соединений минерального характера. Зольность нефти очень мала, она не превышает и одной десятой процента. Нефть бывает трех видов:
Сгорает нефть при теплоте около 43,7-46,2 МДж/кг, что является ее огромным преимуществом среди других горючих веществ. В состав нефти могут входить и легкие фракции, которые кипят при двухстах градусах по Цельсию. Они в основном состоят из метановых углеводородов, то есть алканов. Содержание таких легких фракций в нефтяных продуктах, добытых на разных местонахождениях, может сильно отличаться. Циклоалканы, а также углеводороды ароматического типа, то есть арены, в составе нефти имеют существенное значение. Свойства нефти, по которым идет основное определение высоты ее качества, включают в себя: 1. Плотность. В отношении нефти чаще всего имеют в виду ее плотность по отношению к дистиллированной воде. Плотность нефти обычно варьирует от 0,8 до 0,9 г/см3, но встречаются также виды нефти, плотность которых может достигать и 0,98 г/см3. 2. Вязкость. Выделяют условную, кинематическую и динамическую вязкость. 3. Молекулярная масса. Это самый важный показатель качества нефтяных продуктов. Молекулярная масса большей части нефтепродуктов не превышает 300 г/моль. 4. Показатель преломления. Это очень важный показатель для нефтепродуктов, которые являются сложными смесями различных веществ. 5. Фракционный состав. Все вещества, которые даже в малом количестве входят в состав нефти, имеют огромное значение для ее качества. Фракционной перегонкой нефти называется процесс термического разделения нефти на части (фракции) без заметного разложения содержащихся в ней углеводородов. Фракционная перегонка производится в высокопроизводительных установках непрерывного действия Обычно такая установка состоит из трубчатой печи, насоса, нагнетающего нефть в трубчатую печь, фракционной колонны, в которой нефть, перегретая в трубчатой печи, разделяется из фракции, отбираемые из колонны на различной ее высоте, и других вспомогательных устройств – конденсаторов, водоотделителей и т. д. Продукты, получаемые из нефти в результате фракционной перегонки, состоят из бензина, лигроина, керосина, газойля и остатка от перегонки – мазута. Охрана. Экологические проблемы обострены во всех нефтеперерабатывающих и нефтехимических регионах России. Предполагается: ·- повышение глубины переработки нефти с 62-63% до 73-75%, а в перспективе к 2010 году - до 82-85%; ·- улучшение качества моторных топлив, масел и других продуктов нефтепереработки и нефтехимии; ·- существенное улучшение экологической обстановки на предприятиях и снижение энергетических и материальных затрат на переработку нефти. 38) Циклопарафины, их химическое состояние, свойства, нахождение в природе, практическое значение. В отличии от остальных предельных углеводородов, в молекулах которых все углеродные атомы образуют открытые цепи, имеются углеводороды с замкнутыми цепями (циклами). Так, например, при действии на 1,5-дихлорпентан активным металлом цепь углеродных атомов замыкается и образуется циклический углеводород циклопентан:  Общая формула циклопарафинов CnH2n. Нахождение в природе Циклопарафины главным образом находятся в составе некоторых нефтей. Отсюда и другое название циклопарафинов — нафтены. Пяти- и шестичленные циклопарафины были впервые выделены из нефти и изучены профессором Московского университета В. В. Морковниковым. По химическим свойствам малые и обычные циклы существенно различаются между собой. Циклопропан и Циклобутан склонны к реакциям присоединения, то есть сходны в этом отношении с алкенами. Циклопентан и Циклогексан по своему химическому поведению близки к алканам, так как вступают в реакции замещения. 1. Циклопропан и циклобутан способны присоединять бром: С3H6 + Br2 → BrCH2—CH2—CH2Br 2. Циклопропан, циклобутан и циклопентан могут присоединять водород, давая соответствующие нормальные алканы. Присоединение происходит при нагревании в присутствии никелевого катализатора: С4H8 + H2 → CH3—CH2—CH2—CH3 Из циклопарафинов практическое значение имеют циклогексан, метилциклогексан и некоторые другие. В процессе ароматизации нефти эти соединения превращаются в ароматические углеводороды — в бензол, толуол и другие вещества, которые широко используются для синтеза красителей, медикаментов и т. д. Циклопропан применяют для наркоза. 39) Непредельные углеводороды ряда этилена, общая формула и химические свойства. Применение этиленовых углеводородов в медицине. Алке́ны (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n. Атомы углерода при двойной связи находятся в состоянии sp² гибридизации, и имеют валентный угол 120°. Простейшим алкеном является этилен (C2H4) Хим.свойства Реакции присоединения: СH2=CH-CH3 + H2 → CH3-CH2-CH3 CH2=CH-CH3 + Br2 → CH2Br-CHBr-CH3 - качественная реакция на алкены — обесцвечивание бромной воды. Присоединение по правилу Марковникову: водород присоединяется к наиболее гидрогенезированному (= к тому, у которого больше водородов) атому углерода при двойной связи: СH2=CH-CH3 + HCl = CH3-CHCl-CH3 Окисление алкенов: 1)В нейтральной (или слабощелочной среде: СH2=CH2 → CH2(OH) — CH2(OH) — схематичное уравнение 3СH2=CH2 + 2KMnO4 + 4H2O = 3C2H4(OH)2 + 2MnO2 + 2KOH — полное уравнение 2)В кислой среде — идет разрыв двойной связи: R-СH2=CH2-R → 2R-COOH — схематичное уравнение полное сгорание: С2H4 + 3O2 = 2CO2 + 2H2O Реакция полимеризации: n СH2=CH2 → n(-CH2-CH2-) Применение: При взаимодействии этилена с хлороводородом образуется этилхлорид, который используют в медицине для проведения местной анестезии. Применение алкенов также связано с их способностью реагировать с водой, образуя при этом спирты. Так, из этилена в процессе реакции гидратации получается этиловый спирт. Нашли свое применение в качестве сырья для производства органических соединений, лаков, пластических масс, средств косметической промышленности и окиси алкенов. 40) Механизм реакции присоединения на примере непредельных углеводородов ряда этилена. Правило Марковникова. Применение этиленовых углеводородов в органическом синтезе. Рассмотрим этот механизм на примере реакции присоединения бромоводорода к молекуле этилена.  Несмотря на то, что реакция гидробромирования описывается очень простым равнением, ее механизм включает несколько стадий. Стадия 1. На первой стадии молекула галогеноводорода образует с π-электронным облаком двойной связи неустойчивую систему – «π-комплекс» за счет частичной передачи π-электронной плотности на атом водорода, несущий частичный положительный заряд.  Стадия 2. Связь водород-галоген разрывается с образованием электрофильной частицы Н+, и нуклеофильной частицы Br-. Освободившийся электрофил Н+ присоединяется к алкену за счет электронной пары двойной связи, образуя σ-комплекс – карбокатион.  Стадия 3. На этой стадии к положительно заряженному карбокатиону присоединяется отрицательно заряженный нуклеофил с образованием конечного продукта реакции. 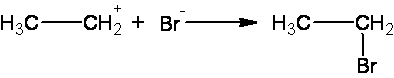 Правило Марковникова — в органической химии правило, используемое для предсказания региоселективности реакции присоединения протонных кислот и воды к несимметричным алкенам и алкинам. Наиболее часто данное правило формулируют следующим образом: при присоединении протонных кислот и воды к несимметричным алкенам и алкинам атом водорода присоединяется к наиболее гидрогенизированному атому углерода. Впервые правило было предложено русским химиком В. В. Марковниковым в 1869 году . 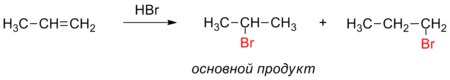 Реакция протекает в две стадии. На первой, медленной стадии происходит присоединение протона H+ к двойной связи: при этом протон может связываться с одним из двух атомов углерода, образующих двойную связь. Образующиеся карбокатионы И1 и И2 имеют различную энергию (устойчивость), поскольку положительный заряд в них делокализуется с разной эффективностью. По этой причине вторичный карбокатион И2 является более устойчивым, и соответствующий ему бромид П2 образуется в большем количестве. При более строгом рассмотрении необходимо сравнивать устойчивости не интермедиатов, а двух альтернативных переходных состояний на стадии образования карбокатионов, то есть энергии активации двух параллельных процессов. Для некоторых реакций различие этих величин достигает 25—30 кДж/моль. 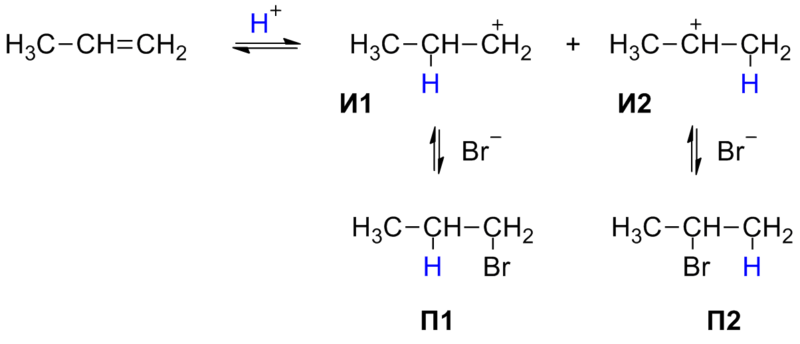 Благодаря высокой химической активности углеводороды ряда этилена являются ценным сырьем для синтеза многих органических веществ. Вопрос 41 Алкадиены — класс углеводородов, содержащих две двойных связи углерод-углерод В зависимости от взаимного расположения двойных связей, диены подразделяются на три группы:
Обычно к диенам относят ациклические и циклические образующие гомологические ряды общих формул и соответственно, ациклические диены являются структурными изомерами алкинов. Получение:
2CH3-CH2-OH --Al2O3, ZnO, t--> CH2=CH-CH=CH2 + 2H2O + H2 Формально эту реакцию можно представить как дегидратацию двух молекул этилового спирта с одновременным межмолекулярным дегидрированием.
CH2Br-CH2-CH2-CH2Br + KOH → CH2=CH-CH=CH2 + 2KBr + 2H2O Применение: Для синтеза каучуков. В результате реакции полимеризации соответствующих мономеров. Вопрос 42 Ацетилен — непредельный углеводород C2H2. Имеет тройную связь между атомами углерода, принадлежит к классу алкинов. Физические свойства: При нормальных условиях — бесцветный газ, легче воздуха. Чистый 100 % ацетилен не обладает запахом, однако технический ацетилен содержит примеси, которые придают ему резкий запах. Малорастворим в воде, хорошо растворяется в ацетоне. Ацетилен требует большой осторожности при обращении. Может взрываться от удара, при нагреве до 500 °C или при сжатии при комнатной температуре. Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки. Для хранения ацетилена используются специальные баллоны, заполненные пористым материалом, пропитанным ацетоном[5]. Химические свойства: Для ацетилена (этина) характерны реакции присоединения: Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания. При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения . Ацетилен обесцвечивает бромную воду и раствор перманганата калия. Реагирует с аммиачными растворами солей Cu(I) и Ag(I) с образованием малорастворимых, взрывчатых ацетиленидов - эта реакция используется для качественного определения ацетилена и его отличия от алкенов (которые тоже обесцвечивают бромную воду и раствор перманганата калия). Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации) Способ производства В лаборатории ацетилен получают действием воды на карбид кальция ,а также при дегидрировании двух молекул метана при температуре свыше 1400 °C: Применение: Ацетилен используют: 1)для сварки и резки металлов, 2)как источник очень яркого, белого света в автономных светильниках, где он получается реакцией 3)карбида кальция и воды (см. карбидная лампа), 4)в производстве взрывчатых веществ (см. ацетилениды), 5)для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука,ароматических углеводородов. 6)для получения технического углерода 7)в атомно-абсорбционной спектрофотометрии при пламенной атомизации 8)в ракетных двигателях Вопрос 43 Ароматические соединения — циклические органические соединения, которые имеют в своём составе ароматическую систему. Основными отличительными свойствами являются повышенная устойчивость ароматической системы и, несмотря на ненасыщенность, склонность к реакциям замещения, а не присоединения. Химические свойства: 1.реакции замещения: а)в присутствии катализатора – Солей железа (III) –бензол вступает в реакцию замещения, так же он реагирует и с хлором. Б)взаимодействие с азотной кислотой 2.реакции присоединения А)при действии солнечного света или ультрафиолетовых лучей. На свету присоединяется хлор и образуется гексахлорциклогексан (гексахлоран). Эта реакция используется и в промышленности, т.к. гексахлоран применяют для борьбы с насекомыми (инсектицид): Б)гидрирование 3. реакции окисления А) при действии энергичных окислителей на гамологи бензола окислению подвергаются только боковые цепи Б)бензол и его гомологи на солнце горят коптящем пламенем Применение: Продукт для получения красителей, медикоментов, взрывчатых веществ, инсектицидов, пластмасс и синтетических волокон. Хороший растворитель многих органических веществ. Получение: Получение. Бензол и его гомологи в больших количествах получа ют из нефти и каменноугольной смолы, образующейся при сухой перегонке каменного угля (коксовании). Сухая перегонка производит ся на коксохимических и газовых заводах Вопрос 44 Спиртами называют производные углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильными (гидроксо) группами. Одноатомные предельные спирты- содержат одну гидроксо-группу. 1.Спирты реагируют со щелочными металлами (Na, K и т.д.) с образованием алкоголятов 2) Взаимодействие спиртов с кислотами называют реакцией этерификации. В результате ее образуются сложные эфиры 3) При высокой температуре кислород воздуха окисляет спирты 4) При пропускании паров первичных и вторичных спиртов над поверхностью наколенных мелкораздробленных металлов (Cu, Fe)происходит их дегидрирование Применение: Получение растворителей, сырья в органическом синтезе, синтетического каучука, лекарственных препаратов, парфюмерной продукции. уксусной кислоты, добавок, улучшающих св - ва бензина и моторного топлива, алкогольных напитков алкоголь – это настоящий наркотик, поэтому он не только разрушает все органы и системы организма, но и вызывает стойкое привыкание. Также в юности алкоголь быстрее начинает воздействовать на человека, что бесспорно увеличивает его пагубное влияние. Человек, который пьет, с каждым днем все меньше контролирует себя и свою тягу к спиртному. Он просто не может противиться искушению выпивки. Ни один орган не может его избежать, но прежде всего, страдают клетки головного мозга. начинается деградация интеллектуальных способностей. В первую очередь вредное воздействие отражается на центрах самоконтроля и внимания. Самой первой стадией алкогольного опьянения считается излишняя легкомысленность, веселость и болтливость. Следующая стадия – это чаще всего немотивированная агрессия или депрессия. Алкоголизм и состояние похмелья практически всегда сопровождается мелкой и даже значительной дрожью в конечностях. Это свидетельствует о серьезных сбоях в психической деятельности. Люди, страдающие зависимостью от спиртных напитков, часто болеют такими недугами нервной системы, как корсаковский психоз или белая горячка. Алкоголь очень негативно воздействует на желудочно-кишечный тракт. Так регулярное потребление спиртных напитков часто вызывает рак желудка. Через некоторое время уменьшается мышечная сила, а это приводит к нарушению координации, и как следствие к авариям на производстве. Ученые доказали, что алкоголь может спровоцировать развитие гипертонии. Наиболее патологическим воздействием спирт обладает на функциональную деятельность человеческого мозга. Вопрос 46 Этиленгликоль (гликоль; 1,2-диоксиэтан; этандиол-1,2), HO—CH2—CH2—OH — двухатомный спирт, простейший представитель полиолов (многоатомных спиртов). В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу. Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
Этиленгликоль также применяется:
Глицерин (1,2,3-триоксипропан, пропантриол-1,2,3) — простейший представитель трёхатомных спиртов. Представляет собой вязкую прозрачную жидкость. Область применения глицерина разнообразна: пищевая промышленность, табачное производство, медицинская промышленность, производство моющих и косметических средств, сельское хозяйство, текстильная, бумажная и кожевенная отрасли промышленности, производство пластмасс, лакокрасочная промышленность, электротехника и радиотехника (в качестве флюса при пайке). Глицерин относится к группе стабилизаторов обладающих свойствами сохранять и увеличивать степень вязкости, а так же консистенции пищевых продуктов. Зарегистрирован как пищевая добавка Е422, и используется в качествеэмульгатора, при помощи которого смешиваются различные несмешиваемые смеси. Поскольку глицерин хорошо поддается желированию, в отличие например от этанола, и как и этанол горит без запаха и чада, его используют для изготовления высококачественных прозрачных свечей. Технический глицерин используется для заполнения виброустойчивых манометров типа ДМ8008ВУ, заполнения торцевых уплотнений мешалок и др. Также глицерин используется при изготовлении динамита. 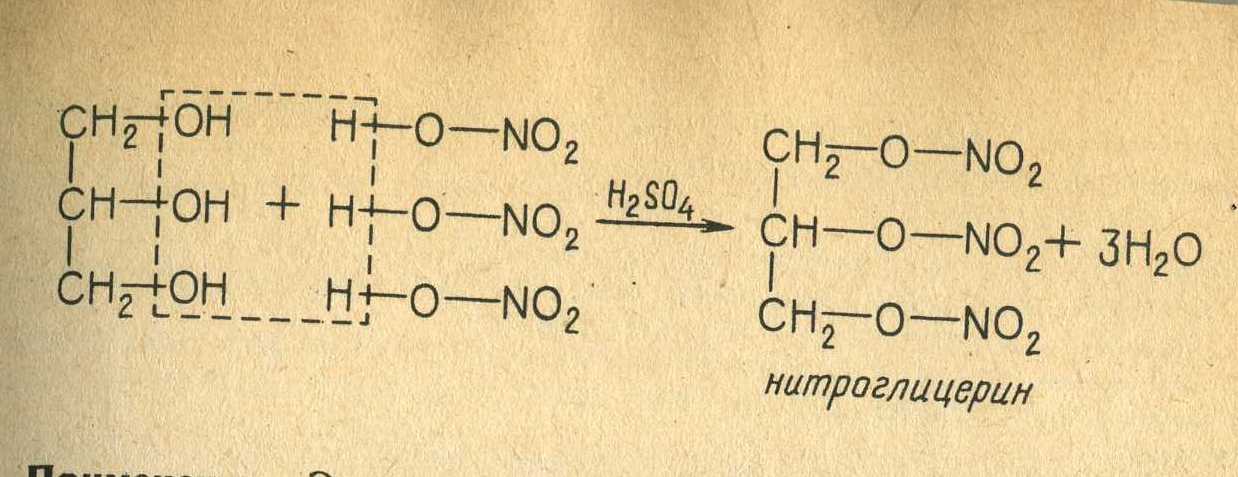  Вопрос 47 Фенол (гидроксибензол, устаревшее карболовая кислота) C6H5OH — простейший представитель классафенолов. Бесцветные игольчатые кристаллы, розовеющие на воздухе из-за окисления, приводящего к образованию окрашенных веществ. Обладают специфическим запахом (таким, как запах гуаши, т. к. в состав гуаши входит фенол). Умеренно растворим в воде (6 г на 100 г воды), в растворах щелоче́й, в спирте, в бензоле, вацетоне. 5 % раствор в воде — антисептик, широко применяемый в медицине. |
