Занятие 8 основные понятия биоорганической химии. Изомерия органических соединений
 Скачать 0.85 Mb. Скачать 0.85 Mb.
|
                                 Занятие 8 Занятие 8ОСНОВНЫЕ ПОНЯТИЯ БИООРГАНИЧЕСКОЙ ХИМИИ. ИЗОМЕРИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Органические соединения классифицируют по: а) строению углеродной цепи; б) наличию функциональных групп. Функциональные группы – это заместители неуглеводородного характера, определяющие принадлежность вещества к определенному классу и одновременно его типичные химические свойства. Классификация органических соединений по функциональным группам:
Классификации органических веществ по строению радикала: Органические вещества ациклические циклические алкены CnH2n алкины CnH2n-2 алканы CnH2n+2 гетероциклические карбоциклические циклоалканы арены предельные непредельные N пиррол CH≡CH ацетилен sp-гибридизация σ, 2π-связи < 1800 CH2=CH2 этен CH3-CH=CH2 пропен Sp2-гибридизация σ, π-связи < 1200 Sp2-гибридизация σ, π-связи < 1200 CH4 – метан C2H6 – этан Sp3-гибридизация σ-связи < 109028׳ Sp3-гибридизация σ-связи < 109028׳ H Циrлопропан N Бензол N циклогексан H CH3 CH3 имидазол толуол Общие формулы биологически важных классов органических соединений: спирты – R-OH Фенолы – OH Тиолы – R-SH Амины – R-NH2 простые эфиры – R1-O-R2 сульфиды – Ме2Sх альдегиды – R-COH кетоны – R1-C-R2 ׀׀ O карбоновые кислоты – R-COOH
В органических соединениях углерод может находиться в одном из 3-х валентных состояний: sp3-гибридизация, при которой происходит смешивание одной s и трех p – орбиталей, с возникновением 4-х гибридизованных орбиталей, расположенных в пространстве под углом 109°28´ по отношению друг к другу. Углерод в таком состоянии получил название тетрагонального атома углерода и встречается в предельных органических соединениях. sp2-гибридизация, при которой происходит смешивание одной s- и двух p-орбиталей, с возникновением 3-х гибридизованных орбиталей, расположенных в одной плоскости, под углом 120° по отношению друг к другу. Негибридозованная p-орбиталь расположена перпендикулярно плоскости гибридизованных орбиталей. Углерод в таком состоянии называют тригональным, и встречается он в соединениях с двойными связями. sp-гибридизация, при которой происходит смешивание одной s- и одной p-орбитали с возникновением 2-х гибридизованных орбиталей, расположенных в пространстве под углом 180° (линейно), а две негибридизованные p-орбитали расположены взаимно перпендикулярно друг другу. Такой вид гибридизации (sp-гибридизация) характерен для углерода, связанного тройной связью. При образовании ковалентной связи в молекулах органических соединений общая электронная пара заселяет связывающие молекулярные орбитали (МО), имеющие более низкую энергию. В зависимости от формы МО – σ-МО или π-МО – образующиеся связи относят к σ- или p-типу. σ-Связь – ковалентная связь, образованная при перекрывании s-, p- и гибридных атомных орбиталей (АО) вдоль оси, соединяющей ядра связываемых атомов (т. е. при осевом перекрывании АО). 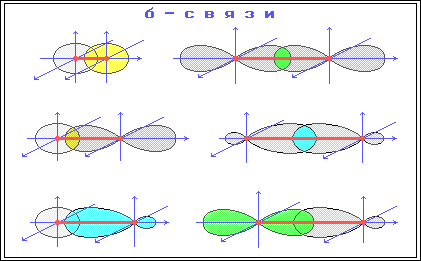 π-Связь – ковалентная связь, возникающая при боковом перекрывании негибридных р-АО. Такое перекрывание происходит вне прямой, соединяющей ядра атомов. π-Связи возникают между атомами, уже соединенными σ-связью (при этом образуются двойные и тройные ковалентные связи) . π-Связь слабее σ-связи из-за менее полного перекрывания р-АО. 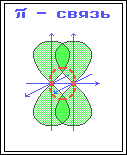 Различное строение σ- и π-молекулярных орбиталей определяет характерные особенности σ- и π-связей. 1. σ-Связь прочнее π-связи. Это обусловлено более эффективным осевым перекрыванием АО при образовании σ-МО и нахождением σ-электронов между ядрами. 2. По σ-связям возможно внутримолекулярное вращение атомов, т. к. форма σ-МО допускает такое вращение без разрыва связи (cм аним. Картинку внизу)). Вращение по двойной (σ + π) связи невозможно без разрыва π-связи! 3. Электроны на π-МО, находясь вне межъядерного пространства, обладают большей подвижностью по сравнению с σ-электронами. Поэтому поляризуемость π-связи значительно выше, чем σ-связи. Длина связи – расстояние между ядрами атомов, ее образовавшими. С увеличением доли s-АО в гибридной орбитали (с увеличением ненасыщенности) длина связи уменьшается, ибо s-орбиталь лежит ближе к ядру (имеет меньший радиус), чем р-орбиталь. Энергия связи – энергия, необходимая для гомолитического разрыва связи на радикалы или на атомы. Табл. 1. Некоторые характеристики связей
То обстоятельство, что p-связь слабее s-связи, заставляет сделать вывод, что для ненасыщенных соединений должны быть характерны, т.е. идти в первую очередь, реакции присоединения по кратным связям, ибо на их разрыв идет меньше энергии и они, кроме того, более доступны с пространственной точки зрения. Энергия связи зависит также от природы элемента, атомы которого образуют связь. Так, связи С-Hal составляют следующий ряд прочности: C-F > C-Cl > C-Br > C-І . Прочность связи в этом ряду уменьшается с увеличением порядкового номера элемента, ибо при этом растет радиус атома и длина связи (с увеличением расстояния электростатическое взаимодействие уменьшается). В соединениях углерода с элементами ІІ периода прочность (энергия) связи возрастает в ряду: С-N < C-O < C-F , т.е. с увеличением электроотрицательности элемента, радиус которого при этом уменьшается (электростатическое взаимодействие усиливается). Полярность связи При образовании ковалентной связи между двумя одинаковыми атомами ее электронное облако симметрично расположено между ядрами связываемых атомов, связь неполярна, и молекула неполярна (этан, этилен, ацетилен). Если ковалентную связь образуют различные атомы с различной электроотрицательностью, то возникает полярная ковалентная связь, поскольку электроны связи сдвинуты к электроотрицательному атому , а на атомах возникают эффективные частичные заряды. Эта полярность постоянна (стационарна), ибо обусловлена внутренними факторами, а именно – природой взаимодействующих атомов и характером связи между ними. Различную электроотрицательность имеют атомы одного и того же элемента, если эти атомы находятся в различном состоянии гибридизации. Так, для углерода:
Таким образом, электроотрицательность атома возрастает с увеличением доли s-орбитали в гибридной орбитали. Появление полярной связи в молекуле обуславливает возникновение полярности всей молекулы, а это влияет на свойства вещества. Так, полярные вещества, в отличие от неполярных, лучше растворяются в полярных растворителях, обычно имеют более высокие температуры кипения и плавления, легче реагируют по ионным механизмам.
Сопряженная система возникает при присоединении к sp2-гибриди-зованному атому углерода в молекуле заместителя, содержащего в своём составе двойную связь (π,π-сопряжение) или имеющий р-орбиталь (р,π-сопряжение). При сопряжении происходит делокализация электронов – π-электронная плотность распределяется по всей π-орбитальной системе, а не сосредоточена между двумя соседними р-орбиталями. В случае р,π-сопряжения электронная плотность делокализуется между орбиталями π-связи и р-орбиталью гетероатома – О••, N••, S•• и др., несущей неподелённую пару электронов, неспаренный электрон или свободной. Сопряжение – энергетически выгодный процесс, т.к. в результате делокализации электронов выделяется энергия, и молекула становится термодинамически более устойчивой. Степень термодинамической устойчивости количественно оценивают как разность энергии молекул с сопряжёнными и изолированными связями – энергия сопряжения (энергия делокализации). 3.1. Системы с открытой цепью сопряжения π,π-Сопряжение. Простейшим представителем π,π-сопряженных систем с углеродной цепью служит бутадиен-1,3 (рис. 1, а). Атомы углерода и водорода и, следовательно, все σ-связи в его молекуле лежат в одной плоскости, образуя плоский σ-скелет. Атомы углерода находятся в состоянии sр2-гибридизации. Негибридизованные р-АО каждого атома углерода расположены перпендикулярно плоскости σ-скелета и параллельно друг другу, что является необходимым условием для их перекрывания. Перекрывание происходит не только между р-АО атомов С-1 и С-2, С-3 и С-4, но и между р-АО атомов С-2 и С-3, в результате чего образуется охватывающая четыре атома углерода единая π-система, т. е. возникает делокализованная ковалентная связь (см. рис. 1, б). 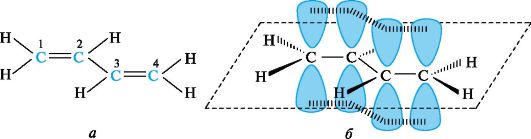 Рис. 1. Атомно-орбитальная модель молекулы бутадиена-1,3 Это отражается в изменении длин связей в молекуле. Длина связи С-1-С-2, а также С-3-С-4 в бутадиене-1,3 несколько увеличена, а расстояние между С-2 и С-3 укорочено по сравнению с обычными двойными и одинарными связями. Другими словами, процесс делокализации электронов приводит к выравниванию длин связей. Аналогичный эффект наблюдается в изопрене (метилбутадиене-1,3), который является мономером природного каучука: СН2=С-СН=СН2 ׀ СН3
Углеводороды с большим числом сопряженных двойных связей распространены в растительном мире. К ним относятся, например, каротиноиды – каротин (пигмент моркови и красного перца), витамин А в формах ретинола и ретиналя, ликопин (пигмент помидора). Все они относятся к классу природных веществ терпеноидов. Имеют окраску от желтого до красного цветов, что связано с наличием длинной цепи сопряжения. Каротиноиды хорошо растворимы в жирах, их называют липохромами; накапливаясь в подкожно-жировой клетчатке при избыточном поступлении в организм, придают коже оранжево-желтый оттенок. Каротиноиды относятся к биологически активным веществам-витаминам Витамин А участвует в акте фоторецепции, обладает антиоксидантным действием, используется как лекарственный препарат.
Открытая система сопряжения может включать и гетероатомы. Примером открытых π,π-сопряженных систем с гетероатомом в цепи могут служить α,β-ненасыщенные карбонильные соединения. Например, альдегидная группа в акролеине CH2=CH-CH=O является участником цепи сопряжения трех sр2-гибридизованных атомов углерода и атома кислорода. Каждый из этих атомов вносит в единую π-систему по одному р-электрону. | ||||||||||||||||||||||||||||||||||||||||||||||||||||

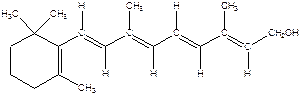 Ретинол
Ретинол 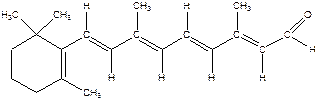 Ретиналь
Ретиналь