Занятие 8 основные понятия биоорганической химии. Изомерия органических соединений
 Скачать 0.85 Mb. Скачать 0.85 Mb.
|
|
pπ-Сопряжение. Этот вид сопряжения чаще всего проявляется в соединениях, содержащих структурный фрагмент -CH=CH-X, где X - гетероатом, имеющий неподеленную пару электронов (прежде всего O или N). К ним относятся, например, виниловые эфиры, в молекулах которых осуществляется сопряжение двойной связи с р-орбиталью атома кислорода. Делокализованная трехцентровая связь образуется путем перекрывания двух р-АО sр2-гибридизованных атомов углерода и одной р-АО гетероатома с парой π-электронов. 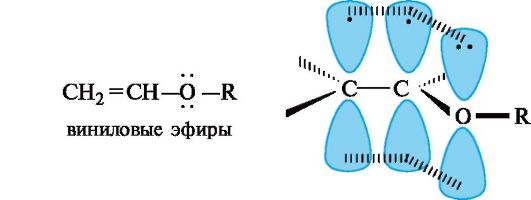 Образование аналогичной делокализованной трехцентровой связи имеется в карбоксильной группе. Здесь в сопряжении участвуют π-электроны связи С=О и π-электроны атома кислорода группы ОН. К сопряженным системам с полностью выровненными связями и зарядами относятся отрицательно заряженные частицы, например ацетат-ион.  Направление смещения электронной плотности обозначается изогнутой стрелкой. Существуют и другие графические способы отображения результатов сопряжения. Так, структура ацетат-иона (I) предполагает, что заряд равномерно распределен по обоим атомам кислорода (как показано на рис. 2, что соответствует действительности). 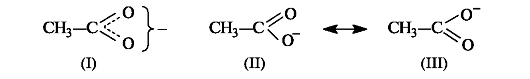 Структуры (II) и (III) применяются в теории резонанса. Согласно этой теории реальная молекула или частица описывается набором определенных так называемых резонансных структур, которые отличаются друг от друга только распределением электронов. В сопряженных системах основной вклад в резонансный гибрид вносят структуры с различным распределением π-электронной плотности (двусторонняя стрелка, связывающая эти структуры, является специальным символом теории резонанса).
Предельные (граничные) структуры в действительности не существуют. Однако они в той или иной степени «вносят вклад» в реальное распределение электронной плотности в молекуле (частице), которую представляют в виде резонансного гибрида, получающегося путем наложения (суперпозиции) предельных структур. В ρ,π-сопряженных системах с углеродной цепью сопряжение может осуществляться при наличии рядом с π-связью атома углерода с негибридизованной р-орбиталью. Такими системами могут быть промежуточные частицы - карбанионы, карбокатионы, свободные радикалы, например, аллильной структуры. Свободнорадикальные аллильные фрагменты играют важную роль в процессах пероксидого окисления липидов. В аллил-анионе CH2=CH-CH2 sр2-гибридизованный атом углерода С-3 поставляет в общую сопряженную систему два электрона, в аллильном радикале CH2=CH-CH2ˑ - один, а в аллильном карбокатионе CH2=CH-CH2+ не поставляет ни одного. В результате при перекрывании p-АО трех sp2-гибридизованных атомов углерода образуется делокализованная трехцентровая связь, содержащая четыре (в карбанионе), три (в свободном радикале) и два (в карбокатионе) электрона соответственно. 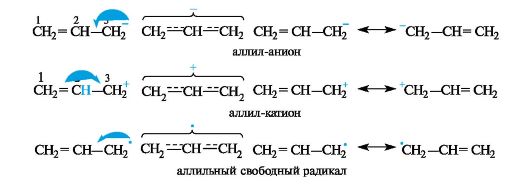 Формально атом С-3 в аллил-катионе несет положительный заряд, в аллильном радикале - неспаренный электрон, а в аллил-анионе - отрицательный заряд. В действительности в таких сопряженных системах имеется делокализация (рассредоточение) электронной плотности, что приводит к выравниванию связей и зарядов. Атомы С-1 и С-3 в этих системах равноценны. Например, в аллил-катионе каждый из них несет положительный заряд +1/2 и связан «полуторной» связью с атомом С-2. Таким образом, сопряжение приводит к существенному различию в распределении электронной плотности в реальных структурах по сравнению со структурами, изображаемыми обычными формулами строения.
Циклические сопряженные системы представляют большой интерес как группа соединений с повышенной термодинамической устойчивостью по сравнению с сопряженными открытыми системами. Эти соединения обладают и другими особыми свойствами, совокупность которых объединяют общим понятием ароматичность. К ним относятся способность таких формально ненасыщенных соединений вступать в реакции замещения, а не присоединения, устойчивость к действию окислителей и температуры. Типичными представителями ароматических систем являются арены и их производные. Особенности электронного строения ароматических углеводородов наглядно проявляются в атомно-орбитальной модели молекулы бензола. Каркас бензола образуют шесть sp2-гибридизованных атомов углерода. Все σ-связи (C-C и C-H) лежат в одной плоскости. Шесть негибридизованных р-АО расположены перпендикулярно плоскости молекулы и параллельно друг другу (рис. 3, а). Каждая р-АО в равной степени может перекрываться с двумя соседними р-АО. В результате такого перекрывания возникает единая делокализованная π-система, наибольшая электронная плотность в которой находится над и под плоскостью σ-скелета и охватывает все атомы углерода цикла (см. рис. 3, б). π-Электронная плотность равномерно распределена по всей циклической системе, что обозначается кружком или пунктиром внутри цикла (см. рис. 3, в). Все связи между атомами углерода в бензольном кольце имеют одинаковую длину (0,139 нм), промежуточную между длинами одинарной и двойной связей. На основании квантовомеханических расчетов установлено, что для образования таких стабильных молекул плоская циклическая система должна содержать (4n + 2) π-электронов, где n = 1, 2, 3 и т. д. (правило Хюккеля, 1931). С учетом этих данных можно конкретизировать понятие «ароматичность». Ароматические системы (молекулы) – системы, отвечающие критериям ароматичности:
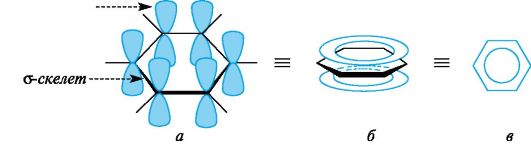 Рис. 3. Атомно-орбитальная модель молекулы бензола (атомы водорода опущены; объяснение в тексте) 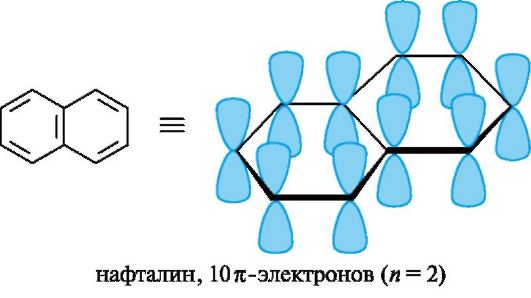 Устойчивость сопряженных систем. Образование сопряженной и особенно ароматической системы - энергетически выгодный процесс, так как при этом увеличивается степень перекрывания орбиталей и происходит делокализация (рассредоточение) р-электронов. В связи с этим сопряженные и ароматические системы обладают повышенной термодинамической устойчивостью. Они содержат меньший запас внутренней энергии и в основном состоянии занимают более низкий энергетический уровень по сравнению с несопряженными системами. По разнице этих уровней можно количественно оценить термодинамическую устойчивость сопряженного соединения, т. е. его энергию сопряжения(энергию делокализации). Для бутадиена-1,3 она невелика и составляет около 15 кДж/моль. С увеличением длины сопряженной цепи энергия сопряжения и соответственно термодинамическая устойчивость соединений возрастают. Энергия сопряжения для бензола гораздо больше и составляет 150 кДж/моль. Примеры небензоидных ароматических соединений:  Пиридин по электронному строению напоминает бензол. Все атомы углерода и атом азота находятся в состоянии sp2-гибридизации, и все σ-связи (C-C, C-N и C-H) лежат в одной плоскости (рис. 4, а). Из трех гибридных орбиталей атома азота две участвуют в образовании
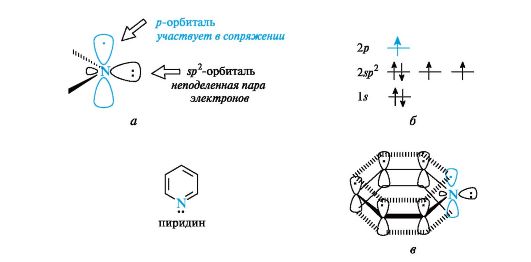 Рис. 4. Пиридиновый атом азота (а), распределение электронов по орбиталям (б) и сопряженная система в молекуле пиридина (в) (связи С-Н для упрощения рисунка опущены) σ-связей с атомами углерода (показаны только оси этих орбиталей), а третья орбиталь содержит неподеленную пару электронов и в образовании связи не участвует. Атом азота с такой электронной конфигурацией называют пиридиновым. За счет электрона, находящегося на негибридизованной р-орбитали (см. рис. 4, б), атом азота участвует в образовании единого электронного облака ср-электронами пяти атомов углерода (см. рис. 4, в). Таким образом, пиридин является π,π-сопряженной системой и удовлетворяет критериям ароматичности. В результате большей электроотрицательности по сравнению с атомом углерода пиридиновый атом азота понижает электронную плотность на атомах углерода ароматического кольца, поэтому системы с пиридиновым атомом азота называют π-недостаточными. Кроме пиридина, примером таких систем служит пиримидин, содержащий два пиридиновых атома азота. Пиррол также относится к ароматическим соединениям. Атомы углерода и азота в нем, как и в пиридине, находятся в состоянии sp2-гибридизации. Однако в отличие от пиридина атом азота в пирроле имеет иную электронную конфигурацию (рис. 5, а, б). 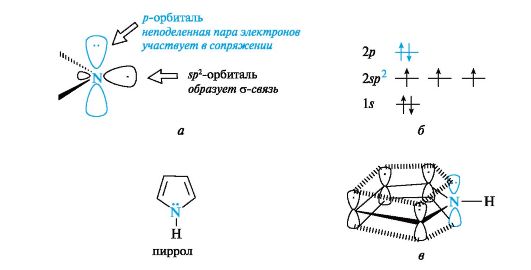 Рис. 5. Пиррольный атом азота (а), распределение электронов по орбиталям (б) и сопряженная система в молекуле пиррола (в) (связи С-Н для упрощения рисунка опущены) На негибридизованной р-орбитали атома азота находится неподеленная пара электронов. Она участвует в сопряжении с р-электрона- ми четырех атомов углерода с образованием единого шестиэлектронного облака (см. рис. 5, в). Три sp2-гибридные орбитали образуют три σ-связи - две с атомами углерода, одну с атомом водорода. Атом азота в таком электронном состоянии получил название пиррольного.
Шестиэлектронное облако в пирроле благодаря р,п-сопряжению делокализовано на пяти атомах цикла, поэтому пиррол представляет собой π-избыточную систему. В фуране и тиофене ароматический секстет также включает неподеленную пару электронов негибридизованной p-АО кислорода или серы соответственно. В имидазоле и пиразоле два атома азота вносят разный вклад в образование делокализованного электронного облака: пиррольный атом азота поставляет пару π-электронов, а пиридиновый - один p-электрон. 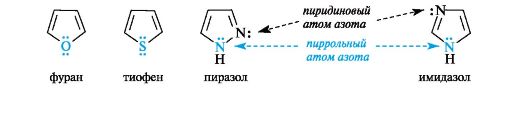 Ароматичностью обладает также пурин, представляющий собой конденсированную систему двух гетероциклов - пиримидина и имидазола. 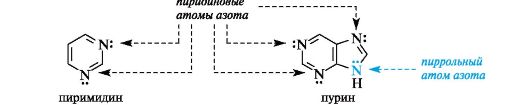 Делокализованное электронное облако в пурине включает 8 π-электронов двойных связей и неподеленную пару электронов атома N=9. Общее число электронов в сопряжении, равное десяти, соответствует формуле Хюккеля (4n + 2, где п = 2). Гетероциклические ароматические соединения обладают высокой термодинамической устойчивостью. Неудивительно, что именно они служат структурными единицами важнейших биополимеров - нуклеиновых кислот.
Элементы, входящие в состав органических соединений, имеют неодинаковую электроотрицательность. Электроотрицательность – это способность атома притягивать к себе электроны. Смещение электронной плотности в сторону более электроотрицательного атома называется поляризацией связи. Смещение электронной плотности вдоль σ-связей в зависимости от электроотрицательности атомов, образующих эти связи, получило название индуктивного эффекта. Этот эффект сохраняется не более, чем на 3-4 σ-связи. Графически он изображается прямой стрелкой, совпадающей с валентным штрихом, острие которой направленно в сторону более электроотрицательного элемента. Индуктивный эффект может быть положительным (+I), если электронная плотность в молекуле возрастает, или отрицательным (-I), если уменьшается электронная плотность в молекуле. Поляризация σ-связей ведёт к появлению частичных зарядов на атомах, обозначаемых буквой δ. Например: δ+ δ+ δ+ -δ СН3 → СН2→ СН2→ ОН Влияние заместителя, передаваемое по сопряженной системе π-связей с перераспределением электронной плотности называется мезомерным эффектом. Мезомерный эффект, в отличие от индуктивного, - незатухающий. Влияние заместителя приводит к сдвигу электронной плотности у всех атомов, участвующих в сопряжении, и, соответственно, появлению на них частичных зарядов. Мезомерный эффект также бывает положительным (+М) и отрицательным (-М). Графически мезомерный эффект изображают изогнутой стрелкой, острие которой направлено в сторону атома, к которому происходит смещение электронной плотности. Электронные эффекты заместителей
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
