Занятие 8 основные понятия биоорганической химии. Изомерия органических соединений
 Скачать 0.85 Mb. Скачать 0.85 Mb.
|
Таблица 1.2. Некоторые характеристические группы, обозначаемые только префиксами 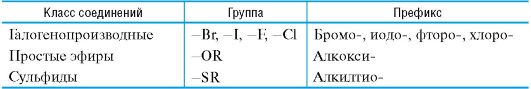 Таблица 1.3. Префиксы и суффиксы, применяемые для обозначения важнейших характеристических групп 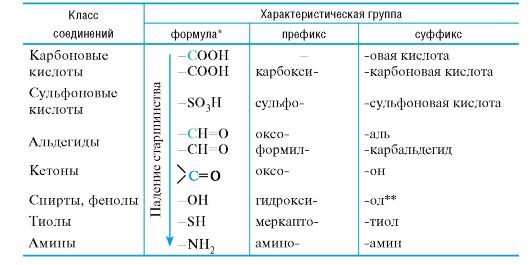 Правило 1. Выбор старшей характеристической группы. Выявляют все имеющиеся заместители. Среди характеристических групп определяют старшую группу (если она присутствует), используя шкалу старшинства (см. табл. 1.3). Правило 2. Определение родоначальной структуры. В качестве родо- начальной структуры в ациклических соединениях используют главную цепь атомов углерода, а в карбоциклических и гетероциклических соединениях - основную циклическую структуру. Главную цепь атомов углерода в ациклических соединениях выбирают по приведенным ниже критериям, причем каждый последующий критерий используют, если предыдущий не приводит к однозначному результату: • максимальное число характеристических групп, обозначаемых как префиксами, так и суффиксами; • максимальное число кратных связей; • максимальная длина цепи атомов углерода;
• максимальное число характеристических групп, обозначаемых только префиксами. Правило 3. Нумерация родоначальной структуры. Родоначальную структуру нумеруют так, чтобы старшая характеристическая группа получила наименьший локант. Если выбор нумерации неоднозначен, то применяют правило наименьших локантов, т.е. нумеруют так, чтобы заместители получили наименьшие номера. Правило 4. Название блока родоначальной структуры со старшей характеристической группой. В названии родоначальной структуры степень насыщенности отражают суффиксами: -ан в случае насыщенного углеродного скелета, -ен - при наличии двойной и -ин - тройной связи. К названию родоначальной структуры присоединяют суффикс, обозначающий старшую характеристическую группу. Правило 5. Названия заместителей (кроме старшей характеристической группы). Дают название заместителям, обозначаемым префиксами в алфавитном порядке. Положение каждого заместителя и каждой кратной связи указывают цифрами, соответствующими номеру атома углерода, с которым связан заместитель (для кратной связи указывают только наименьший номер). В русской терминологии цифры ставят перед префиксами и после суффиксов, например, 2-аминоэтанол H2NCH2CH2OH, бутадиен-1,3 СН2=СН-СН=СН2, пропанол-1 СН3СН2СН2ОН. Для иллюстрации этих правил ниже приведены примеры построения названий ряда соединений в соответствии с общей схемой 1.2. Схема 1.3. Построение систематического названия фторотана 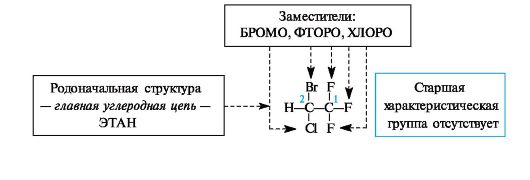 2- бромо-1,1,1-трифторо-2-хлороэтан (средство для ингаляционного наркоза)
Радикально-функциональная номенклатура Радикально-функциональная номенклатура используется реже, чем заместительная. В основном она применяется для таких классов органических соединений, как спирты, амины, простые эфиры, сульфиды и некоторых других. Для соединений с одной функциональной группой общее название включает название углеводородного радикала, а наличие функциональной группы отражают опосредованно через название соответствующего класса соединений, принятого в этом виде номенклатуры (табл. 1.4).  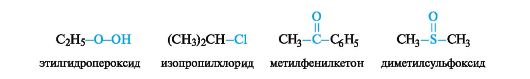
Конфигурация и конформация отражает пространственное строение, т. е. трехмерность молекулы. Конформации Вокруг простой связи С-С возможно свободное вращение, в результате которого молекула может принимать различные формы в пространстве. Это видно на стереохимических формулах этана (I) и (II), где отмеченные цветом группы СН3 расположены по-разному относительно другой группы СН3. 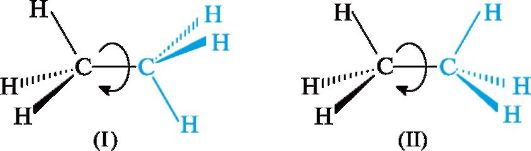 Поворот одной группы СН3 относительно другой происходит без нарушения конфигурации - изменяется лишь взаимное расположение в пространстве атомов водорода. Геометрические формы молекулы, переходящие друг в друга путем вращения вокруг σ-связей, называют конформациями. В соответствии с этим конформационнымиизомерами являются стереоизомеры, различие между которыми вызвано поворотом отдельных участков молекулы вокруг σ-связей. Конформационные изомеры обычно нельзя выделить в индивидуальном состоянии. Переход различных конформаций молекулы друг в друга происходит без разрыва связей. Конформации ациклических соединений Простейшим соединением со связью С-С является этан; рассмотрим две из множества его конформаций. В одной из них (рис. 7, а) расстояние между атомами водорода двух групп СН3 наименьшее, поэтому находящиеся друг против друга связи С-Н отталкиваются. Это приводит к увеличению энергии молекулы, а, следовательно, к меньшей устойчивости этой конформации. При взгляде вдоль связи С-С видно, что три связи С-Н у каждого атома углерода попарно «заслоняют» друг друга. Такую конформацию называют заслоненной.
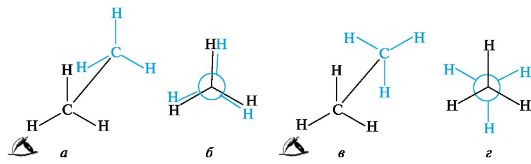 Рис. 7. Заслоненная (а, б) и заторможенная (в, г) конформации этана В другой конформации этана, возникающей при повороте одной из групп СН3 на 60° (см. рис. 7, в), атомы водорода двух метильных групп максимально удалены друг от друга. При этом отталкивание электронов связей С-Н будет минимальным, энергия такой конформации также будет минимальной. Эту более устойчивую конформацию называют заторможенной. Разница в энергии обеих конформаций невелика и составляет 12 кДж/моль; она определяет так называемый энергетический барьер вращения. Проекционные формулы Ньюмена. Эти формулы (проще - проекции Ньюмена) используют для изображения конформаций на плоскости. Для построения проекции молекулу рассматривают со стороны одного из атомов углерода вдоль его связи с соседним атомом углерода, вокруг которой происходит вращение. При проецировании три связи от ближнего к наблюдателю атома углерода к атомам водорода (или в общем случае - к другим заместителям) располагают в виде трехлучевой звезды с углами 120°. Удаленный от наблюдателя (невидимый) атом углерода изображают в виде круга, от которого также под углом 120° отходят три связи. Проекции Ньюмена также дают наглядное представление о заслоненной (см. рис. 7, б) и заторможенной (см. рис. 7, г) конформациях. При обычных условиях конформации этана легко переходят друг в друга, и можно говорить о статистическом наборе различных конформаций, незначительно различающихся по энергии. Выделить в индивидуальном виде даже более устойчивую конформацию невозможно. В более сложных молекулах замена атомов водорода при соседних атомах углерода на иные атомы или группы приводит к их взаимному отталкиванию, что сказывается на увеличении потенциальной энергии. Так, в молекуле бутана наименее выгодной будет заслоненная конформация, а самой выгодной - заторможенная конформация с максимально удаленными группами СН3. Разница между энергиями этих конформаций составляет 25 кДж/моль. У бутана при повороте относительно связи между вторым и третьим атомами углерода возникает дополнительно скошенная конформация (гош-конформация). Кроме этого, заслоненные конформации бутана отличаются энергетически. 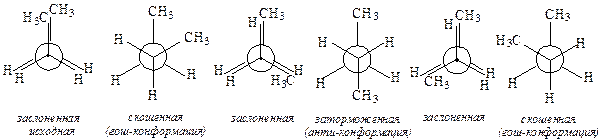 Заслоненная (исходная) конформация бутана характеризуется максимальной энергией, что обусловлено наличием торсионных и ван-дер-ваальсовых напряжений. Ван-дер-ваальсовы напряжения в этой конформации возникают из-за взаимного отталкивания объемных (в сравнении с атомом Н) метильных групп, оказавшихся сближенными. Такое взаимодействие увеличивает энергию конформации, делая ее энергетически невыгодной. При повороте на 60° возникает скошенная конформация, в которой нет торсионных напряжений (связи не заслоняют друг друга), а ван-дер-ваальсовы напряжения существенно уменьшаются за счет отдаления метильных групп друг от друга, поэтому энергия гош-конформации меньше на 22 кДж/моль энергии заслоненной конформации. При очередном повороте на 60° возникает заслоненная конформация, в которой, однако, имеют место только торсионные напряжения. Между атомом Н и группой СН3 не возникают ван-дер-ваальсовы напряжения вследствии незначительного размера атома Н. Энергия такой конформации меньше энергии исходной заслоненной конформации на 7,5 кДж/моль. Очередной поворот на 60° приводит к возникновению заторможенной конформации, в которой нет торсионных и ван-дер-ваальсовых напряжений, так как связи не заслоняют друг друга, а объемные метильные группы максимально удалены друг от друга. Энергия заторможенной конформации минимальна, меньше энергии исходной заслоненой конформации на 25,5 кДж/моль, а по сравнению с энергией скошенной конформации меньше на 3,5 кДж/моль. Последующие повороты приводят в возникновению заслоненной, скошенной и исходной заслоненной конформаций. При обычных условиях большинство молекул бутана находятся в виде смеси гош- и анти-конформеров.
Для циклогексана, как правильного шестиугольника, межъядерные углы составляют 120º. Если бы молекула циклогексана имела плоское строение, то отклонение от нормального валентного угла атома углерода составляло:109,5º–120º = 10,5º. Однако циклогексан и большие циклы имеют неплоское строение. В рассматриваемой молекуле циклогексана сохраняются обычные валентные углы при условии его существования в двух конформациях «кресла» и «ванны». Конформация «кресла» менее напряжена, поэтому циклогексан существует преимущественно в виде конформеров I и III, причем цикл претерпевает непрерывную инверсию (inversio – с латинского переворачивание, перестановка) с промежуточным образованием конформера II: 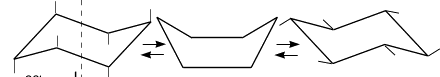 Ось симметрии I II III Двенадцать связей C–H, которые имеются у циклогексана в конформации «кресла», делятся на два типа. Шесть связей направлены радиально от кольца к периферии молекулы и называются экваториальными связями (e-связи), остальные шесть связей направлены параллельно друг другу и оси симметрии и называются аксиальными (a-связи). Три аксиальные связи направлены в одну сторону от плоскости цикла, а три – в другую (имеется чередование: вверх-вниз). Взаимное превращение этих конформаций, а также переход конформации кресла вконформацию ванныпроисходит через гибкие формы, известные под названиями полукреслаи «иска женной» ванны (твист-форма).При переходе от одной конформации к другой меняется потенциальная энергия системы. Максимум энергии соответствует конформации полукресла; минимальной энергией обладает конформация кресла. Шестичленный цикл с атомом кислорода, тетрагидропиран, имеет конформацию кресла. Алкильные заместители во всех позициях предпочтительно занимают экваториальное положение, напротив, α-алкоксильная группа (атом галогена и т.п.) стремится занять аксиальное положение. Этот эффект носит название аномерного, и обусловлен, по крайней мере частично, неблагоприятным диполь-дипольным взаимодействием атомов кислорода, когда алкоксигруппа находится в экваториальном положении. Такой же эффект проявляют и алкоксигруппы в четвёртом положении. 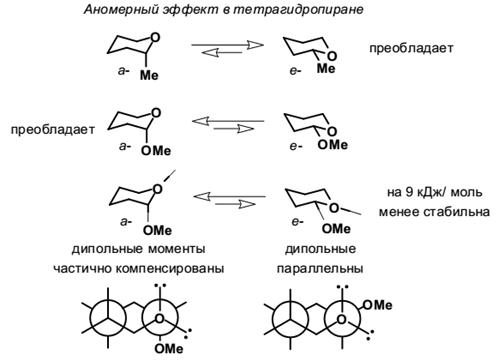 Иногда для лучшего понимания аномерного эффекта (эффект Ривса) рассматривают простые для восприятия, но не совсем корректные, проекционные формулы Ньюмена с аксильными и экваториальными неподелёнными парами атома кислорода.
Молекулы, обладающие одинаковым химическим строением, могут различаться пространственным строением, т.е. существовать в виде пространственных изомеров - стереоизомеров. Пространственное строение молекул - это взаимное расположение атомов и атомных групп в трехмерном пространстве. Стереоизомеры - соединения, в молекулах которых имеется одинаковая последовательность химических связей атомов, но различное расположение этих атомов относительно друг друга в пространстве. В свою очередь стереоизомеры могут быть конфигурационнымии конформационными изомерами, т. е. различаться соответственно конфи- гурацией и конформацией. Конфигурация - это порядок расположения атомов в пространстве без учета различий, возникающих вследствие вращения вокруг одинарных связей. Конфигурационные изомеры могут переходить друг в друга путем разрыва одних и образования других химических связей и могут существовать раздельно в виде индивидуальных соединений. Они подразделяются на два основных типа - энантиомерыи диастереомеры. Энантиомеры - стереоизомеры, относящиеся друг к другу, как предмет и несовместимое с ним зеркальное отображение. В виде энантиомеров могут существовать только хиральныемолекулы. Хиральность - это свойство объекта быть несовместимым со своим зеркальным отражением. Хиральными (от греч. cheir - рука), или асимметричными, объектами являются левая и правая рука, а также перчатки, ботинки и др. Эти парные предметы представляют собой объект и его зеркальное отражение (рис. 8, а). Такие предметы не могут быть полностью совмещены друг с другом. В то же время существует множество окружающих нас предметов, которые совместимы со своим зеркальным отражением, т. е. они являются ахиральными(симметричными), например тарелки, ложки, стаканы и т. д. Ахиральные предметы обладают, по крайней мере одной плоскостью симметрии, которая делит объект на две зеркально-идентичные части (см. рис. 8, б). Подобные взаимоотношения наблюдаются также в мире молекул, т. е. молекулы делятся на хиральные и ахиральные. У ахиральных молекул есть плоскости симметрии, у хиральных их нет. В хиральных молекулах имеется один или несколько центров хиральности. В органических соединениях в качестве центра хиральности чаще всего выступает асимметрический атом углерода. 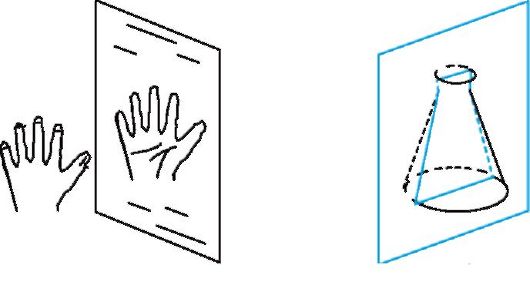 Рис. 8. Отражение в зеркале хирального объекта (а) и плоскость симметрии, разрезающая ахиральный объект (б) Асимметрическим является атом углерода, связанный с четырьмя различными атомами или группами. При изображении стереохимической формулы молекулы символ «С» асимметрического атома углерода обычно опускается. 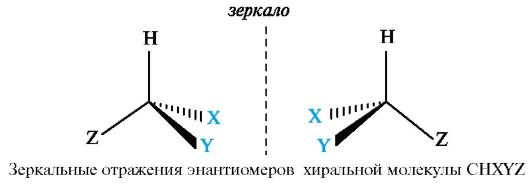 Чтобы определить, является молекула хиральной или ахиральной, нет необходимости изображать ее стереохимической формулой, достаточно внимательно рассмотреть все атомы углерода в ней. Если находится хотя бы один атом углерода с четырьмя разными заместителями, то этот атом углерода асимметричен и молекула за редкими исключениями хиральна. Так, из двух спиртов - пропанола-2 и бутанола-2 - первый ахирален (две группы СН3 у атома С-2), а второй - хирален, так как в его молекуле у атома С-2 все четыре заместителя разные (Н, ОН, СН3 и С2Н5). Асимметрический атом углерода иногда помечают звездочкой (С*).
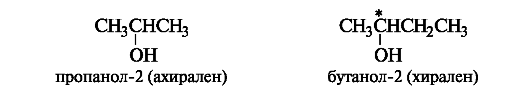 Следовательно, молекула бутанола-2 способна существовать в виде пары энантиомеров, которые не совмещаются в пространстве (рис. 9). 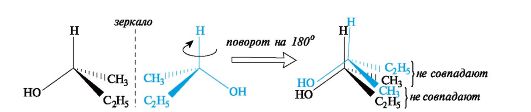 |
