Занятие 8 основные понятия биоорганической химии. Изомерия органических соединений
 Скачать 0.85 Mb. Скачать 0.85 Mb.
|
|
Понятия – субстрат, реагент, реакционный центр, продукт реакции, энергия активации, скорость реакции, механизм. Субстрат - химическое вещество, подвергающееся превращению под действием фермента. Реагент - это вещества, которые принимают участие в химической реакции, но при этом сами не являются объектом обработки. реакционный центр - атом, у которого происходит разрыв или образование связей. 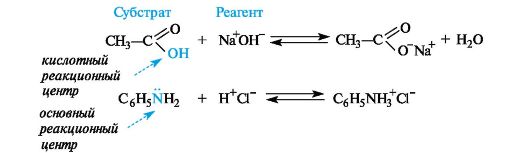 Продукт реакции – образующиеся в ходе реакции вещество. Энергия активации - минимальное количество энергии, которое требуется сообщить системе (выражается в джоулях на моль), чтобы произошла реакция. Скорость реакции - изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Механизм реакции - это детальное описание всех стадий химического процесса.
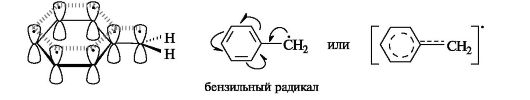
Типы реагентов: Радикальные реагенты(радикалы) - свободные атомы или частицы с неспаренным электроном. Примеры радикальных реагентов: гидроксильные НОˑ, гидропероксильные HOOˑ, алкильные Rˑ радикалы, атомы галогенов Сˑ, Brˑ. Электрофильные реагенты(электрофилы) - частицы, образующие новую ковалентную связь за счет электронной пары реакционного партнера. Электрофильные частицы обозначаются символом Е+ или Е. Они могут нести положительный заряд - протон Н+, карбокатионы R3C+, ацилий-катионы R-C=O - или быть электронейтральными, например триоксид серы SO3. Кислотные реагенты(кислоты) - полностью или частично ионизированные в водных растворах нейтральные молекулы (CH3COOH, HCl) либо положительно заряженные частицы (катионы аммония NH4+, гидроксония H3O+), способные быть донором протона для реакционного партнера. Нуклеофильные реагенты(нуклеофилы) - частицы, образующие новую ковалентную связь с реакционным партнером, предоставляя для этого свою электронную пару. Нуклеофильные частицы обозначаются символами Nu или Nu и могут быть отрицательно заряженными - гидрид-ион Н-, гидроксид-ион НО- , алкоксид-ион RO- , карбанион R3C- , хлорид-ион Cl- или быть электронейтральными. В этом случае их нуклеофильность обусловлена р- или π-электронами (NH3, H2O, CH2=CH2, C6H6). Термин «нуклеофил» применяется к частице, реагирующей с любым электрофильным реакционным партнером за исключением протона Н+. Основные реагенты(основания) - отрицательно заряженные частицы (НО-, RO-) или нейтральные молекулы (NH3, H2O), способные оторвать протон от кислотного реакционного центра. Основные реагенты обозначаются символами B- или B. В соответствии с характером разрыва связи в субстрате и природой реагента различают реакции радикальные и ионные. В радикальных, или гомолитических, реакциях(символ R) участвуют радикальные реагенты и происходит гомолитический разрыв ковалентной связи в субстрате. При гомолитическом, или свободнорадикальном, разрыве ковалентной связи (гомолизе)у каждого из ранее связанных атомов остается по одному электрону. В результате в качестве промежуточных частиц образуются радикальные реагенты, как показано ниже для молекулы X-Y (где X и Y обозначают ковалентно связанные атомы или группы атомов). 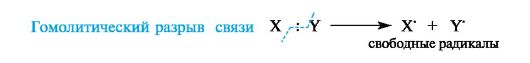 Ионные(гетеролитические) реакциисопровождаются гетеролитическим разрывом связи в субстрате. При таком разрыве (гетеролизе) ковалентной связи электронная пара, связывающая атомы, остается с одним из партнеров по связи. При этом образуются электрофильная и нуклеофильная частицы. 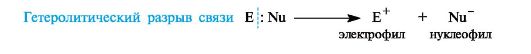 В качестве промежуточных частиц в гетеролитических реакциях принимают участие карбокатионы R3C+ и карбанионы R3C-. Свободные радикалы.Входящий в состав свободнорадикальных частиц атом углерода с неспаренным электроном находится в состоянии sр2-гибридизации и три его валентные связи лежат в одной плоскости. Неспаренный электрон занимает негибридизованную р-АО, расположенную перпендикулярно плоскости σ-связей (рис. 6). 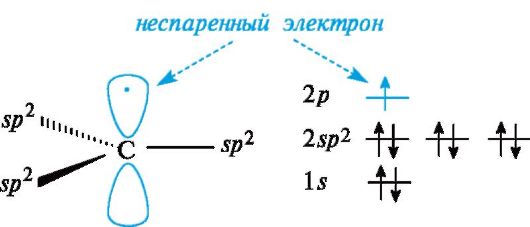 Рис. 6. Распределение электронов по орбиталям в свободном радикале Высокая реакционная способность свободных радикалов объясняется их стремлением достроить внешний электронный уровень до устойчивого октета. Алкильные радикалы - короткоживущие частицы. Их относительная устойчивость соответствует ряду: третичный > вторичный > первичный.  Это связывают с энергией разрыва соответствующей связи С-Н, которая составляет 414 кДж/моль в этане, 396 кДж/моль для группы в пропане и 376 кДж/моль для группы СН в 2-метилпропане. Стабильность свободных радикалов существенно возрастает, когда имеется возможность делокализации неспаренного электрона за счет участия π-электронов соседней двойной связи или бензольного кольца. Для систем с открытой цепью сопряжения наиболее типичным примером является аллильный радикал, а для систем с ароматическим циклом - бензильный радикал (одноэлектронные смещения обозначены стрелкой с одним острием).
По направлению (конечному результату) органические реакции делят на несколько основных типов: В случае реакций замещения в молекуле один атом (или группа атомов) замещается другим атомом (или группой атомов), в результате чего образуются новые соединения: СН3–СН3 + С12 → СН3–СН2С1 + НC1 При протекании реакций присоединения из двух (или нескольких) молекул образуется одно новое вещество: CH2 = CH2 + HBr → CH2Br–СH3 В результате реакции отщепления (элиминирования) образуется новое органическое вещество, содержащее кратную связь: СН3–СН2С1 + NaOH(спиртовой р-р) → СН2 = СН2 + NaC1 + Н2О Реакции разложения приводят к образованию из одного вещества двух или более веществ более простого строения: НСООН → СО2 + Н2 окислительно-восстановительные реакции. Процесс окисления включает переход электронов от органического субстрата к реагенту-окислителю, а процесс восстановления - передачу электронов от реагента к органическому субстрату. В органической химии более распространен иной подход к трактовке реакций окисления и восстановления. Под окислением понимают введение атома кислорода в молекулу субстрата или удаление двух атомов водорода, как, например, в следующих рядах: 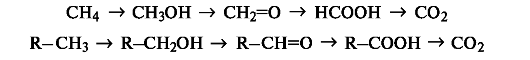 При таком подходе восстановление представляет собой обратный процесс, т.е. удаление атома кислорода или введение двух атомов водорода: В окислительно-восстановительных реакциях органических соединений, безусловно, меняется степень окисления атома углерода, являющегося реакционным центром. Учет изменения степени окисления, однако, может потребоваться только при необходимости расстановки коэффициентов в уравнении реакции. В то же время многие процессы, протекающие с изменением степени окисления атома углерода, такие, как дегидрирование (-СН2СН2- → -СН=СН-) или галогенирование (-СН3 - →СН2О), классифицируются не как реакции окисления.
Реакция перегруппировки (молекулярная перегруппировка) — химическая реакция, в результате которых происходит изменение взаимного расположения атомов в молекуле, места кратных связей и их кратности; могут осуществляться с сохранением атомного состава молекулы (изомеризация) или с его изменением. Классификация органических реакций по механизму: В радикальных реакциях реагент имеет неспаренный электрон и является свободным радикалом (Cl , R и др.). В ходе радикальных реакций связь в субстрате разрывается гомолитически, а новая связь образуется за счет неспаренного электрона свободного радикала и одного из электронов старой связи. Примером радикальных реакций может служить радикальное замещение (символ SR) в алканах: R-H + Cl• → R• + HCl R• + Cl-Cl → R-Cl + Cl• В ионных реакциях происходит гетеролитический разрыв связей в субстрате под действием электрофильного или нуклеофильного реагентов. В нуклеофильных реакциях реагент (нуклеофил) имеет на одном из атомовсвободную пару электронов и является нейтральной молекулой или анионом (Hal-, OH-, RO-, RS-, RCOO-, R-, CN-, H2O, ROH, NH3, RNH2 и др.). Все нуклеофилы – основания Льюиса. Нуклеофил атакует в субстрате атом с наименьшей электронной плотностью (т.е. с частичным или полным положительным зарядом). При этом новая связь образуется за счет электронной пары нуклеофила, а старая претерпевает гетеролитический разрыв. Примером нуклеофильной реакции может служить нуклеофильное замещение (символ SN) у насыщенного атома углерода: 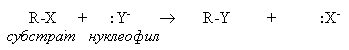 В электрофильных реакциях атакующий реагент (электрофил) имеет вакантную орбиталь и является нейтральной молекулой или катионом (Cl2, SO3, BF3, H+, Br+, R+, NO2+, и др.). Все электрофилы – кислоты Льюиса. Электрофил атакует в субстрате атом с наибольшей электронной плотностью, причем старая связь претерпевает гетеролитический распад, а образование новой связи происходит за счет пары электронов субстрата. Пример электрофильной реакции – электрофильное присоединение (символ AdE) к С=С связи: 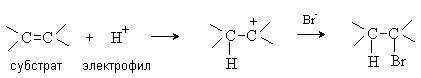 В согласованных реакциях разрыв старых и образование новых связей происходит одновременно. 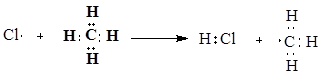
См. лекцию № 4.
В настоящее время общепринята систематическая номенклатура ИЮПАК (IUPAC - Международный союз теоретической и прикладной химии). Для использования систематической номенклатуры ИЮПАК необходимо знать содержание следующих номенклатурных терминов: • органический радикал; • родоначальная структура; • характеристическая группа; • заместитель; • локант. Органический радикал - остаток молекулы, из которой удаляются один или несколько атомов водорода и при этом остаются свободными одна или несколько валентностей. Углеводородные радикалы алифатического ряда имеют общее название - алкилы (в общих формулах обозначаются R), радикалы ароматического ряда - арилы (Ar). Два первых представителя алканов - метан и этан - образуют одновалентные радикалы метил СН3- и этил СН3СН2-. Названия одновалентных радикалов обычно образуются при замене суффикса -ан суффиксом -ил. Атом углерода, связанный только с одним атомом углерода (т. е. концевой), называют первичным, с двумя - вторичным, с тремя - третичным, с четырьмя - четвертичным.
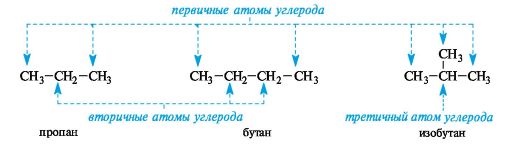 Каждый последующий гомолог из-за неравноценности атомов углерода образует несколько радикалов. При удалении атома водорода от концевого атома углерода пропана получают радикал н-пропил (нормальный пропил), а от вторичного атома углерода - радикал изопропил. Бутан и изобутан каждый образуют по два радикала. Буква н- (которую разрешается опускать) перед названием радикала указывает, что свободная валентность находится на конце неразветвленной цепи. Префикс втор- (вторичный) означает, что свободная валентность находится у вторичного атома углерода, а префикс трет- (третичный) - у третичного. 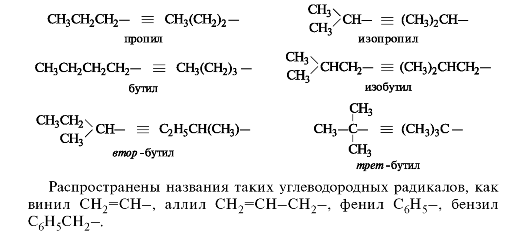 Родоначальная структура - химическая структура, составляющая основу называемого соединения. В ациклических соединениях в качестве родоначальной структуры рассматривается главная цепь атомов углерода, в карбоциклических и гетероциклических соединениях - цикл. Характеристическая группа - функциональная группа, связанная с родоначальной структурой или частично входящая в ее состав. Заместитель - любой атом или группа атомов, замещающие в органическом соединении атом водорода. 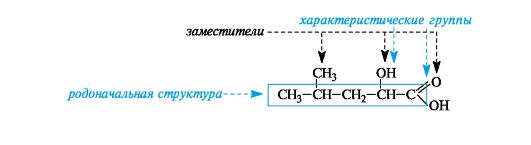 Локант (от лат. locus - место) цифра или буква, указывающая положение заместителя или кратной связи. Наиболее широко применяются два вида номенклатуры: заместительная и радикально-функциональная. Заместительная номенклатура Общая конструкция названия по заместительной номенклатуре представлена на схеме 1. Схема 1. Общая конструкция названия соединения по заместительной номенклатуре 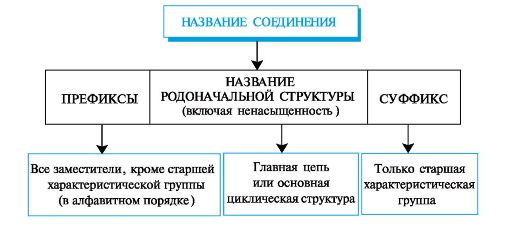 Название органического соединения представляет собой сложное слово, включающее название родоначальной структуры (корень) и названия разного типа заместителей (в виде префиксов и суффиксов), отражающих их природу, местонахождение и число. Отсюда и название этой номенклатуры - заместительная.
Заместители подразделяются на два типа: • углеводородные радикалы и характеристические группы, обозначаемые только префиксами (табл. 1.2); • характеристические группы, обозначаемые как префиксами, так и суффиксами в зависимости от старшинства (табл. 1.3). Для составления названия органического соединения по заместительной номенклатуре используют приводимую ниже последовательность правил. |
